Чем заменить инсулиновый шприц
Аналоги инсулина в клинической практике
Если бы не разрушительные последствия гипогликемии, лечение сахарного диабета было бы очень легким. Ф. Крейер Одним из самых древних, с позиции четких описаний симптомов, заболеваний является сахарный диабет (СД).
Если бы не разрушительные последствия гипогликемии,
лечение сахарного диабета было бы очень легким.
Ф. Крейер
Одним из самых древних, с позиции четких описаний симптомов, заболеваний является сахарный диабет (СД). Еще Гиппократ обращал внимание на сладкую мочу у молодых людей, резко худеющих, много пьющих и выделяющих жидкость и быстро погибающих по непонятным причинам. На протяжении многих столетий врачи только констатировали наличие данного заболевания, но помочь больному не могли. В 1921 г. доктора Ф. Бантинг и Г. Бест первыми получили экстракт из поджелудочной железы собак, который устранил гипергликемию и глюкозурию у таких пациентов. Через год были приготовлены первые коммерческие препараты инсулина. Но по-настоящему эра фармакологической «гонки» за лучший препарат инсулина началась только в 1953 г., когда Сангером была расшифрована химическая структура инсулина. За эти десятилетия фармакологический рынок инсулинов значительно изменился — от бычьих-свиных через генно-инженерные, к аналоговым инсулинам. О них и пойдет речь в данной статье.
СД является одним из самых распространенных среди эндокринопатий заболеваний. Основными задачами в лечении данной патологии являются поддержание нормального уровня гликемии и предотвращение возникновения и развития поздних осложнений, а также предупреждение гипогликемии.
В основе патогенеза данного заболевания лежат два эндокринных дефекта: нарушение продукции инсулина и периферическая резистентность к действию инсулина. Именно инсулинорезистентностью обусловлена избыточная печеночная продукция глюкозы, проявляющаяся, в частности, утренней гипергликемией. Создание и внедрение новых форм инсулина, обладающих улучшенными фармакокинетическими и фармакодинамическими свойствами, представляют собой один из способов добиться лучшего контроля гликемии и предупредить развитие гипогликемических состояний. Разработанная ранее схема интенсивной инсулинотерапии с использованием инсулинов длительного и средней продолжительности действия позволяет достичь относительной нормогликемии, но в то же время увеличивает риск развития гипогликемии как в дневное, так и в ночное время. Для инсулинов длительного и средней продолжительности действия характерна максимальная концентрация через 5–7 ч с момента введения, что повышает риск развития гипогликемии в ночные часы. Точность дозировок НПХ инсулина сильно варьирует из-за неадекватного ресуспендирования.
Действие человеческого инсулина короткого действия характеризуется медленным началом и большей продолжительностью по сравнению с эндогенным инсулином. Введение обоих препаратов (базис-болюсная терапия) сопровождается значительными колебаниями постпрандиальной гликемии и гликемии в ночное время. При создании аналогов инсулинов основной задачей было достижение максимальной приближенности по времени и интенсивности действия к эндогенному инсулину.
СД 2 типа — прогрессирующее заболевание. Фаза гиперсекреции инсулина сменяется фазой «истощения», в этот период возникает дефицит инсулина и пациент начинает нуждаться в инсулинотерапии.
Немало исследований посвящено изучению влияния гликемии на формирование поздних осложнений СД. В последнее время все больше внимания уделяется исследованию именно постпрандиальной гликемии. Многолетнее комплексное исследование NHANES (National Health and Nutrition Examination Surveys) в США показывает, что даже при удовлетворительной компенсации СД, по данным гликозилированного гемоглобина (НbА1с), часто встречается гипергликемия после еды. Европейское эпидемиологическое исследование DECODE (The Diabetes Epidemiology: Collaborative Analysis of Diagnostic Criteria in Europe) показало, что постпрандиальная гипергликемия более тесно коррелирует с увеличением общей смертности, чем тощаковая гипергликемия. Многочисленными исследованиями доказан возрастающий риск острых сосудистых нарушений на фоне постпрандиальной гипергликемии: значительно возрастает риск развития инфаркта миокарда и инсульта, которые обусловливают примерно 70% смертельных исходов у лиц, страдающих СД 2 типа.
Гипогликемия одно из самых распространенных и тяжелых осложнений лечения СД. По последним данным, гипогликемия соответствует уровню глюкозы в плазме венозной крови в пределах от 3,5 до 2,8 ммоль/л, при этом значимостью клинических проявлений гипогликемии, таких как выраженное потоотделение, тремор рук, головокружение, сильное чувство голода, нарушения эмоционального состояния, диабетологи пренебрегают.
Причинами возникновения данного состояния могут служить следующие факторы:
Современная наука достигла таких высот, что вчерашняя «мечта» — получение генно-инженерного человеческого инсулина и его широкое использование поставила перед разработчиками новую цель: получить инсулин с параметрами, превосходящими некоторые показатели человеческого инсулина. Ограничениями в применении человеческого инсулина короткого действия являются: медленное начало воздействия (пациент вынужден вводить его за 30–40 мин до еды), продолжительное действие, иногда до 12 ч (повышенный риск поздней гипогликемии). В начале 1980-х годов стала актуальной разработка аналогов инсулина, лишенных указанных выше недостатков. В отношении инсулинов короткого действия был максимально сокращен период полувыведения, что приблизило их к фармакодинамике нативного инсулина, инактивация которого происходит через 4–5 мин после поступления в портальную систему. Беспиковые аналоги инсулина способны постепенно и равномерно всасываться из подкожного депо и не вызывают ночных гипогликемий. Наиболее прогрессивные открытия последних лет: переход от кислых растворов инсулина к нейтральным, получение человеческих инсулинов с помощью ДНК-рекомбинантной технологии, создание аналогов человеческого инсулина, обладающих качественно новыми фармакологическими свойствами.
Аналоги модифицируют время действия человеческого инсулина для обеспечения физиологического подхода в инсулинотерапии и более удобны в использовании для пациента. Они дают возможность достичь баланса между достижением целевой гликемии и минимизацией риска гипогликемий.
Современные аналоги инсулина по длительности действия делятся на ультракороткие и пролонгированные. Имеются также комбинированные препараты аналогов, где представлена смесь ультракороткого и пролонгированного инсулина в фиксированном соотношении. К первым относятся: хумалог, ново- рапид пенфилл и апидра. К пролонгированным относятся лантус и левемир пенфилл. Комбинированные препараты — пенфилл, хумалог микс 25.
Инсулин лизпро (хумалог). В структуре хумалога изменена позиция лизина и пролина в 28-м и 29-м положении В-цепи соответственно, что сопровождается значительно более слабой спонтанной межмолекулярной ассоциацией, чем у растворимого человеческого инсулина. В силу этого хумалог намного быстрее всасывается из мест подкожных инъекций.
Изучение концентраций инсулина при введении человеческого короткого инсулина и хумалога здоровым добровольцам показало, что при назначении препаратов в одинаковой дозе и в одно и то же время достигается пиковая концентрация хумалога быстрее и при этом оказывается в 2 раза выше по сравнению с человеческим инсулином. Кроме того, препарат быстрее элиминируется и через 4 ч концентрация хумалога возвращается к исходным значениям, в то время как концентрация простого человеческого инсулина сохраняется в пределах 6 ч.
При сравнении аналога инсулина лизпро и инсулина короткого действия было отмечено, что хумалог значительно сильнее подавляет продукцию глюкозы печенью (рис. 1).
Это больше соответствует физиологическому раннему пику секреции инсулина. Таким образом, хумалог вызывает более выраженное снижение риска развития стойкой постпрандиальной гипергликемии.
Еще одно преимущество инсулина лизпро над простым человеческим инсулином короткого действия, по существу делающим действие инсулина более предсказуемым, а следовательно, облегчающим процесс адаптации дозы к пищевой нагрузке, — это отсутствие изменения длительности действия препарата в зависимости от увеличения дозы. Хорошо известно, что при применении простых человеческих инсулинов длительность их действия может увеличиваться от дозы, отсюда и средняя продолжительность действия — 6–8 ч, а иногда и до 12 ч (рис. 2). Проведенное исследование показало, что при увеличении дозы инсулина лизпро длительность действия его практически не изменяется и составляет максимум 5 ч, тогда как время действия простого инсулина сильно увеличивается при более высоких дозах. Таким образом, повышение дозы инсулина лизпро не повышает риска развития поздних гипогликемий.
Инсулин аспарт (новорапид пенфилл). Новорапид был получен путем замены пролина в 28-м положении В-цепи на аспарагин, что также способствовало ускорению диссоциации гексамеров инсулина на мономеры, быстрому их всасыванию из подкожно-жировой клетчатки.
Этот препарат инсулина более адекватно имитирует нормальный инсулиновый ответ на прием пищи. Присущий ему короткий период активности обусловливает слабый эффект между приемами пищи, что позволяет добиться более полного контроля гликемии после еды.
Результаты сравнительного действия базально-болюсной терапии аналогами инсулина (инсулина детемира и инсулина аспарта) с традиционными человеческими инсулинами (НПХ-инсулин и человеческим инсулином короткого действия) продемонстрировали значительное повышение качества контроля постпрандиальной гликемии (рис. 3).
Данное исследование продемонстрировало, что комбинированная терапия инсулинами детемир и аспарт позволяет практически полностью нормализовать суточный профиль гормона, улучшить показатель гликозилированного гемоглобина, существенно снизить риск развития гипогликемии, отмечено значительное уменьшение количества пиков и амплитуды колебания концентрации глюкозы крови. Средняя масса тела пациентов, находившихся на базально-болюсной терапии аналогами инсулина (детемир и аспарт), характеризовалась достоверно меньшим приростом за время динамического наблюдения.
Инсулин глулизин (апидра). Апидра представляет собой аналог человеческого инсулина ультракороткого действия, в котором в 3-м положении В-цепи аспарагин заменен на лизин, а в 29-м положении В-цепи лизин заменен на глутамин. По фармакодинамическим и фармакокинетическим свойствам, а также по своей биодоступности инсулин глулизин соответствует хумалогу, а по митогенной и метаболической активности не отличается от простого человеческого инсулина, что позволяет безопасно и длительно его использовать.
В обычном режиме апидру необходимо использовать в сочетании с инсулином длительного действия или аналогом базального инсулина. Aпидра характеризуется более быстрым началом и меньшей продолжительностью действия, чем обычный человеческий инсулин (регуляр), и позволяет пациентам с СД проявлять большую гибкость при применении инсулина во время приема пищи, нежели обычный инсулин регуляр. Препарат начинает действовать непосредственно после введения. При этом уровень глюкозы начинает снижаться через 10–20 мин после подкожного введения препарата. Для предотвращения гипогликемических состояний у пожилых людей рекомендуется вводить препарат сразу после приема пищи или непосредственно во время еды.
Короткое время действия препарата (3 ч) позволяет избежать эффекта «наложения»; таким образом предотвращается развитие гипогликемических состояний. Препарат может применяться у лиц с избыточной массой тела, так как его применение не сопровождается дальнейшей прибавкой в весе. Препарат характеризуется более быстрым наступлением пика действия по сравнению с инсулином регуляр и даже с инсулином лизпро.
Апидра обеспечивает большую гибкость в применении у тех пациентов, у которых индекс массы тела варьирует от показателей избыточного веса до выраженного ожирения. Висцеральное ожирение может влиять на скорость всасывания инсулина, делая прандиальный гликемический контроль затруднительным.
Инсулин детемир (левемир пенфилл). Левемир пенфилл является аналогом человеческого инсулина средней продолжительности действия, не имеет пиков действия и обеспечивает базальный гликемический контроль в течение 24 ч при двукратном введении. После подкожного введения детемир формирует ди-гексамеры, которые посредством С14-цепи жирной кислоты связываются с сывороточным альбумином уже в интерстициальной жидкости. После переноса через капиллярную стенку препарат повторно связывается с альбумином в циркулирующей крови. Поскольку биологически активной является только свободная фракция детемира, то связывание ее с альбумином и последующая медленная диссоциация обеспечивают пролонгированное и беспиковое действие. Левемир пенфилл характеризуется плавным действием и обеспечивает потребность больного в базальном инсулине. Он не требует встряхивания непосредственно перед введением [14, 20].
Инсулин гларгин (лантус). Препарат ультрадлинного действия — лантус — был получен путем замены аспарагина в 21-м положении А-цепи на глицин, кроме этого были добавлены две молекулы аргинина в С-конец В-цепи в положении 31 и 32. Данные изменения привели к смещению изоэлектрической точки молекулы с рН 5,4 до 6,7, следовательно уменьшилась растворимость препарата при физиологических значениях нейтральной среды подкожной клетчатки. Таким образом, лантус полностью растворим в слабокислой среде, но плохо растворим в нейтральной среде подкожно-жировой клетчатки. После введения лантус вступает в реакцию нейтрализации с образованием микропреципитатов, из которых в дальнейшем происходит высвобождение гексамеров инсулина гларгина и их диссоциация с образованием димеров и мономеров инсулина. Это обеспечивает постепенный выход гормона в кровь и его циркуляцию в кровеносном русле в течение 24 ч, что позволяет вводить его 1 раз в сутки. Добавление небольшого количества цинка обеспечивает кристаллизацию инсулина гларгина в подкожной клетчатке, дополнительно удлиняя время абсорбции.
Все перечисленные особенности данного аналога инсулина обусловливают его плавный «беспиковый» профиль действия. Начало действия после подкожного введения — через 1 ч, устойчивая концентрация инсулина в крови достигается через 2–4 сут после первого введения первой дозы. Независимо от времени введения лантуса (утром или вечером) и места введения (подкожная клетчатка руки, ноги или живота), средняя продолжительность действия составляет 24 ч [5], максимальная продолжительность — 29 ч. Аналог инсулина гларгин соответствует по эффективности воздействия физиологическому инсулину: стимулирует потребление глюкозы инсулинозависимыми периферическими тканями, особенно мышечной и жировой, ингибирует глюконеогенез, таким образом, снижает содержание глюкозы крови. Кроме того, инсулин гларгин, подобно эндогенному инсулину, подавляет липолиз в адипоцитах и протеолиз, усиливая синтез белка (рис. 4).
В исследованиях фармакокинетики лантуса доказано практически беспиковое распределение препарата, что позволяет максимально точно имитировать «базальную» секрецию эндогенного инсулина в течение суток, значительно снижает риск гипогликемии и вариабельность концентрации глюкозы. Сравнение фармакокинетики инсулина лантус, НПХ-инсулина и инсулина ультраленте представлено на рисунке 5.
Назначение пролонгированных аналогов инсулина оправдано как при СД 1 типа, так и при СД 2 типа. Основное отличие данных препаратов в отсутствии прироста массы тела на фоне проводимой терапии и снижении количества ночных гипогликемий. Немаловажной является необходимость введения данного аналога инсулина однократно в сутки. Было проведено немало исследований, доказывающих эффективность и безопасность данного препарата. Среди них стоит отметить LANMET по применению аналога инсулина гларгин в сочетании с метформином у пациентов, страдающих СД 2 типа и ожирением [5]. Данное исследование выявило значительное снижение ночных гипогликемий, что достоверно позволяет нормализовать уровень суточной гликемии.
Также имеется ряд работ, посвященных сочетанной терапии лантусом и пероральными сахароснижающими препаратами (ПССП) у декомпенсированных пациентов. Авторы этих работ подтвердили сделанные прежде выводы и доказали целесообразность более раннего назначения инсулина гларгин [6, 9, 19]. Более позднее исследование ATLANTUS продемонстрировало возможность начала терапии лантусом как при лечении у врача эндокринолога, так и у врача общей практики. В Московском исследовании, проведенном под руководством М. Б. Анциферова, было показано, что интенсификация исходной терапии (ПССП, НПХ-инсулин) с добавлением лантуса позволяет улучшить контроль гликемии во всех группах [1].
Хумалог микс 25. Хумалог микс 25 — смесь, состоящая из 75% протаминизированной суспензии инсулина лизпро и 25% инсулина лизпро (хумалог). Данный аналог инсулина является препаратом с комбинированным по времени механизмом выделения. Среднюю продолжительность действия обеспечивает протаминизированная суспензия инсулина лизпро, что имитирует базальную секрецию инсулина, а 25% инсулина лизпро является компонентом с ультракоротким действием и снижает уровень гликемии после еды. Важно знать, что хумалог в смеси действует гораздо быстрее по сравнению с инсулином короткого действия, обеспечивает лучший контроль постпрандиальной гликемии [18] и, таким образом, более физиологический профиль по сравнению с инсулином короткого действия [4, 3, 10, 15, 18]. Миксты инсулинов рекомендованы для применения у пациентов, страдающих СД 2 типа. К данной группе относятся люди старшего возраста и, в большинстве своем, имеющие сниженную память. Поэтому возможность ввести инсулин непосредственно перед едой или сразу после еды крайне важна для них и значительно улучшает качество их жизни. В исследовании, проведенном у больных СД 2 типа в возрастной группе 60–80 лет с применением хумалога микс 25 в режиме введения непосредственно перед едой и после еды удалось достичь хорошей компенсации углеводного обмена при небольшом приросте веса и достаточно низкой частоте гипогликемии [7].
 |
| Рисунок 6. Сравнение эффективности хумалога микс 25 и лантуса у пациентов, получающих метформин |
Исследования, посвященные сравнению действия хумалога микс 25 и хумулина М3, показали, что аналоговый инсулин снижает колебания постпрандиальной гликемии на 40% эффективнее, чем готовая смесь человеческого инсулина [2]; кроме того, сахароснижающий эффект не зависел от времени приема пищи. Последнее было подтверждено в ходе очень интересного и оригинального исследования, проведенного с участием пациентов, соблюдавших мусульманский пост Рамадан. В период данного поста по религиозным законам пищу можно принимать только после захода солнца и до его восхода. Таким образом, пациенты имели возможность принимать еду дважды в день. Больные получали хумалог микс 25 непосредственно перед едой или хумулин М3 за 30–40 мин до еды. Суточное мониторирование уровня гликемии показало, что более низкие показатели постпрандиальной гликемии и гликемии перед вечерним введением препарата были в группе пациентов, получавших хумалог микс 25. Утренние показатели гликемии достоверно не отличались [11]. Данная работа доказывает, что лизпро, входящий в состав данного аналога, более физиологично корректирует уровень постпрандиальной гликемии. В 2004 г. было проведено 32-недельное рандомизированное открытое перекрестное исследование по сравнению действия хумалога микс 25 (вводили 2 раза в день) и аналога пролонгированного инсулина лантус (вводили 1 раз в день) на фоне приема метформина (рис. 6, 7).
Достоверных отклонений в колебании гликемии после обеда не было выявлено, но отмечалось достоверное снижение колебаний уровня гликемии после завтрака на 65% и после ужина на 70% на фоне применения хумалога микс 25. В этой же группе была выше частота легкой гипогликемии [12]. Работа по изучению сравнительных влияний данных аналогов была продолжена в исследовании, которое подтвердило снижение колебания уровня глюкозы на фоне хумалога микс 25 на 25%. Тяжелой гипогликемии не было зарегистрировано ни в одном исследовании [13].
 |
| Рисунок 7. Сравнение частоты гипогликемий при лечении хумалогом и лантусом |
Доза инсулина зависит от уровня гликемии, уровня НbА1c, массы тела. Начинать инсулинотерапию необходимо с малых доз для предотвращения гипогликемий. Согласно рекомендации Федеральной целевой программы «Сахарный диабет», 12 Ед инсулина следует вводить перед завтраком и 8 Ед — перед ужином, под контролем гликемии, при необходимости дозировка увеличивается по 2–4 Ед через 2–3 дня. Если пациент ранее получал хумулин М3, то начальная доза хумалога микс 25 будет 1 : 1. Чем больше избыточный вес у пациента, тем более выражена инсулинорезистентность и тем выше потребность в дозах инсулина. Начальная доза у таких больных составляет 0,4–0,8 Ед/кг/сут. Обычно аналог инсулина хумалог микс 25 требует, чтобы соблюдалось соотношение 50 : 50 применительно к утреннему/вечернему введению.
Литература
А. М. Мкртумян, доктор медицинских наук, профессор
А. Н. Оранская, кандидат медицинских наук
МГМСУ, Москва
Техника инъекций и средства введения инсулина
Начало практического применения инсулина почти 85 лет тому назад остается одним из немногих событий, значение которых не оспаривается и современной медициной. С тех пор многие миллионы нуждающихся в инсулине больных
Начало практического применения инсулина почти 85 лет тому назад остается одним из немногих событий, значение которых не оспаривается и современной медициной. С тех пор многие миллионы нуждающихся в инсулине больных во всем мире были спасены от смерти в результате диабетической комы. Пожизненное заместительное лечение инсулином стало основным условием выживания больных диабетом 1 типа, оно также играет большую роль в терапии определенной части больных диабетом 2 типа. В первые годы существовало достаточно много проблем, связанных с получением препарата, техникой его введения, изменением доз, но постепенно все эти вопросы были решены. Сейчас каждому больному диабетом с потребностью в инсулине вместо фразы «Мы вынуждены колоть инсулин», следовало бы говорить: «Мы имеем возможность колоть инсулин». В последние годы интерес к возможностям совершенствования инсулинотерапии, т. е. приближения к физиологическим условиям, постоянно растет. Определенную роль здесь играют не только установка на уменьшение ограничений в образе жизни и улучшение качества жизни, но и признание необходимости коренных преобразований, направленных на улучшение метаболического контроля. Дж. Дж. Р. Маклеод (ассистенты которого — Фредерик Бантинг и Чарльз Бест — в 1921 г. открыли инсулин) писал в своей книге «Инсулин и его применение в лечении диабета»: «Чтобы больной мог доверить самому себе свою собственную жизнь, ему нужно отлично овладеть определением дозы и введением инсулина. » Эта фраза актуальна и по сей день, поскольку замены подкожному введению инсулина в обозримом будущем не предвидится.
В связи с этим очень важно правильно использовать инсулин и современные средства его введения, к которым относятся шприцы, шприц-ручки, носимые инсулиновые помпы.
Хранение инсулина
Как у любого лекарственного препарата, длительность хранения инсулина ограничена. На каждом флаконе обязательно указывается срок годности препарата. Запас инсулина необходимо хранить в холодильнике при температуре + 2. +8 °С (ни в коем случае не замораживать). Флаконы с инсулином или шприц-ручки, которые используются для ежедневных инъекций, могут храниться при комнатной температуре в течение 1 мес. Также нельзя допускать перегревания инсулина (например, запрещено оставлять его на солнце или летом в закрытой машине). После инъекции обязательно следует убирать флакон инсулина в бумажную упаковку, поскольку активность инсулина снижается под воздействием света (шприц-ручка закрывается колпачком). Не рекомендуется при перевозке запаса инсулина (во время отпуска, командировки и т. д.) сдавать его в багаж, так как он может потеряться, разбиться, замерзнуть или перегреться.
Инсулиновые шприцы
Стеклянные шприцы неудобны (требуют стерилизации) и не могут обеспечить достаточно точную дозировку инсулина, поэтому сегодня они практически не применяются. При использовании пластиковых шприцев рекомендуются шприцы со встроенной иглой, позволяющей устранить так называемое «мертвое пространство», в котором в обычном шприце со съемной иглой после инъекции остается некоторое количество раствора. Таким образом, при каждом введении теряется определенное количество препарата, что, учитывая масштабы заболеваемости диабетом, оборачивается огромными экономическими потерями. Пластиковые шприцы вполне можно использовать неоднократно, при условии, что с ними обращаются правильно, соблюдая правила гигиены. Желательно, чтобы цена деления инсулинового шприца была не более 1 ЕД, а для детей — 0,5 ЕД.
Концентрация инсулина
Пластиковые шприцы выпускаются для инсулина с концентрацией 40 ЕД/мл и 100 ЕД/мл, поэтому при получении или покупке новой партии шприцев следует обращать внимание на их шкалу. Больных, отправляющихся в поездку за рубеж, также стоит предупредить о том, что в большинстве стран используется только инсулин с концентрацией 100 ЕД/мл и соответствующие шприцы. В России в настоящее время встречается инсулин в обеих концентрациях, хотя ведущие мировые производители инсулина поставляют его в концентрации 100 ЕД в 1 мл.
Набор инсулина в шприц
Последовательность действий при наборе инсулина с помощью шприца следующая:
Смешивание инсулинов в одном шприце
Возможность смешивания инсулинов короткого и продленного действия в одном шприце зависит от вида пролонгированного инсулина. Смешивать можно только те инсулины, в которых использован белок (НПХ-инсулины). Нельзя смешивать появившиеся в последние годы аналоги человеческого инсулина. Целесообразность смешивания инсулинов объясняется возможностью уменьшения числа инъекций. Последовательность действий при наборе в один шприц двух инсулинов следующая:
Техника инъекций инсулина
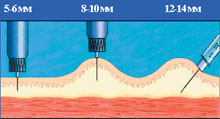 |
| Рисунок 1. Введение инсулина иглами различной длины |
Скорость всасывания инсулина зависит от того, куда вводится игла. Инъекции инсулина должны всегда осуществляться в подкожный жир, но не внутрикожно и не внутримышечно (рис. 1). Оказалось, что толщина подкожной клетчатки у лиц с нормальным весом, особенно у детей, часто меньше длины стандартной инсулиновой иглы (12–13 мм). Как показывает опыт, очень часто больные не формируют складку и делают инъекцию под прямым углом, что приводит к попаданию инсулина в мышцу. Это подтвердили специальные исследования с использованием ультразвуковой аппаратуры и компьютерной томографии. Периодическое попадание инсулина в мышечный слой может приводить к непредсказуемым колебаниям уровня гликемии. Для того чтобы избежать вероятности проведения внутримышечной инъекции, следует использовать короткие инсулиновые иглы — длиной 8 мм (Бектон Дикинсон Микрофайн, Новофайн, Дизетроник). Кроме того, эти иглы являются и самыми тонкими. Если диаметр стандартных игл составляет 0,4; 0,36 или 0,33 мм, то диаметр укороченной иглы — всего лишь 0,3 или 0,25 мм. Это особенно актуально для детей, поскольку такая игла практически не вызывает болезненных ощущений. В последнее время предлагаются и более короткие (5–6 мм) иглы, которые чаще применяют у детей, но дальнейшее уменьшение длины увеличивает вероятность внутрикожного попадания.
Для того чтобы сделать инъекцию инсулина, необходимо следующее:
Области инъекций инсулина
Для инъекций инсулина используются несколько областей: передняя поверхность живота, передняя поверхность бедер, наружная поверхность плеч, ягодицы (рис. 3). Делать инъекцию самому себе в плечо не рекомендуется, так как при этом невозможно сформировать складку, а значит, увеличивается риск внутримышечного введения инсулина. Следует знать, что инсулин из различных областей тела всасывается с разной скоростью (например, быстрее всего из области живота). Поэтому перед приемом пищи рекомендуется вводить инсулин короткого действия в эту область. Инъекции пролонгированных препаратов инсулина можно делать в бедра или ягодицы. Место инъекции должно быть каждый день новым, в противном случае возможны колебания уровня сахара крови.
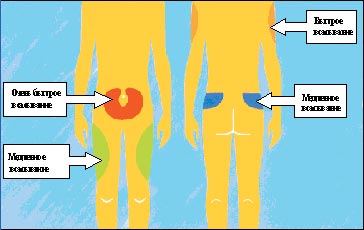 |
| Рисунок 3. Области инъекций инсулина |
Следует следить также за тем, чтобы в местах инъекций не появлялись изменения — липодистрофии, которые ухудшают всасывание инсулина (см. ниже). Для этого необходимо чередовать места инъекций, а также отступать от места предыдущей инъекции не менее чем на 2 см.
Шприц-ручки
В последние годы, наряду с пластиковыми инсулиновыми шприцами, все большее распространение получают полуавтоматические дозаторы инсулина, так называемые шприц-ручки. Их устройство напоминает чернильную авторучку, в которой вместо резервуара с чернилами находится картридж с инсулином, а вместо пера — одноразовая инсулиновая игла. Подобные «ручки» выпускаются сейчас практически всеми зарубежными производителями инсулинов (Ново Нордиск, Эли Лилли, Авентис), а также производителями медицинского оборудования (Бектон Дикинсон). Исходно они были разработаны для больных с нарушением зрения, которые не могли самостоятельно набрать инсулин в шприц. В дальнейшем их стали использовать все больные сахарным диабетом, так как они позволяют повысить качество жизни больного: отпадает необходимость носить с собой флакон с инсулином и набирать его шприцем. Особенно это значимо при современных режимах интенсифицированной инсулинотерапии, когда в течение дня больному приходится делать инъекции многократно (рис. 4).
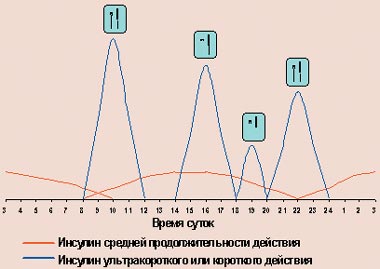 |
| Рисунок 4. Режим интенсифицированной инсулинотерапии с помощью многократных инъекций |
Однако освоить технику инъекций с помощью шприц-ручки несколько сложнее, поэтому больные должны тщательно изучить инструкцию по использованию и строго придерживаться всех указаний. Один из недостатков шприц-ручек также состоит в том, что, когда в картридже остается небольшое количество инсулина (меньше нужной больному дозы), многие пациенты просто выбрасывают такой картридж и вместе с ним инсулин. Кроме того, если больной вводит инсулины короткого и продленного действия в индивидуально подобранном соотношении (например, при интенсифицированной инсулинотерапии), то он лишен возможности смешать и ввести их вместе (как в шприце): приходится вводить их раздельно двумя «ручками», таким образом увеличивается число инъекций. Как и в случае с инсулиновыми шприцами, важное требование к инъекторам — возможность дозировать кратно 1 ЕД, а для маленьких детей — кратно 0,5 ЕД. Перед инъекцией пролонгированного инсулина нужно произвести 10–12 поворотов ручки на 180° для того, чтобы шарик, находящийся в картридже, равномерно перемешал инсулин. Наборным кольцом ставится необходимая доза в окошке корпуса. Введя иглу под кожу так, как было описано выше, следует нажать на кнопку до упора. Через 7–10 с (!) вынуть иглу.
Самой первой шприц-ручкой была Новопен, созданная в 1985 г. Необходимая доза с ее помощью вводилась дискретно, так как с каждым нажатием кнопки можно было ввести только 1 или 2 ЕД.
Следующие поколения шприц-ручек позволяли вводить всю дозу сразу, предварительно определив ее. В настоящее время в России используются шприц-ручки, в которые вставляется картридж объемом 3 мл (300 ЕД инсулина). К ним относятся Новопен 3, Хумапен, Оптипен, Инново.
Новопен 3 предназначена для введения инсулинов компании Ново Нордиск. Шприц-ручка имеет корпус, изготовленный из пластика и металла. Она позволяет одномоментно ввести до 70 Ед инсулина, при этом шаг введения — 1 ЕД. Кроме классического варианта серебристой окраски выпускаются разноцветные шприц-ручки (чтобы не путать разные инсулины). Для детей имеется модификация Новопен 3 Деми, которая позволяет вводить инсулин с кратностью дозы 0,5 ЕД.
Шприц-ручка Хумапен предназначена для введения инсулинов компании Эли Лилли. Ручка очень проста в использовании, можно легко перезарядить картридж (за счет специального механизма), а также скорректировать неправильно набранную дозу. Корпус устройства полностью пластиковый, что облегчает его вес, а специально разработанный эргономичный дизайн корпуса делает его удобным для руки во время инъекции. Цветовые вставки на корпусе предназначены для использования различных инсулинов. Хумапен позволяет одномоментно ввести до 60 ЕД инсулина, шаг вводимой дозы — 1 ЕД.
Шприц-ручка Оптипен предназначена для введения инсулинов компании Авентис. Основное ее отличие от других моделей — наличие жидкокристаллического дисплея, на котором отображается доза для введения. Чаще всего на российском рынке встречается вариант Оптипен Про 1. Он позволяет одномоментно ввести до 60 ЕД инсулина, цифра «1» означает, что шаг вводимой дозы — 1 ЕД. Еще одним преимуществом данной модели является тот факт, что невозможно установить дозу больше, чем остается инсулина в картридже.
В 1999 г. компания Ново Нордиск выпустила новую шприц-ручку Инново. За счет специального механизма была уменьшена длина устройства. Как и у Оптипена, доза отображается на жидкокристаллическом дисплее. Но главное отличие от всех предыдущих модификаций в том, что Инново показывает время, прошедшее с момента последней инъекции, и запоминает последнюю дозу инсулина. Также электронная система контроля гарантирует точное введение набранной дозы. Диапазон вводимых доз — от 1 до 70 ЕД, шаг дозирования — 1 ЕД. Установленная доза может быть увеличена или уменьшена простым поворотом дозатора вперед или назад без потери инсулина. Невозможно установить больше дозу, чем остается инсулина в картридже.
Смена игл
Поскольку больному, находящемуся на инсулинотерапии, за свою жизнь приходится делать огромное количество инъекций, большое значение приобретает качество инсулиновых игл. Для того чтобы обеспечить как можно более комфортное введение инсулина, производители постоянно делают иглы тоньше, короче, острее. Чтобы сделать введение инсулина практически безболезненным, острие иглы подвергается специальной заточке и смазке с использованием новейших технологий. Тем не менее повторное и многократное использование инсулиновой иглы ведет к повреждению ее острия и стиранию смазочного покрытия, что увеличивает болезненные ощущения и дискомфорт. Затупление иглы не только делает введение инсулина болезненным, но может стать причиной местного кровоизлияния. К тому же стирание смазки на игле способствует увеличению силы проталкивания иглы через кожу, в связи с чем возрастает опасность искривления иглы и даже ее поломки. Однако основной аргумент против многократного использования иглы — это микротравматизация ткани. Дело в том, что при повторном использовании иглы ее острие изгибается, приобретая форму крючка, что хорошо видно под микроскопом (рис. 5). При удалении иглы после введения инсулина этот крючок разрывает ткань, вызывая микротравму. Это способствует образованию у ряда больных выступающих уплотнений (плюс-ткань) в местах инъекций инсулина, т. е. липодистрофий. Помимо того, что липодистрофические уплотнения вызывают косметический дефект, они могут иметь серьезные медицинские последствия. Часто больные продолжают вводить инсулин в эти уплотнения в силу того, что уколы в этих местах менее болезненны. Однако всасывание инсулина в этих местах происходит неравномерно, в результате чего может ослабевать контроль гликемии. Довольно часто в таких ситуациях ставится ошибочный диагноз «лабильное течение диабета».
 |
| Рисунок 5. Деформация инсулиновых игл после многократного использования |
Повторное использование иглы может приводить к тому, что кристаллы инсулина забивают канал, что, в свою очередь, затрудняет подачу инсулина и делает ее неадекватной.
Многократное использование игл для инсулиновых шприц-ручек может повлечь за собой еще одну серьезную ошибку. В инструкции к шприц-ручкам написано, что после каждой инъекции необходимо снимать иглу. Но большинство больных не соблюдают этого правила (в связи с тем, что бесплатно выдается недостаточное количество игл). Таким образом, остается открытым канал между инсулиновым картриджем и окружающей средой. В результате температурных колебаний происходит утечка инсулина и попадание воздуха во флакон. Наличие пузырьков воздуха в инсулиновом картридже приводит к более медленному введению инсулина по мере проталкивания поршня. В результате введенная доза инсулина может оказаться неточной. При наличии больших пузырьков воздуха количество введенного инсулина в некоторых случаях может составлять только 50–70% от набранной дозы. Для того чтобы снизить влияние этого фактора, необходимо вынимать иглу не сразу, а через 7–10 с после того, как поршень достиг своего нижнего положения, о чем и следует проинструктировать больных.
Какие же выводы можно сделать, исходя из всех вышеперечисленных наблюдений? В идеале следует рекомендовать одноразовое использование инсулиновых игл; кроме того, после каждого введения инсулина нужно немедленно снимать иглу.
Учитывая важность вышеперечисленных моментов, врачам следует периодически проверять средства введения инсулина, технику инъекций и состояние мест инъекций у каждого больного.
Инсулиновые помпы
Носимые дозаторы инсулина (инсулиновые помпы) появились в конце 1970-х гг. Следующее десятилетие характеризовалось бурным интересом к этим новым техническим средствам введения инсулина, на них возлагались определенные надежды. После накопления опыта и проведения достаточного числа научно-клинических исследований помповый «бум» спал, и эти приборы заняли свое вполне определенное место в современной инсулинотерапии. В России в настоящее время используются помпы компании Медтроник Минимед.
При использовании дозаторов происходит следующее (рис. 6): для имитации физиологической секреции через установленную в теле канюлю (место инъекции меняется каждые 2–3 дня) инсулин короткого действия подается помпой непрерывно в виде подкожной инфузии (базальная скорость), а перед едой больной вводит различные дополнительные количества инсулина (болюсное введение).
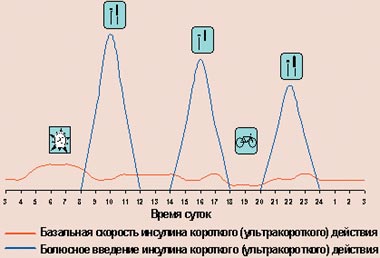 |
| Рисунок 6. Режим интенсифицированной инсулинотерапии с помощью помпы |
Таким образом, прибор представляет собой систему «открытого» типа. Это значит, что дозировку инсулина больной регулирует сам, изменяя ее в зависимости от результатов самоконтроля гликемии. Последнее и является тем звеном, которое как бы «замыкает цепочку», формируя обратную связь. Одно из главных преимуществ имеющихся носимых помп — возможность варьирования базальной скорости инфузии инсулина. Современные помпы позволяют устанавливать разную скорость для каждого часа суток, что помогает справиться с таким явлением, как «феномен утренней зари» (повышение уровня гликемии в ранние утренние часы, заставляющее больных в этом случае производить первую инъекцию инсулина в 5–6 ч утра). Также использование помп позволяет уменьшить количество инъекций, проявить большую гибкость в отношении времени приема пищи и количества потребляемых углеводов. Существуют и имплантируемые помпы, в которых инсулин попадает внутрибрюшинно, а значит, поступает в воротную вену, как это происходит при нормальной секреции инсулина.
Тем не менее многочисленные исследования показали, что значительной разницы в уровне метаболического контроля у больных, использующих дозаторы инсулина, и у тех, кто находится на режиме многократных инъекций, нет. Самым большим недостатком является высокая стоимость помп. Применение помп однозначно оправдано в определенных ситуациях, например во время беременности, у детей с лабильным течением диабета и т. д. Миниатюрного, портативного прибора, который бы не только вводил инсулин, но и имел датчик для определения гликемии, а также функцию автоматизированной подачи инсулина на основе полученных результатов, т. е. представлял бы собой искусственную b-клетку, для длительного клинического применения пока не разработано. Тем не менее экспериментальные модели уже существуют, и серийное производство таких приборов может начаться в ближайшем будущем. В связи с этим возрос интерес к применению обычных помп, так как и медицинским работникам, и больным необходимо привыкать к обращению со сложными техническими устройствами.
Таким образом, на сегодняшний день в нашем арсенале имеются средства самоконтроля и введения инсулина, которые во многом позволяют оптимизировать лечение больных сахарным диабетом. Остается лишь научить больных правильно их использовать, что представляет собой не менее трудную задачу, чем само создание этих средств.
Литература
А. Ю. Майоров, кандидат медицинских наук
ЭНЦ РАМН, Москва