Чем заменить метотрексат при псориатическом артрите
Метотрексат в лечении ревматоидного артрита и псориатического артрита

В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективнос
Abstract. The article provides data on the place of methotrexate in accordance with international and national recommendations 2019–2020 in the management of patients with rheumatoid and psoriatic arthritis. Data on the prevalence of these diseases, the effectiveness and tolerability of methotrexate according to randomized controlled and cohort studies are presented. The advantages of the subcutaneous form of methotrexate in terms of efficacy and tolerability for both rheumatoid and psoriatic arthritis are discussed. Data on the tolerance of the subcutaneous form of methotrexate from various manufacturers are presented. Analysis of literature data and the results of our own research indicate the need for early prescription of methotrexate in patients with rheumatoid arthritis and patients with peripheral joint lesions in psoriatic arthritis. Numerous studies confirm the effectiveness of methotrexate in rheumatoid arthritis in relation to the symptoms of the disease, both articular and non-articular, structural damage (slowing down X-ray progression), which is accompanied by an improvement in the patient’s functional abilities. With psoriatic arthritis, methotrexate is able to reduce the activity of arthritis, enthesitis, reduce skin manifestations, and improve the functional state of the patient. Treatment with methotrexate, when the clinical effect is achieved, is accompanied by a decrease in cardiovascular complications in inflammatory lesions of the joints.
Резюме. В статье приводятся данные о месте метотрексата в соответствии с международными и национальными рекомендациями 2019–2020 гг. в ведении больных ревматоидным и псориатическим артритом. Приведены данные о распространенности данных заболеваний, об эффективности и переносимости метотрексата по данным рандомизированных контролируемых и когортных исследований. Обсуждаются преимущества подкожной формы метотрексата в отношении эффективности и переносимости как при ревматоидном, так и при псориатическом артрите. Представлены данные по переносимости подкожной формы метотрексата различных производителей.
Анализ данных литературы и результаты собственных исследований свидетельствуют о необходимости раннего назначения метотрексата больным ревматоидным артритом и больным с поражением периферических суставов при псориатическом артрите.
Многочисленные исследования подтверждают эффективность метотрексата при ревматоидном артрите в отношении симптомов болезни, как суставных, так и не суставных, структурных повреждений (замедление рентгенологического прогрессирования), что сопровождается улучшением функциональных способностей больного. При псориатическом артрите метотрексат способен уменьшить активность артритов, энтезитов, уменьшить кожные проявления, улучшить функциональное состояние больного. Лечение метотрексатом при достижении клинического эффекта сопровождается уменьшением кардиоваскулярных осложнений при воспалительном поражении суставов.
Ревматоидный артрит (РА) и псориатический артрит (ПсА) являются одними из наиболее частых ревматических заболеваний, протекающих с поражением синовиальных суставов, а ПсА еще и с частым вовлечением в патологический процесс суставов позвоночника, энтезисов (мест прикрепления сухожильно-связочного аппарата сустава к кости). Распространенность РА среди взрослого населения колеблется от 0,5% до 1% и ПсА — от 0,05% до 1,2% [1, 2]. По данным Российского эпидемиологического исследования (проскринировано 76 162 человека, из них 4894 человека были осмотрены ревматологом) распространенность РА в РФ составила 0,6% и ПсА — 0,37% [3]. Объединяет эти два заболевания развитие периферического артрита, что и позволяет обсуждать медикаментозную терапию РА и данного субтипа ПсА в одной статье. При этом надо отметить, что ведение больных и вопросы безопасности фармакотерапии при РА и ПсА различаются в первую очередь из-за различий в структуре и частоте коморбидных состояний. При РА спектр коморбидности соответствует таковой в популяции, так что чаще всего имеют место кардиоваскулярные (КВ) заболевания (ИБС, артериальная гипертензия) и сахарный диабет (СД) преимущественно 2 типа, хотя риск развития КВ-заболеваний при РА выше, чем в популяции [4, 5]. При ПсА частота КВ-заболеваний высока, СД 1 типа, метаболический синдром и ожирение по многочисленным сообщениям встречаются чаще, чем в популяции, относительный риск развития СД 2 типа составляет 2,18 (95% доверительный интервал 1,36–3,50) [6–8]. Пациенты с ПсА имеют больший индекс массы тела (ИМТ), чем больные РА, и больше, чем в популяции [9], часто выявляется дислипидемия [10].
Метотрексат в лечении РА
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [11] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. В соответствии с международными и отечественными рекомендациями терапия синтетическими классическими базисными противовоспалительными препаратами (БПВП) должна начинаться сразу после установления диагноза (желательно в первые 3–6 месяцев от дебюта РА) [1, 12]. По данным анализа 14 рандомизированных контролируемых исследований (РКИ), в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА (с учетом пола, возраста, клинических и лабораторных параметров активности болезни), по мере увеличения длительности болезни частота развития эффекта БПВП снижалась с 52% (начало терапии в 1-й год болезни) до 35% (длительность РА > 10 лет) больных, ответивших на терапию [13].
«Якорным» препаратом из группы БПВП в лечении РА с конца прошлого столетия является метотрексат (МТ), поскольку он эффективен у большинства больных РА, обладает хорошей переносимостью доз, используемых в ревматологии при ограниченных противопоказаниях (острая инфекция, алкоголизм, беременность) (рис. 1) [14, 15]. МТ при РА может применяться в виде монотерапии, в комбинации с другими синтетическими (классическими и таргетными) БПВП или с генно-инженерными биологическими препаратами (ГИБП). В виде монотерапии (с или без глюкокортикоидов) МТ эффективен в первой линии фармакотерапии с уменьшением активности РА до низкой у 70% больных [16].
Перед назначением МТ следует оценить факторы риска нежелательных лекарственных реакций (НЛР): прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липиды, тест на беременность, маркеры вирусных инфекций — ВИЧ, гепатиты В/С), провести рентгенографию органов грудной клетки. Оптимальными терапевтическими дозами при лечении хронических воспалительных артритов считаются от 10–15 до 25–30 мг/неделю [17]. С учетом антифолатного действия МТ показана комбинация его с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту НЛР [18]. Начинают лечение с дозы 10–15 мг/неделю с увеличением ее на 2,5–5,0 мг каждые 2–4 недели с ориентацией на эффективность и переносимость [1]. В отечественных рекомендациях указано, что при наличии у больного РА высокой активности (т. е. те больные, которым показано использование дозы МТ ≥ 15 мг/неделю) рекомендуется начинать лечение с подкожной формы МТ. Известно, что биодоступность подкожной формы МТ выше, чем пероральной, особенно при назначении рекомендуемых высоких доз МТ и их быстрой эскалации [19]. В табл. приведено соотношение доз таблетированного МТ и МТ для подкожного введения. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 2) [20]. Объясняется это особенностями фармакодинамики различных форм МТ. При назначении МТ перорально препарат абсорбируется в проксимальном отделе тощей кишки при посредстве транспортера (PCFT/SLC46A1), что редуцирует фолаты и МТ [21]. Биодоступность орального МТ относительно высока, но варьирует в широких пределах у пациентов и снижается при увеличении дозы, выходя на плато при дозе 15 мг/неделю за счет сатурации интестинального транспорта [19, 20, 22]. При этом концентрация в плазме МТ при подкожном введении продолжает нарастать и при увеличении дозы выше 15 мг/неделю [19].
Результаты многих исследований показали большую эффективность подкожного введения МТ по сравнению с таблетированной формой в равных дозах и возможность достоверного увеличения эффекта в тех случаях, когда оральный препарат был неэффективен или недостаточно эффективен (рис. 3) [23–26]. Подкожная форма МТ лучше переносится, чем оральная. При появлении НЛР со стороны желудочно-кишечного тракта (ЖКТ) или печени показан перевод больного на подкожное введение, что позволяет уменьшить нежелательные проявления или купировать их, а это сопряжено с сохранением (нарастанием) эффекта, увеличивает выживаемость терапии и позволяет избежать или отсрочить назначение дорогостоящей терапии ГИБП [27, 28]. Данные исследования MENTOR (Methotrexate Evaluation of Norwich Treatment Outcomes in RA) оценили эффект перевода больных с орального на подкожный МТ в краткосрочный, средний и долговременный (до 5 лет наблюдения) периоды из-за непереносимости (43,9% больных) или из-за неэффективности (50,5% больных) в когорте из 196 пациентов с длительно текущим РА [29]. Смена формы МТ привела и к увеличению выживаемости терапии (83% больных продолжили лечение в течение 1 года, 75% — в течение 2 лет и 47% — в течение 5 лет) с минимальной потребностью в терапии ГИБП (10% больных). Метаанализ подтвердил преимущества подкожного МТ перед оральной формой в отношении и эффективности, и переносимости [30]
Особенно эффективно назначение подкожного МТ при раннем РА. Это показано на примере когорты St. Gallen [31] — 70 больным терапия подкожным МТ была инициирована без использования оральной формы. Через 1,8 года 53% больным не потребовалось присоединение ГИБП, а 47% больным ГИБП были присоединены через 387 ± 404 дня. Частота достижения низкой активности или ремиссии РА была несколько меньше в группе комбинированной терапии МТ + ГИБП, чем в группе, получавшей только МТ (низкая активность у 78,8% vs 81,1%; ремиссия — 69,7% vs 75,7%).
По нашим данным, назначение подкожного МТ (без использования оральной формы и без комбинации с глюкокортикоидами) 67 больным РА с исходно высокой и умеренной активностью болезни в первые полгода заболевания позволяет во всех случаях в течение 6–12 месяцев достичь ремиссии (в ряде случаев безлекарственной) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного при отмене из-за непереносимости (flu-синдром) у 2 больных (3%) [32].
Такие же данные получены сотрудниками Научно-исследовательского института ревматологии им. В. А. Насоновой [33] в исследовании РЕМАРКА: 191 больному была назначена подкожная форма МТ (без использования оральной формы) в начальной дозе 15 мг/неделю с эскалацией дозы до переносимой за 4–8 недель, что позволило добиться ремиссии у 54,1% больных за первый год лечения без применения глюкокортикоидов (ГК) и ГИБП.
Интересны данные Клиники раннего артрита (г. Лейден, Нидерланды) [34]: безлекарственной ремиссии удалось достичь у 155 из 1007 пациентов с РА (15,4%), диагноз которым был установлен с 1993 по 2011 г. За последние годы изменились тактика и стратегия лечения больных РА. Авторы установили, что стратегия ведения больных достоверно ассоциируется с достижением ремиссии (p
* ФГБНУ НИИР им. В. А. Насоновой, Москва, Россия
** ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Метотрексат в лечении ревматоидного артрита и псориатического артрита/ Н. В. Чичасова, А. М. Лила
Для цитирования: Лечащий врач № 7/2020; Номера страниц в выпуске: 42-51
Теги: суставы, воспаление, боль, осложнения
Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
Диагноз ревматоидного артрита ставится на основании:
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
Биологические (генно-инженерные) БПВП – биологические агенты
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Медикаментозная терапия псориатического артрита
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
П сориатический артрит (ПА) является одним из основных воспалительных заболеваний суставов и позвоночника и наряду с идиопатическим анкилозирующим спондилоартритом (ББ) и реактивными артритами составляет основное содержание серонегативных спондилоартритов (ССА). Это заболевание представляет собой хронический прогрессирующий системный воспалительный процесс, ассоциированный с псориазом (Пс), который характеризуется преимущественной локализацией воспалительного процесса в тканях опорно–двигательного аппарата и приводит к развитию эрозивного артрита, внутрисуставного остеолиза и спондилоартрита [1]. Распространенность Пс в популяции составляет 1–3%, а распространенность артрита среди больных Пс, по данным разных авторов, колеблется от 13,5% до 47,0%, что свидетельствует об относительно большой распространенности ПА.
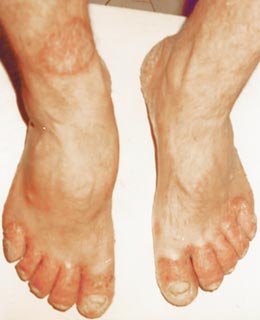
Артрит стоп «Сосискообразная» дефигурация пальев стоп. Акральный псориаз.
Клинические проявления ПА и его течение чрезвычайно многообразны – от моно–олигоартрита или изолированного энтезита до генерализованного поражения суставов и позвоночника с яркой внесуставной симптоматикой. Нередко с самого начала заболевание сопровождается выраженными экссудативными явлениями в пораженных суставах, максимальной активностью воспалительного процесса, быстро прогрессирующим течением с развитием стойкой функциональной недостаточности опорно–двигательного аппарата уже в течение первых двух лет болезни. Все это приводит к существенному снижению качества жизни и к ранней инвалидизации больных.
Псориатический артрит (Рентгенограмма кистей) Множественный внутрисуставной остеолиз. Анкилозированные лучезапястные суставы и суставы запястья
В развитии и клинической эспрессии ПА принимают участие многие факторы, включая генетические, иммунологические и приобретенные [1]. Первостепенное значение принадлежит иммунопатологическим нарушениям – как гуморальным, так и клеточным (табл. 1). Многочисленные исследования демонстрируют при ПА гиперпродукцию циркулирующих иммунных комплексов, содержащих IgA, поликлональную гаммапатию, преобладание СД4+ Т–лимфоцитов в клеточных инфильтратах синовии, депрессию ответа лимфоцитов на специфические и неспецифические антигены, повышенную экспрессию тромбоцит–зависимого фактора роста. Значение иммунных нарушений в реализации псориатического синовита находит свои доказательства в обнаружении фиксированных на клетках покровного и подпокровного слоев синовиальной оболочки иммуноглобулинов и комплемента, ее инфильтрации иммунокомпетентными клетками, высоком уровне провоспалительных цитокинов в синовиальной жидкости и синовиальной оболочке, эффективности селективных иммуноактивных средств. Стимуляция пролиферации кератиноцитов, основной клетки, ответственной за напластование чешуек и корочек при Пс синовиальными Т–лимфоцитами, демонстрирует тесную взаимосвязь основных синдромов при ПА и нозологическую его самостоятельность.
Объем терапевтических мероприятий при ПА определяется основными параметрами патологического процесса, которые включают клинико–анатомический вариант суставного синдрома, спектр возможных системных проявлений и их выраженность, степень лабораторной активности, характер псориаза и стадию его развития. При остеолитическом и спондилоартритическом вариантах, наиболее тяжелых и неблагоприятных в прогностическом плане, необходимо проведение особенно активной терапии, с включением интенсивных методов лечения. Напротив, при олигоартритическом и дистальном вариантах, характеризующихся мало прогрессирующим течением и длительным сохранением функциональной способности опорно–двигательного аппарата, терапия может быть ограничена лишь применением нестероидных противовоспалительных препаратов (НПВП), локальным применением глюкокортикостероидов (ГКС) и назначением сульфасалазина.
При яркой висцеральной патологии, которая, как правило, протекает на фоне максимальной лабораторной активности, как это наблюдается и при злокачественной форме ПА, терапия должна включать системное применение ГКС, высокие дозы цитостатических иммуносупрессоров, комбинированное применение болезнь–модифицирующих препаратов, пульс–терапию большими дозами метотрексата и метилпреднизолона. При ПА нередко требуются лекарства, направленные на нормализацию обмена веществ и восстановление функции пораженных органов и систем организма (например, назначение аллопуринола при развитии вторичной подагры у больных с генерализованным поражением кожи, коррекция гипергликемии или гиперлипидемии, которые при ПА встречается существенно чаще, чем в популяции, антиаритмических препаратов, гепатопротекторов, коррекция гипопротеинемии, отеков или азотвыделительной функции при вторичном реактивном амилоидозе и т.д.). Терапевтическая тактика при распространенном вульгарном или экссудативном Пс (и тем более пустулезном и эритродермическом) предполагает применение активной наружной терапии с использованием индифферентных мазей, препаратов цинка, кортикостероидных мазей, дериватов витамина Д, ароматических ретиноидов, как и метотрексата или циклоспорина А, десенсибилизирующих средств и т.д.
Чрезвычайно важно применение таких препаратов, которые активно воздействовали бы прежде всего на основные синдромы ПА – суставной и кожный. Это тем более актуально, что между этими синдромами существует тесная взаимосвязь и взаимообусловленность. Параллелизм течения кожного и суставного синдрома является одним из диагностических критериев данного заболевания. Эта взаимобусловленность находит свое выражение в одновременном развитии кожного и суставного синдромов в дебюте заболевания, синхронности обострений этих синдромов, изменении характера дерматоза при возникновении артрита или спондилоартрита, что выражается как в появлении более распространенных его форм, так и в трансформации ограниченного вульгарного Пс в распространенный вульгарный или в экссудативный, возникновении торпидных форм дерматоза к ранее эффективной терапии, а также исчезновении четко выраженной сезонности обострений Пс, наблюдавшейся до поражения суставов.
Выделение клинико–анатомических вариантов суставного синдрома ПА, уточнение диапазона висцеральных проявлений и характера течения, а также выяснение некоторых патогенетических факторов, имеющих значение в развитии осложненного Пс, позволило подойти к обоснованию дифференцированной терапии этого заболевания. В основе лечебных мероприятий должно лежать не только уменьшение активности процесса в каждый конкретный момент, но главным образом прерывание или уменьшение дальнейшего прогрессирования заболевания, предупреждение стойкой недостаточности опорно–двигательного аппарата, что, по существу, и представляет содержание вторичной профилактики.
Также как и при многих других ревматических заболеваниях, основу медикаментозной терапии составляют симптом–модифицирующие (СМП) и болезнь–модифицирующие препараты (БМП). Среди первых фигурируют НПВП и ГКС. При выборе НПВП и его суточной дозы следует учитывать активность воспалительного процесса, эффективность и переносимость препарата, возможность сочетания с другими видами терапии, наличие сопутствующих заболеваний. У больных ПА с преимущественным поражением позвоночника наиболее эффективны производные индолуксусной кислоты, как это наблюдается и при ББ. Иногда под влиянием традиционных НПВП возможно обострение кожного Пс, что связано с их влиянием на продукцию лейкотриенов.
Лечение ГКС при ПА имеет ряд особенностей по сравнению с другими ревматическими заболеваниями [4]. Клинический опыт позволяет констатировать, что терапия ГКС при ПА менее эффективна, чем, например, при ревматоидном артрите (РА), и что введение ГКС внутрисуставно или в пораженные энтезы оказывает более отчетливое положительное действие, чем их системное применение. Это может быть связано со многими обстоятельствами, в частности, с небольшим участием гуморальных иммунных нарушений в развитии и прогрессировании заболевания, трудностями адекватной оценки степени активности воспалительного процесса и, соответственно, определении показаний к назначению ГКС, незначительной выраженности и необлигатности воспаления синовиальной оболочки. Некоторые авторы считают, что анкилозы крестцово–подвздошных суставов и суставов позвоночника или фиброзный анкилоз тазобедренных суставов могут сформироваться и без предшествующего синовита. В частности, такой точки зрения придерживается Fassbender H.G., который полагает, что при ПА первично наблюдается поражение энтезов, т.е. мест прикрепления к кости суставной капсулы, сухожилий и связок с последующей оссификацией этих образований и лишь вторично в процесс вовлекается синовиальная оболочка с развитием ее воспаления. Это обстоятельство позволило автору называть псориатический артрит «псориатической остеоартропатией», подчеркивая решающее значение изменений в костной ткани, во всяком случае на ранних этапах заболевания [2]. Позже эта точка зрения нашла свое доказательство при использовании компьютерной томографии, а патологические изменения в опорно–двигательном аппарате при ПА стали рассматривать с позиций энтез–ассоциированной патологии [3]. Особенности ответа организма на ГКС при ПА, возможно, определяются низкой плотностью ГКС–рецепторов в тканях, а также нарушением взаимодействия ГКС с ГКС–рецепторами.
Интересно, что при длительной терапии ГКС у больных ПА не развивается выраженный синдром Кушинга или стероидный остеопороз, а синдром отмены наблюдается лишь в исключительных случаях. Следует иметь в виду, что системная терапия ГКС нередко приводит к дестабилизации Пс с формированием торпидных к проводимой терапии форм дерматоза, а в редких случаях способствует трансформации относительно благоприятного дерматоза в пустулезный Пс, который является фактором высокого риска тяжелого течения ПА.
И все же терапия ГКС довольно широко применяется при этом заболевании. Результаты ретроспективного многоцентрового исследования в 10 ревматологических центрах Италии показали, что 24,4% больных ПА принимают ГКС в малых дозах, не превышающих 10 мг. Нередко эти препараты назначают и в качестве bridge–терапии на первых этапах базисного (патогенетического) лечения метотрексатом, циклоспорином или сульфасалазином (табл. 2).
Прямым показанием к системному применению ГКС является прежде всего злокачественная форма ПА, при которой ответ на такую терапию во многом определяет дальнейший исход заболевания [4]. Доза преднизолона при этом должна быть не менее 30–40 мг/сут. ГКС обрывают гектическую лихорадку, существенно снижают активность воспалительного процесса в опорно–двигательном аппарате, включая проявления артрита и спондилоартрита, способствуют разрешению общих и системных проявлений, столь характерных для этого варианта ПА. Менее эффективно действие ГКС на эритродермический или пустулезный Пс, закономерно имеющие место при злокачественной форме. Обычно ГКС должны применяться в комбинации с метотрексатом или циклоспорином А (ЦсА). Доза метотрексата составляет 20–25 мг/нед, и при этом его предпочтительнее вводить парентерально (внутримышечно или внутривенно). Системное применение ГКС показано также больным с распространенным экссудативным артритом, максимальной лабораторной активностью воспалительного процесса на протяжении 3–х и более мес, ярко выраженных висцеритах (аортит, формирующийся порок сердца, диффузный гломерулонефрит, периферическая нейропатия), распространенном вульгарном, экссудативном или тем более атипичном (пустулезном, эритродермическом) Пс. ГКС могут применяться для лечения и профилактики побочных явлений метотрексата. Во всяком случае их назначение в малых дозах существенно смягчает токсические проявления цитотоксической терапии.
При ПА широко проводится и локальная терапия ГКС, причем не только суставного синдрома, но и кожного. Показанием к внутрисуставному их введению является прежде всего активный артрит в ограниченном числе пораженных суставов. Лечение бетаметазоном проводят при наличии высокой местной активности и упорном синовите. Их целесообразно вводить и в пораженные энтезы при наличии дактилита, талалгии или энтезитов иной локализации. Топические ГКС широко применяются и для лечения Пс, ассоциированного с артритом. В ряде случаев без них невозможно провести эффективную терапию кожного синдрома. Хотя локальная терапия ГКС также может привести к дестабилизации Пс и развитию распространенных его вариантов, но это происходит реже, чем при их системном применении.
Теоретическим обоснованием применения при ПА БМП явились результаты многочисленных исследований, свидетельствующие об иммунном воспалении, как основе тканевых изменений этого заболевания. Необходимость применения БМП подчеркивает и хроническое прогрессирующее течение ПА, которое подчас не удается прервать или замедлить другими методами лечения. Близость клинических проявлений ПА к РА и ББ дала основание использовать при осложненном Пс те принципы БМТ, которые разработаны и с успехом применяются при основных воспалительных заболеваниях суставов и позвоночника и которые направлены на подавление иммунопатологических нарушений – главной мишени терапевтического воздействия. Но лечение ПА имеет и свои отличительные особенности. Среди БМП, применяющихся при этом заболевании, фигурируют не только метотрексат, циклоспорин, сульфасалазин, лефлуномид и препараты биологического действия, но и колхицин, дериваты фумаровой кислоты, микофенолат мофетил, ароматические ретиноиды, дериваты витамина Д, соматостатин и другие, многие из которых способствуют разрешению как суставных, так и кожных проявлений заболевания (табл. 3). Далеко не все они нашли широкое применение в терапии осложненного Пс из–за относительно низкой эффективности и возможности развития серьезных побочных реакций при их длительном применении. Производные хинолина при ПА оказывают более слабое действие на суставный синдром, чем при РА, и в то же время они способствуют переходу стационарной стадии дерматоза в прогрессирующую, ОВПс в ПусПс или эксфолиативную эритродермию и даже появлению первых псориатических эффлоресценций. Отрицательная динамика кожного синдрома при таком лечении достигает 41,7%, поэтому их применение не рекомендуется при этом заболевании [5].
БМП терапия при ПА представлена и препаратами золота (ПЗ). Мишенью для них являются макрофаги и эндотелиальные клетки, принимающие участие на разных этапах развития патологического процесса, включая самые ранние. ПЗ тормозят высвобождение цитокинов, в частности, ИЛ–1 и ИЛ–8, усиливают функциональную активность нейтрофилов и моноцитов, ингибируют презентацию антигена Т–клеткам, уменьшают инфильтрацию Т– и В–лимфоцитами синовиальной оболочки и пораженной псориазом кожи, тормозят дифференциацию макрофагов.
Впервые о положительном действии солей золота при ПА было сообщено в 1973 г. В последующем во многих работах была показана высокая эффективность ауротерапии при осложненном Пс, позволяющая позитивно влиять на многие параметры суставного синдрома и контролировать воспалительную активность. Pioro M.H. и Cash J.M. [6] провели анализ опубликованных открытых исследований по изучению эффективности и переносимости ауротиомалата натрия. Достоверное улучшение, по данным различных авторов, наблюдалось у 63% – 82% больных, принимающих препарат в течение 12 мес., что позволило рассматривать ауротиомалат натрия, как альтернативу при рефрактерном течении ПА.
Раlit J. и соавт. [7] в многоцентровом двойном слепом плацебо–контролированном исследовании сравнивали эффективность и безопасность ауротиомалата и ауранафина у 82 больных ПА. Длительность лечения составила 6 мес. Отмечено достоверное снижение суставного индекса Ричи, интенсивности боли по визуальной аналоговой шкале и СОЭ у больных, принимающих как ауротиомалат, так и ауранафин, хотя более высокий эффект был получен при парентеральном введении солей золота. А.П. Бурдейный расценивает терапевтическую активность ПЗ у больных ПА выше, чем сульфасалазина и метотрексата [8]. По мнению автора, ПЗ оказывают положительное действие как на проявления артрита, так и на воспалительный процесс в осевом скелете, и способны замедлить темпы рентгенологического прогрессирования ПА.
При индуцировании полной или частичной клинико–лабораторной ремиссии ауротерапию следует проводить неопределенно долго. Однако и в случае положительного ее эффекта нередко дальнейшее применение ПЗ прекращают, что приводит к последующему обострению заболевания. В противоположность мнению, что повторные курсы ауротерапии менее эффективны по сравнению с первым курсом, исследованиями Klinkhoff A.V. и Teufel A. [9] показано, что второй курс лечения ПЗ дает положительный эффект, сравнимый с эффектом, полученным в конце первого курса.
Одним из обстоятельств, затрудняющих широкое внедрение ПЗ в комплексную терапию ПА, является их способность вызывать обострение Пс [10]. Это выражается в появлении новых папул и синдрома Кебнера, периферическом росте бляшек, распространении дерматоза на ранее непораженные участки, появлении выраженного воспалительного компонента кожных высыпаний. Обычно при лечении ауротиомалатом обострение Пс наступает на 5–16 нед. от начала терапии, хотя возможно появление пустулезных элементов уже после первой инъекции препарата. Однако риск обострений дерматоза несомненно завышен. Многие исследователи не наблюдали обострений дерматоза даже при длительном применении солей золота, а в некоторых случаях регистрировали положительную динамику кожного синдрома.
При клиническом испытании натрия ауротиомалата у 12 больных ПА c давностью заболевания от 5 до 19 лет, суммарной дозой препарата от 310 до 1260 мг и длительностью терапии у большинства больных до 26 нед, мы выявили отчетливую положительную динамику суставного синдрома уже спустя 16 нед от начала лечения, при этом в 1,5–2 раза уменьшилась интенсивность боли в суставах и позвоночнике, число воспаленных суставов и функциональный индекс, в 2,7 раза – выраженность утренней скованности и в 2,3 – ее продолжительность. В дальнейшем сохранялись достоверные положительные сдвиги. К концу курса лечения число воспаленных суставов уменьшилось в 3,1 раза по сравнению с исходным показателем, а утренняя скованность полностью прошла у каждого второго больного. Существенные сдвиги отмечены и в лабораторной активности. Так, максимальная активность заболевания из 5 больных оставалась лишь у одного, а умеренная активность из 7 – у 4. Существенных изменений в характере Пс не наблюдалось. Не было зарегистрировано увеличение площади кожных высыпаний или их распространение на ранее непораженные области.
Таким образом, имеющиеся данные позволяют дать высокую оценку натрия ауротиомалата, как одного из БМП в лечении ПА. Ауротерапия позволяет контролировать течение этого заболевания, воздействует на симптоматику поражения периферических суставов и осевого скелета, уменьшает число рецидивов суставного синдрома, снижает клиническую и лабораторную активность заболевания. ПЗ могут быть назначены при любом варианте суставного синдрома (кроме спондилоартритического), быстро прогрессирующем течении, серопозитивности по ревматоидному фактору, что хотя и редко, но наблюдается при ПА, низкой эффективности или плохой переносимости метотрексата и сульфасалазина, отсутствии выраженных системных проявлений.
Сульфасалазин является одним из стандартных препаратов в лечении ПА. Доказана высокая терапевтическая эффективность сульфасалазина при всех ССА. При сравнительном изучении эффективности препаратов базисного действия, таких как сульфасалазин, ауронафин, ауротиомалат, этретинат, фумаровая кислота, колхицин, азатиоприн, метотрексат, у 1022 больных ПА по материалам, представленным в Medline и Eхcerpta Medica, наиболее выраженная положительная динамика отдельных параметров патологического процесса отмечена при лечении сульфасалазином и высокими дозами метотрексата [11]. Эффективность азатиоприна, этретината, колхицина была выше по сравнению с плацебо, но явно уступала сульфасалазину и метотрексату. Проведено несколько двойных слепых рандомизированных плацебо–контролируемых исследований, в которых была доказана эффективность сульфасалазина при ПА, особенно у больных с активным периферическим артритом. За 36 недель лечения сульфасалазином в дозе 2000 мг/сут статистически достоверно уменьшалась общая активность заболевания (как по оценке врача, так и больного), боль в суставах, скованность, число воспаленных суставов [12]. Этот препарат активно воздействует на проявления периферического артрита и практически не влияет на воспалительный процесс в осевом скелете. Сульфасалазин не вызывает обострение дерматоза, а у части больных способствует разрешению псориатических эффлоресценций.
Болезнь–модифицирующие свойства метотрексата при ПА являются общепризнанным фактом. Его отличает наиболее выгодное соотношение эффективности и переносимости по сравнению с другими цитотоксическими препаратами. Как известно, метотрексат для лечения Пс впервые был применен в 1951 г., причем одновременно с его апробацией при РА. Он относится к препаратам патогенетического действия и рассматривается, как одно из наиболее мощных и эффективных средств, используемых для лечения широкого круга иммуновоспалительных заболеваний человека. Выбор метотрексата продиктован прежде всего его высокой терапевтической эффективностью в отношении кожных проявлений Пс [13]. Он является препаратом выбора при лечении генерализованного экссудативного, пустулезного и эритродермического Пс, т.е. наиболее тяжелых вариантов этого дерматоза, которые, как правило, протекают с системными проявлениями и часто способствуют развитию артрита и/или спондилита. Метотрексат, являясь структурным аналогом фолиевой кислоты, тормозит синтез нуклеиновых кислот, активно вмешивается в репродукцию клеток и тем самым угнетает ускоренный эпидермопоэз.
При ПА доказано положительное влияние метотрексата на ряд параметров суставного синдрома и активность воспалительного процесса, включая больных, ранее рефрактерных к другим базисным препаратам [6]. В многоцентровом двойном слепом 6–ти–мес. испытании он оказался в 8,9 раз более эффективным, чем ауротиомалат, при существенно меньшем количестве побочных эффектов [14]. Положительное влияние метотрексата на суставной синдром у больных осложненным Пс связано не только с его высокой концентрацией в синовиальной жидкости, но и в воспаленных энтезах, тем более, что ПА можно рассматривать, как пример генерализованной энтезопатии.
Мы также показали высокую эффективность метотрексата при лечении 100 больных ПА. По комплексной оценке тяжелое течение заболевания наблюдалось у 78%. Длительность терапии достигала 9 лет. Программа лечения строилась индивидуально. Первоначальная доза составляла 10–15 мг/нед, позже при необходимости она могла быть увеличена до 30 мг/нед. Метотрексат назначался как внутрь, так и парентерально. После достижения терапевтического эффекта дозу постепенно уменьшали до поддерживающей, обычно не превышающей 10 мг/нед.
Существенный положительный эффект наблюдался уже через 3–4 нед от начала терапии. К концу второго месяца лечения все показатели суставного синдрома снизились в 2–3 раза. Особенно отчетливую динамику претерпели такие показатели, как продолжительность и интенсивность утренней скованности, суставной индекс. За этот же период у каждого четвертого больного полностью купировалась ригидность, а у некоторых – боль в суставах и позвоночнике. Максимальная активность, которая была у 45% больных, после 2–х мес. терапии определялась только у 19%. Отчетливой динамике подвергся и кожный синдром. Практически у всех больных удалось прервать прогрессирующую стадию Пс. Обратное развитие кожных высыпаний наблюдалось также при универсальной эритродермии и пустулезном Пс. К концу второго месяца терапии результаты лечения оценены как хорошие в 84,4%, удовлетворительные – в 9,4% и отсутствие эффекта – в 6,2%. Столь яркое и быстрое положительное действие метотрексата не может быть объяснено только иммунодепрессивным эффектом, а связано с его прямым антивоспалительным действием, обусловленным аденозиновым механизмом, что выгодно отличает этот препарат от других базисных средств.
После 6 мес. терапии отмечено дальнейшее подавление воспалительного процесса в суставах и позвоночнике, о чем свидетельствует снижение ряда параметров суставного синдрома (табл. 4). У 18,4% больных удалось получить полную ремиссию и у 63,2% – частичную. За это время существенная положительная динамика дерматоза отмечена у 91% больных. Число больных с высокой лабораторной активностью уменьшилось почти в 3 раза по сравнению с аналогичным показателем до лечения.
Непрерывная терапия метотрексатом в течение 12 месяцев вела к дальнейшему снижению воспалительного процесса, что выражалось в положительной динамике практически всех показателей, характеризующих суставной синдром, а также степени активности, хотя темпы этого снижения были и менее впечатляющие по сравнению с первым полугодием. Длительный, на протяжении ряда лет прием метотрексата существенно влиял на течение ПА, обеспечивая низкие значения лабораторных показателей воспалительного процесса. У 1/3 больных наблюдалась клиническая и лабораторная ремиссия, а у остальных имела место небольшая субъективная симптоматика и слабо выраженные экссудативные явления в пораженных суставах.
Отмечая высокую эффективность метотрексата у больных ПА, следует иметь в виду, что он полностью не подавляет воспалительный процесс. Отрицательная рентгенологическая динамика наблюдалась у каждого третьего больного и проявлялась возникновением новых эрозий, в увеличении выраженности остеолиза или формировании новых синдесмофитов. На фоне базисной терапии прогрессирование костной деструкции обычно протекает субклинически, без четких симптомов обострения ПА. Это дает основание к использованию более высоких доз метотрексата или проведению интенсивной терапии метотрексатом и метилпреднизолоном. Синхронная пульс–терапия 100 мг метотрексата с 250 мг метипреднизолона (1 раз в 2 нед, всего 4 процедуры) показала значительное улучшение у всех больных, вплоть до полного купирования суставного синдрома и разрешения кожных проявлений Пс (при этом спектр побочного действия оставался примерно таким же, как и при назначении 15–20 мг/нед).
Длительное многолетнее применение метотрексата существенно влияло на кожный синдром. У большинства больных распространенный вульгарный Пс перешел в ограниченный. Обострения дерматоза не носили присущий им ранее генерализованный характер и не сопровождались столь ярким экссудативным компонентом, как это было до начала базисной терапии. Пс утрачивал отчетливую сезонность обострений, а их появление удавалось быстро купировать увеличением еженедельной дозы метотрексата. Он, кроме того, обрывал длительную лихорадку, способствовал обратному развитию полиадении, купировал или замедлял течение псориатического нефрита и других висцеритов.
Показания к назначению того или иного препарата не могут быть сформулированы без анализа его побочного действия. Метотрексат влияет не только на иммунокомпетентные клетки, но тормозит деление и вызывает гибель других клеток, что приводит к развитию «цитостатической болезни», своеобразного полисиндромного заболевания, обусловленного действием на организм цитостатических факторов. Важное значение в развитии осложнений имеет индивидуальная чувствительность организма, незначительный разрыв между лечебной и токсической дозой, склонность препарата к кумуляции.
На фоне терапии метотрексатом побочные явления возникают нередко, и необходима высокая квалификация врача по предупреждению, выявлению и лечению подобных осложнений. Метотрексат был отменен у 9 из 100 больных в связи с развитием стойкого эрозивного стоматита и кишечной диспепсии, геморрагического энтероколита, токсического гепатита с печеночно–клеточной недостаточностью, значительной лейкопении, аллергической реакции с преимущественным поражением кожи. Но все же токсичность метотрексата не превышает токсичность других БМП. Тщательное обследование больных, отобранных для такой терапии, постоянный контроль за возникновением побочных эффектов с регулярным исследованием лабораторных тестов, своевременное проведение мероприятий, направленных на ликвидацию возникших осложнений, позволяют с успехом проводить лечение метотрексатом на протяжении ряда лет. В большинстве случаев побочные реакции удается полностью ликвидировать уменьшением суточной и/или еженедельной дозы препарата, переходом на одноразовый прием в неделю, изменением пути введения препарата, назначением кортикостероидов в малых дозах или гепатопротекторов, а также фолиевой или фолиновой кислот (табл. 5).
Конкретными показаниями к проведению базисной терапии метотрексатом являются злокачественная форма ПА, быстро прогрессирующее течение заболевания, генерализованное поражение суставов, высокая лабораторная активность на протяжении 3–х и более месяцев, экссудативный, пустулезный или эритродермический Пс, выраженные трофические нарушения, упорный диффузный гломерулонефрит. С учетом современных представлений показания к иммуносупрессивной терапии могут быть расширены. Ее следует начинать в ранней стадии заболевания, особенно при тяжелых формах, еще до появления деструктивных изменений в костно–суставном аппарате.
Среди других цитотоксических препаратов при ПА нашли применение циклоспорин А (ЦсА) и лефлуномид. Эффективность ЦсА близка к эффективности метотрексата, но переносимость этого препарата значительно хуже. В многоцентровом контролированном исследовании сравнивали терапевтическую эффективность ЦсА, сульфасалазина и препаратов симптоматического действия (НПВП, анальгетики или преднизолон не выше 5 мг/сут) [15]. ЦсА в дозе 3 мг/кг/сут оказался более эффективен на проявления периферического артрита, чем симптом–модифицирующие препараты и сульфасалазин. В то же время у ЦсА и сульфасалазина не было преимущества перед НПВП и малыми дозами преднизолона по их влиянию на спондилоартрит. ЦсА способен контролировать рентгенологическое прогрессирование у 60% больных ПА при непрерывной 24–мес терапии [16]. Другой цитостатический препарат метаболического действия – лефлуномид, который используется в терапии РА, оказался эффективным и при ПА, причем он способен контролировать не только активность заболевания, но и течение основных синдромов – суставного и кожного [17,18]. Лефлуномид тормозит темпы рентгенологического прогрессирования заболевания, снижает прирост эрозий, уменьшает индекс площади и тяжести псориаза (PASI).
В качестве препаратов патогенетического действия при ПА идут поиски и других средств. В этом плане заслуживает внимания колхицин. Пока проведено мало клинических испытаний по изучению его эффективности и безопасности. Возможно, он способен задерживать прогрессирование внутрисуставного остеолиза. Но определенно его следует назначать больным ПА с вторичным реактивным амилоидозом, при этом колхицин будет действовать не только на все этапы образования и отложения в тканях эозинофильного белка, но и на амилоидогенный стимул.
Приведенные данные позволяют с оптимизмом смотреть на будущее развитие медикаментозной терапии такого своеобразного заболевания, как ПА. В последнее время разрабатываются высокоэффективные препараты биологического действия. В частности, показана высокая эффективность при ПА ингибиторов фактора некроза опухоли, причем складывается впечатление, что их терапевтический потенциал при ПА выше, чем при РА. При разработке программы лечения в каждом конкретном случае следует учитывать гетерогенность этого заболевания и строить ее с учетом клинико–анатомического варианта суставного синдрома, активности заболевания, наличия системных проявлений, эффективности и переносимости ранее проводимой терапии и особенностей Пс. Длительное лечение БМП позволяет контролировать активность ПА и течение основных его синдромов, замедляет темпы прогрессирования заболевания, способствует сохранению трудоспособности больных и улучшает качество их жизни.
фирмы «ЭБЕВЕ Фарма Гес. м.б.х. Нфг. КГ» (Австрия)
127473 Москва, 3–й Самотечный пер., д. 3
Телефон: (095) 933–8702; факс: (095) 933–8715
1. Бадокин ВВ. Избранные лекции по клинической ревматологии. Под ред. В.А.Насоновой и Н.В.Бунчука. М., 2001, 82–90.
2. Fassbender H.G. Reumatologia 1998; 36, suppl 1: 45–6.
3. McGonagle D., Conaghan P.G., Emery P. Arthritis Rheum 1999; 42: 1080–86.
4. Бадокин В.В., Агабабова Э.Р., Шубин С.В. Научно–практическая ревматология 2001;4:48–55.
5. Wolf R., Ruocco V. Rheuma (Derm 97. Malta, 1997, L21.
6. Pioro M.H., Cash J.M. Rheum. Dis Clin North Am 1995; 21: 129–49.
7. Palit J., Hill J., Capell N.A. et al. Br. J. Rheumatol 1990; 29: 280–3.
8. Бурдейный А.П., Агабабова Э.Р., Коротаева Т.В., Харамильо Л.Ф. Тер архив 1992; 5: 54–9.
9. Klinhoff A.V., Teufel A. J Rheumatol 1995; 22: 1655–56.
10. Smith D.L., Wernick R. Arch Dermatol 1991; 127: 268–70.
11. Jones G., Crotty M., Brooks P. Cochrane Database Syst Rev 2000; 3: CD000212.
12. Сlegg D.O., Reda D.J., Mejias E. et al. Arthritis Rheum 1996; 39: 2013–20.
13. Вright R.D. Cutis 1999; 64: 332–34.
14. Lacaille D., Stein H.B., Klinkhoff A.V. Arthritis Rheum. 1996; 39: suppl, № 1367.
15. Salvarani C., Саntini F., Olivieri I. Clin Eхp Rheumatol 2002; 20, suppl 28: S71–5.
16. Мacchioni Р., Boiardi L., Cremonesi T. et al. Rheumatology Int 1998; 18: 27–33
17. Liang G.C., Barr W.G. J Clin Rheumatol 2001; 7: 366–70.
18. Cuchacovich M., Sato L. Ann Rheum Dis 2001; 60: 913–23.
_575x.gif)
.gif)
.gif)
.gif)