Чем заполняется пустота после удаления опухоли головного мозга
Парадоксальность в исходах после операции
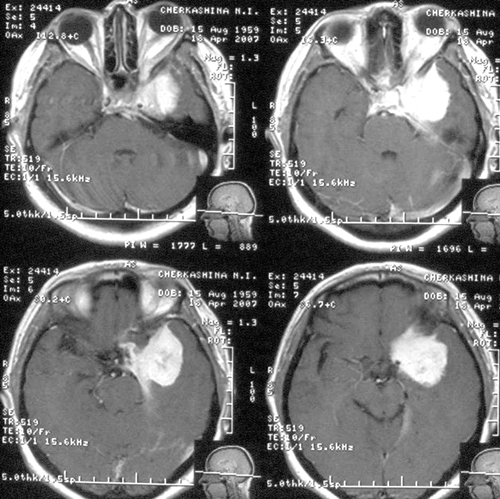
МРТ головного мозга до операции. Обращает на себя выраженный перифокальный отек головного мозга, что не очень характерно для менингиомы, или говорит о ее агрессивной природе.
Вскрыта ТМО, обнажен край опухоли, полнокровные вены и бледный, ишемизированный мозг.
Опухоль отделяется от матрикса, бескровно, атравматично, сосуды, питающие опухоль коагулируются.
Опухоль удалена полностью и уложена на свое место для фото.
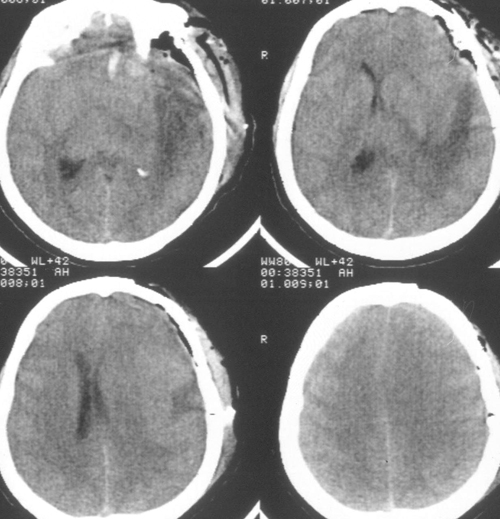
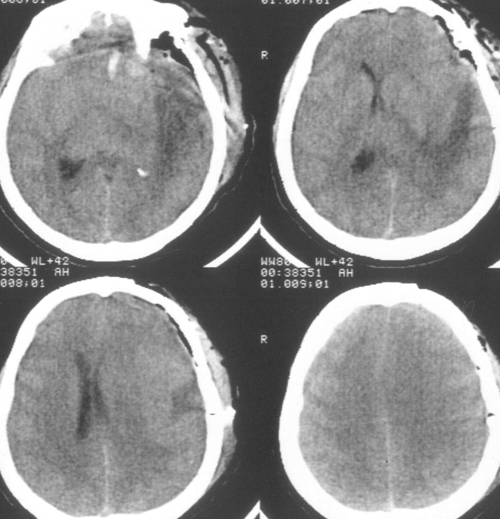
Так выглядит мозг после удаления опухоли — бледный и ишемичный, без кровотечения и грубой травмы, а так выглядит КТ после операции.
Большая зона ишемии в области ложа удаленной опухоли в левой теменной доле.
После операции — правосторонняя гемиплегия, тотальная афазия, на следующие сутки после операции переведена в отделение нейрохирургии, а потом на следующий день снова в отделение реанимации из-за ухудшения состояния.
Удовлетворительный статус до операции + нормальное выполнение операции = плохой результат.
Во вторую очередь оперирован пациент Н., 63 года, с грубым правосторонним гемипарезом и смешанной афазией.
На КТ до операции большая кистозная опухоль слева.
С дислокационным синдромом.
Опухоль пунктирована, получена ксантохромная жидкость до 50 мл, а затем после кортикотомии частично удалена (стенки кисты). Полость выложена марлей СУржиселл.
Полость заполнена жидкостью.
В раннем послеоперационном периоде значительно уменьшился гемипарез. Сохраняется афазия.
Конечно же данные случаи сравнивать между собой нельзя — разные опухоли, свои особенности кровоснабжения и т.д.
В данной ситуации я просто делюсь эмоциональной реакцией на полученный результат. Каждый день, отправляясь на работу, нас ожидает какой-нибудь очередной неожиданный и чаще неприятный сюрприз — особенность хирургии, а в частности, нейрохирургии.
Автор статьи: врач-нейрохирург Воробьев Антон Викторович Рамка вокруг текста
NSICU.RU neurosurgical intensive care unit
сайт отделения реанимации НИИ им Н.Н. Бурденко
Курсы повышения квалификации
Внутричерепная гипертензия
Асинхронии и графика ИВЛ
Водно-электролитные
нарушения
в нейрореанимации
Книга «Основы ИВЛ»
Рекомендации
по интенсивной терапии
у пациентов
с нейрохирургической патологией
Статьи → Нетипичное течение отека мозга, развившегося после удаления опухоли базальной локализации (наблюдение)
После удаления опухолей головного мозга может развиваться отек-набухание мозга иувеличиваться внутричерепное давление (ВЧД). Одной из вероятных и наименее изученныхпричин этого является нарушение венозного оттока. Тяжесть клинических проявлений иисходы венозной дисциркуляции значительно варьируют от головной боли и тошноты докоматозного состояния и летального исхода [14,17,22,26]. Вариабельность клиническойкартины определяется количеством сегментов венозной системы, в которых происходитнарушение оттока. Это было показано в эксперименте Fries G с соавторами [14], когдасвиньям последовательно производили окклюзию верхнего сагиттального синуса, мостиковыхи корковых вен, оценивая при этом клиническое состояние животных, измеряя ВЧД исодержание воды в ткани мозга. Было установлено, что выраженный отек мозга,внутричерепная гипертензия (ВЧГ), разрушение гематоэнцефалического барьера, а затем иартериальная гипоперфузия, приводящая к инфаркту мозга, развивалась только приодновременной окклюзии синуса, мостиковых и корковых вен, когда прекращался иретроградный, и коллатеральный венозный кровоток [1,14]. В то же время установлено, чтонаиболее выраженный неврологический дефицит возникает при нарушении оттока крови поглубоким и парасагиттальным венам или при заинтересованности большого количества венсильвиевой группы [24].
Общепринятых протоколов коррекции ВЧГ, развившейся вследствие нарушения венозногооттока, на сегодня нет. Мы приводим клиническое наблюдение пациентки с менингиомойкрыла основной кости, у которой в раннем послеоперационном периоде остро развилосьнарушение венозного оттока и устойчивая ВЧГ.
Клиническое наблюдение.
Была выполнена операция – субтотальное удаление менингиомы медиальных отделов основаниясредней черепной ямки слева птериональным доступом. Кавернозный синус былинфильтрирован опухолью. Эта часть опухоли не удалялась. Интраоперационно быликоагулированы две враставшие в капсулу опухоли крупные вены сильвиевой группы.
Кровопотеря не превысила 700 мл и была адекватно восполнена.
Пробуждение из наркозного сна было в обычные сроки. Нарастания общемозговой и очаговойневрологической симптоматики по сравнению с дооперационным уровнем не отмечалось.
Пациентка экстубирована через 2 часа после операции. Гемодинамика была стабильной.
Гомеостатические показатели были в пределах нормы.
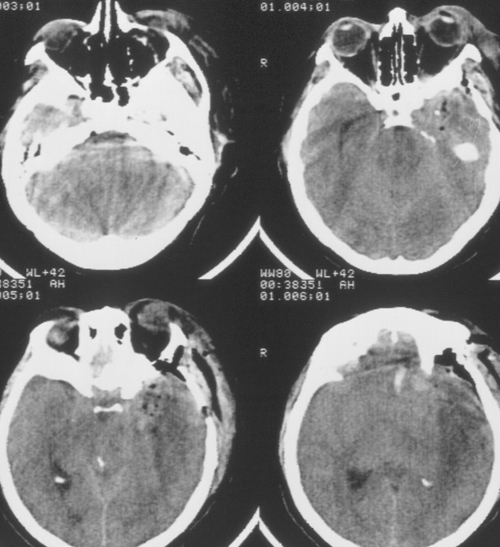
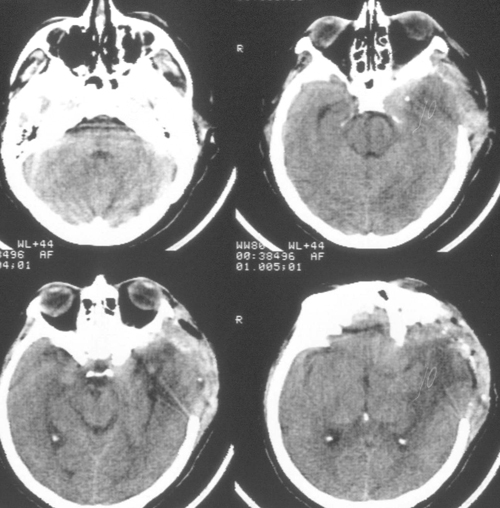
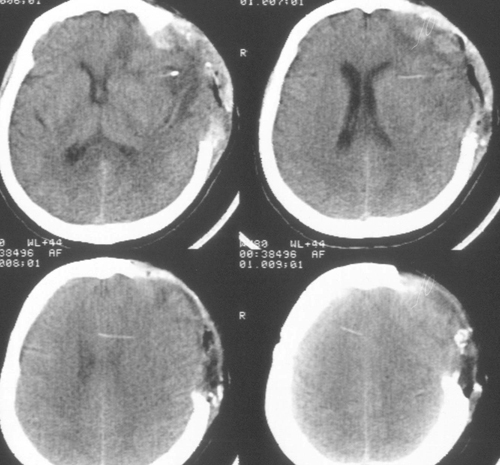
Состояние резко ухудшилось через 12 часов после операции. Развилось коматозноесостояние и правосторонний гемипарез (3 – 4 балла). В связи с дыхательнойнедостаточностью больная была интубирована, начата ИВЛ в режиме SIMV+PS. ПриКТ-исследовании головного мозга был выявлен преимущественно левополушарный отек,массивный очаг пониженной плотности, располагавшийся в лобно-теменно-височной областислева, отмечено смещение срединных структур слева направо на 9 мм. Базальные цистерныне визуализировались, желудочковая система была компремирована (Рис. 2). Притранскраниальной допплерографии линейная скорость кровотока была в пределах нормы. Установлен субдуральный/паренхиматозный датчик ВЧД (Codman, USA). Выявлена выраженнаяВЧГ (ВЧД 35 – 45 мм.рт.ст.).
Для коррекции ВЧГ использовались опции протокола лечения пациентов с черепно-мозговойтравмой, поскольку общепринятых протоколов коррекции ВЧГ при нарушении венозного оттоканет. Головной конец кровати был приподнят на 30º. Начата умеренная гипервентиляция,седация пропофолом (45 мкг/кг/мин), аналгезия фентанилом (0,02 мкг/кг/мин) имиорелаксация пипекуронием (0,5 мкг/кг/мин). Эти мероприятия были неэффективны – ВЧД оставалось на уровне 30 – 35 мм.рт.ст. через 20 минут после начала терапии. После этогобыла использована осмотерапия маннитолом (до 1,5 г/кг). ВЧД через 10 минут снизилось до20 – 25 мм.рт.ст., однако, через 30 мин вновь развилась выраженная ВЧГ (до 40мм.рт.ст.). Повторная инфузия маннитола оказалась неэффективной.
Было принято решение о проведении умеренной гипотермии. Индукция гипотермии началасьспустя час после ухудшения состояния. Использовалось наружное охлаждение и внутривенноевведение охлажденного физиологического раствора в дозе 20 мл/кг. Температура 33º С быладостигнута через два часа после индукции. ВЧД эффективно стабилизировалось на уровне 10– 12 мм.рт.ст. При гипотермии развились гипокалиемия (3,1 – 3,3 ммоль/л) игипомагниемия (0,39 – 0,41 ммоль/л), которые были эффективно корригированы применениемпрепаратов калия и магния. В качестве профилактики развития гипокоагуляции, учитываяранний послеоперационный период и эффекты гипотермии, проводилась плазмотрансфузия вдозе 15 мл/кг. При этом протромбиновый индекс был в пределах 75 – 85%, активированноечастично тромбопластиновое время – 28 – 33 секунды, фибриноген – 3,4 – 3,9 г/л.
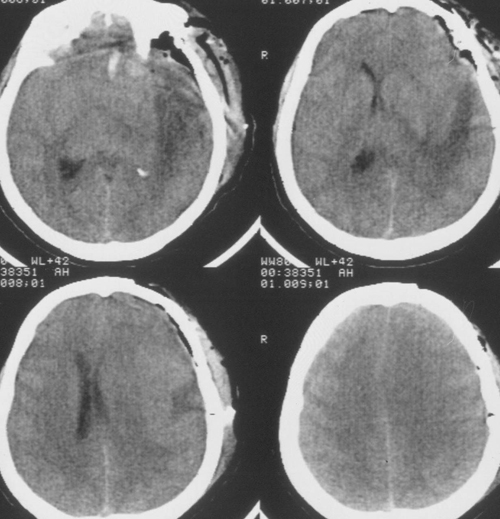
Температура тела 33ºС поддерживалась в течение 24 часов. Перед началом согревания быловыполнено контрольное КТ-исследование головного мозга, выявившее положительную динамикув виде появления базальных цистерн и уменьшения смещения срединных структур вправо до 5мм. Однако сохранялся отек мозга и очаг пониженной плотности в левом полушарии (Рис 3).
При достижении 35ºС (через 10 часов после начала согревания) появилась отчетливаятенденция к ВЧГ, поэтому темп согревания был снижен до ≈ 0,05 градуса в час. Внеседации больная выполняла простые инструкции, правосторонний гемипарез регрессировал.
Таким образом, уже на этом этапе были выявлены положительные эффекты гипотермии в видерегресса общемозговой и очаговой неврологической симптоматики.
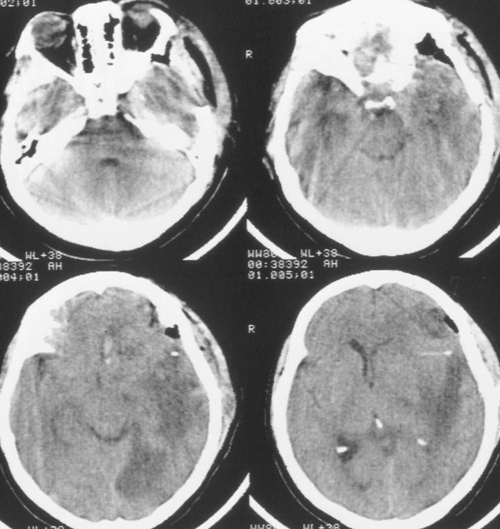
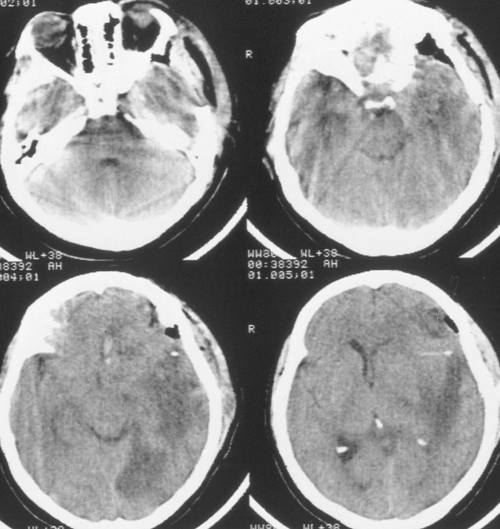
Седация продолжалась еще в течение 2 суток после выполнения наружной декомпрессии, амониторинг ВЧД – в течение 5 суток. В течение этого периода эпизодов внутричерепнойгипертензии не было. При КТ-исследовании была выявлена положительная динамика (Рисунок4). Больная была в сознании, но дезориентирована в месте, времени, личной ситуации.
Движения выявлялись во всех конечностях, без отчетливой ассиметрии. ИВЛ прекращеначерез 6 суток после декомпрессивной трепанации, а еще через 5 суток больная переведенаиз реанимации в нейрохирургическое отделение.
Спустя 1,5 месяца состояние пациентки было стабильным. Выявлялся корсаковский синдром.
Речевых и двигательных нарушений не было. Было выполнено МРТ-исследование головногомозга с венографией, и в режиме диффузии (Рис 5), при котором выявлено отсутствиекровотока по поперечному и сигмовидному синуса слева. Кроме этого, диагностированобширный очаг церебромаляции лобно-височной области базальной локализации слева,который визуализировался и при КТ-исследовании в остром периоде, как очаг пониженнойплотности.
Через 2,5 месяца у больной развилась гидроцефалия, которая явилась показанием длявыполнения люмбоперитонеального шунтирования. Через 4 месяца больная выписана изИнститута в стабильном состоянии. Больная могла обслуживать себя самостоятельно.
Выраженность корсаковского синдрома уменьшилась. Через 6 месяцев после выпискипланируется повторная госпитализация пациентки для выполнения пластики костногодефекта. Дифференциальный диагноз при ухудшении состояния пациентки проводился междуартериальной ишемией и нарушением венозного оттока. Для нарушения венозного характерно:- отсутствие пробуждения из наркозного сна или ухудшение состояния через несколькочасов после операции [17];- при КТ-исследовании возможна визуализация очага пониженной плотности в первые суткипосле операции вследствие гидростатического отека [2];- интраоперационные данные о повреждении вен или синусов;- скорость кровотока при транскраниальной допплерографии остается нормальной илиснижается [4,29,30,33].- при МРТ-венографии выявляются измененные параметры [2]. Однако выполнение МРТ-исследования в остром периоде при наличии выраженной ВЧГ чревато развитием жизненноугрожающих осложнений.
Итак, дифференциальная диагностика позволила заподозрить у пациентки наличие нарушениявенозного оттока. Патогенез развившегося состояния можно представить следующим образом.
Интраоперационная окклюзия вен сильвиевой группы, включенных в опухоль, привела клокальной венозной дисциркуляции. Отсутствие кровотока по поперечному, сигмовидномусинусу (возможно, врожденное) и кавернозному синусу (инфильтрация опухолью)ограничивало компенсаторные возможности коллатерального перераспределения венозногооттока. Это привело к постепенному, в течение 10 – 12 часов после операции, наростаниюотека мозга, что, в свою очередь, вызвало дисциркуляцию в системе глубоких вен мозга.
Это явилось причиной острого ухудшения через 12 часов после операции с развитиемкоматозного состояния, вследствие выраженного отека мозга и его дислокации.
В настоящий момент отсутствует протокол коррекции ВЧГ при нарушении венозного оттока.
При неэффективности перечисленных опций для снижения ВЧД показано применениеагрессивных методов: барбитуровая кома, наружная декомпрессия или умеренная гипотермия.
Барбитураты не использовались, поскольку, из отчетов организации «Кохрановскоесотрудничество», специализирующейся на систематизации и анализе результатовисследований с использованием принципов доказательной медицины, следует, что: «нетдоказательств того, что терапия барбитуратами у пациентов с тяжелой черепно-мозговойтравмой улучшает исходы. Барбитураты вызывают артериальную гипотензию у каждогочетвертого пациента. Гипотензивный эффект барбитуратов будет нивелировать положительноевлияние снижения ВЧД на церебральное перфузионное давление…» [28].
Наружная декомпрессивная трепанация не была использована на этом этапе, поскольку, поданным Greenberg M.S, при нарушении венозного оттока вследствие венозных тромбозов онаприводит к снижению ВЧД, но не улучшает исходов заболевания [17]. При наружнойдекомпрессии изменяются интракраниальные соотношения, меняется ликвородинамика,повышается риск кровоизлияния в остатки опухоли или очаг ишемии при его наличии.
Известно, что при выраженном отеке мозга после декомпрессии может развиваться ущемлениеткани мозга в костном дефекте с развитием ишемии и вторичным нарушением венозногооттока на этом участке [11,27].
В приведенном наблюдении гипотермия во время ее проведения, во-первых, эффективностабилизировала ВЧД, во-вторых, позволила защитить мозг от ишемии. В отличие отартериальной ишемии, развивающейся, например, вследствие клипирования артерии, принарушении венозного оттока ишемия развивается позднее. Вначале появляется выраженныйгидростатический отек мозга. Именно этим манифестировало ухудшение состояния вприведенном наблюдении. Если коллатеральный или ретроградный венозный кровотокневозможен, то остро развивается несовместимый с жизнью отек мозга. При сохранностиколлатерального или ретроградного венозного кровотока, когда возможно егокомпенсаторное перераспределение, выраженность отека будет значительно варьировать[14]. При сохраняющемся нарушении оттока будут формироваться участки мозга, к которымне будет поступать адекватный объем артериальной крови. Вследствие этого разовьетсяишемия. Итак, при венозном инфаркте вначале развивается гидростатический отек, а затем– ишемия и ишемический отек. При артериальном инфаркте вначале развивается ишемия, азатем – отек. Поскольку в приведенном наблюдении при достижении нормотермии был регрессправостороннего гемипареза и восстановление сознания, а в дальнейшем не былодвигательных нарушений, то гипотермия, вероятно, имела церебропротективный эффект. Кроме этого, проведенная гипотермия обеспечила адекватные условия для выполнения впоследующем наружной декомпрессии.
Гипотермия является агрессивным методом коррекции ВЧГ. Наиболее часто описываемыми влитературе осложнениями являются гипокоагуляция [8,35], водно-электролитные нарушения[21], гемодинамические расстройства [12,34] и инфекционно-воспалительные осложнения[8,34]. Наиболее грозными проявлениями гипокоагуляции являются интракраниальныекровоизлияния. Это обусловило профилактическое использование свежезамороженной плазмы вприведенном наблюдении. Водно-электролитные нарушения при гипотермии проявляютсягипокалиемией и гипомагниемией [21]. Гемодинамические расстройства проявляются обычносинусовой брадикардией. Описаны более опасные нарушения ритма – асистолия и фибрилляцияжелудочков, однако, они развиваются или при температуре менее 28ºС или при длительностигипотермии более 48 часов [8,12,34]. Развившиеся в приведенном наблюдении гипокалиемия,гипомагниемия и гемодинамически незначимая брадикардия не угрожали витальным функциям ибыли корригированы незамедлительно при их развитии. Таким образом, умеренная гипотермияпоказала себя относительно безопасным методом контроля над ВЧД.
Период согревания является важным этапом в проведении гипотермии. В нашем наблюдениипри согревании появилась тенденция к повышению ВЧД. Это согласуется с данными рядаавторов. Так, Schwab S с соавторами показали, что согревание – это период высокогориска развития повторной и устойчивой ВЧГ, которая может приводить к летальному исходу[31,32]. Авторы доказали, что продолжительность согревания, превышающая 16 часов,достоверно уменьшает летальность. Поэтому скорость согревания в нашем наблюдениисоставила ≈ 0,05º в час. Не смотря на это, постепенно развилась устойчивая ВЧГ, чтостало показанием к выполнению наружной декомпрессивной трепанации с пластикой твердоймозговой оболочки. Выбранная тактика позволила не допустить усиления дислокации мозга исохранить структурность паренхимы мозга к моменту декомпрессии.
Данные литературы и наше наблюдение свидетельствуют о том, что гипотермия за счетсвоего церебропротективного эффекта, позволяет уменьшить зону уже сформировавшегосяишемического очага и не допустить дальнейшего ишемического повреждения. Однако в периодсогревания сохраняется риск развития повторной резистентной ВЧГ. В этих условияхнеобходимо выполнять наружную декомпрессию с пластикой твердой мозговой оболочки.
Гипотермия в этом случае будет создавать более благоприятные условия для выполненияоперации.
В заключение необходимо сказать, что у пациентов с опухолями базальной локализации враннем послеоперационном периоде возможно развитие отека мозга вследствие нарушениявенозного оттока. При этом стремительно развивается устойчивая ВЧГ. Дифференцироватьнарушение венозного оттока от других возможных причин развития отека мозга в остромпериоде достаточно сложно. Однако это состояние всегда необходимо рассматривать вкачестве возможной причины развития устойчивой ВЧГ. Умеренная гипотермия являетсяэффективным и безопасным методом коррекции отека мозга и ВЧГ при нарушении венозногооттока. Внутричерепная гипертензия, развившаяся на этапе согревания, являетсяпоказанием к выполнению наружной декомпрессии. И, конечно, необходимы дальнейшиеисследования в этом интересном и перспективном направлении.
Реабилитация после удаления опухоли головного мозга
Опухоль головного мозга – широкое понятие, которое подразумевает ряд заболеваний, общей чертой которых является появление новообразований, локализованных в области черепа. Эти новообразования могут развиваться непосредственно в тканях мозга, в его оболочках, а также в черепных костях и сосудах.
Опухоли могут быть первичными и вторичными. В первом случае новообразование формируется в полости черепа. Во втором – в полости черепа появляются уже метастазы, а первичный раковый очаг находится в другом месте.
Также опухоли делятся на доброкачественные и злокачественные, одиночные и множественные. Одиночные подразумевают наличие всего одного новообразования, множественные – от двух.
Характерная симптоматика
Опухоль растет внутри черепа и начинает сдавливать мозг. В итоге страдают не только те отделы, которые находятся в непосредственной близости к очагу, но и те, что расположены на удалении. Чем больше опухоль, тем выше внутричерепное давление, и тем выше вероятность отека мозга. Все это приводит к ряду симптомов:
Лечение опухолей головного мозга
Существует три основных подхода к лечению заболевания:
Оперативное вмешательство используется в основном в тех случаях, когда опухоль отграничена от других тканей, и при проведении операции риск их повреждения минимален.
Новообразование может быть удалено полностью или частично. Также может быть проведена паллиативная операция, которая облегчит состояние больного.
Оперативное вмешательство противопоказано в тех случаях, когда:
Химиотерапия направлена на уничтожение раковых клеток. Метод может использоваться как самостоятельный, а также в совокупности с хирургическим вмешательством. Специальные препараты (цитостатики) вводятся внутримышечно, внутриартериально, внутривенно, внутритканево (непосредственно в полость, откуда была удалена опухоль), интратекально.
Лучевая терапия – это воздействие на раковые клетки радиоактивными веществами. Лечение подходит для разных видов опухолей, как злокачественных, так и доброкачественных, и в тех случаях, когда операция невозможна. Данная методика может использоваться и после хирургического вмешательства, когда новообразования проросли в близлежащие ткани.
Есть также методики радиохирургии, которые также относятся к лучевой терапии. Это гамма-нож и кибер-нож. В обоих случаях проводится радиоактивное облучение, которое воздействует на раковые клетки и не влияет на здоровую ткань.
Восстановление после удаления опухоли головного мозга
Операция по удалению опухоли головного мозга – очень серьезное вмешательство. Даже если она проведена профессионально и без последствий после нее очень важно провести правильное восстановление, чтобы полностью выздороветь без риска рецидива.
После хирургического вмешательства есть ряд запретов:
Очень важно начать нейрореабилитацию как можно раньше, чтобы восстановиться как можно быстрее и избежать инвалидности.
Восстановление касается, прежде всего, утраченных ранее функций пациента и возвращение его к нормальной жизни. Не всегда возможно вернуть полностью доболезненное состояние, в этом случае нужно постараться адаптировать больного к текущей ситуации, научить его самостоятельно себя обслуживать.
Реабилитацией занимаются хирурги, химиотерапевты, психологи, радиологи, физиотерапевты, врачи и инструкторы по ЛФК, а также младший медицинский персонал. Только комплексный подход всех групп специалистов позволяет обеспечить качественный реабилитационный процесс.
Программа индивидуально разрабатывается для каждого пациента. Для него ставятся краткосрочные и отдаленные цели. Когда достигаются краткосрочные цели, ставятся новые. И так постепенно, шаг за шагом достигается основная цель. Процесс делится на такие маленькие этапы для того, чтобы врачи смогли оценить динамику, а пациент ощутил радость достижений и получил мотивацию для дальнейших действий.
Пока больной проходит процесс нейрореабилитации, помощь нужна и его родственникам, так как тяжелое состояние пациента часто приводит к состоянию подавленности всей его семьи. Чтобы у членов семьи были силы для поддержки своего родственника, им тоже нужна помощь.
Реабилитационные программы и сроки восстановления
Чтобы говорить о сроках, нужно иметь представление о сложности первоначального состояния, оперативном вмешательстве и его результатах. Если процесс запущен вовремя и идет успешно, обычно он занимает около 3-6 месяцев.
Среди самых популярных методик:
Все меры реабилитации проводятся специалистами. Но очень важна мотивация самого пациента, его желание работать и получать результат.
Обзор онкологических заболеваний менингиомы
Вам поставили диагноз: менингиома?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Предлагаем Вашему вниманию краткий, но подробный обзор одной из разновидности опухолей головного мозга.
Ежегодно в России выявляют более 8 тысяч новых заболеваний опухолей мозговой оболочки, головного и спинного мозга и других частей центральной нервной системы. Почти такое же количество граждан умирает от данных локализаций.
Филиалы и отделения, где лечат менингиомы
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение нейроонкологии
Заведующий – к.м.н. ЗАЙЦЕВ Антон Михайлович
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение протонной и фотонной терапии
Заведующий – д.м.н. ГУЛИДОВ Игорь Александрович
Тел: 8 (484) 399 31 30
Менингиомы
Симптомы менингиомы
Симптомы заболевания во многом зависят от места локализации опухоли и могут проявляться в виде:
головных болей; нарушения координации движений; глазодвигательных нарушений (косоглазие, двоение, опущение верхнего века); нарушений зрения – снижения остроты или ограничения периферического зрения чувствительных или двигательных нарушений в конечностях противоположной стороны тела, эпилептических приступов различной структуры, психо-эмоциональных нарушений.
Менингиомы больших размеров могут сопровождаться симптомами повышения внутричерепного давления (головная боль с тошнотой и рвотой), могут вызывать клинические симптомы сдавления мозга и ликворопроводящих путей и угрожать жизни пациента.
Диагностика менингиомы
Лечение менингиомы
В настоящее время выделяют несколько основных методов лечения менингиом.
Хирургическое удаление. Успешность хирургического вмешательства зависит от нескольких факторов – от расположения опухоли по отношению к функционально важным отделам мозга, от близости сосудов и черепно-мозговых нервов, а также от размера менингиомы. Оперативное удаление менингиомы в большинстве случаев заканчивается благополучно. Пациенты относительно быстро могут вернуться к нормальному образу жизни. Однако, вероятность рецидива (повторного образования опухоли) может достигать 20% и более в сроки свыше 10 лет наблюдения и зависит в первую очередь от гистологического подтипа опухоли и радикальности ее удаления.
Альтернативой хирургическому вмешательству при лечении менингиом является лучевая терапия. Этот современный метод облучения отлично себя зарекомендовал при лечении опухолей с локализацией в труднодоступных местах, когда удаление сопряжено с высоким риском функциональных нарушений и хирургических осложнений. Лучевой терапии поддаются опухоли различной величины с максимальной точностью, за один раз или несколькими сеансами лечения, необходимых для получения желаемого результата.
Данные литературы свидетельствуют, что контроль роста доброкачественных менингиом составляет 92-95% (т.е. всего 5-8% рецидивов) при наблюдении свыше 10 лет после лучевой терапии с сохранением высокого уровня качества жизни. Менингиомы 2-й и 3-й степени злокачественности рецидивируют чаще, однако важным преимуществом применения лучевой терапии перед другими методами лечения является возможность неоднократного использования и низкий (в сравнении с другими методами) уровень осложнений.
Таким образом, при менингиомах внутричерепной локализации применение лучевой терапии является оптимальным методом лечения, потому что:
ведет к продолжительному контролю опухолевого роста, который проявляется стабилизацией размеров или уменьшением опухоли;
имеет минимальный риск появления новой или усугубления имеющейся неврологической симптоматики;
позволяет быстро вернуться к повседневной жизненной активности.
Лучевая терапия противопоказана при: больших опухолях (должно быть проведено удаление); наличии выраженной неврологической симптоматики связанной или нет с наличием масс-эффекта; опухолях зрительного нерва с сохранным зрением (проводится фракционированное облучение).
Филиалы и отделения, в которых лечат опухоли головного и спинного мозга, а также отделы центральной нервной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.