Фосфопротеины и фосфопротеиды в чем разница
Сложные белки



Это структуры, содержащие белковую часть – апопротеин и небелковый компонент – простетическую группу. В зависимости от строения последней принято различать следующие их варианты.
Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Тип связи между апопротеином и небелковым компонентом – сложноэфирная, которая образуется при взаимодействии ОН-группы серина или треонина с фосфорной кислотой. К протеинам этого класса относятся казеиноген молока, фосфорилированные модификации гистонов, ферменты (РНК-полимеразы, некоторые фосфотрансферазы, фосфатазы) и другие, а также вителлин, фосвитин желтка и овальбумин белка яиц, ихтуллин икры рыб.
Остатки фосфорной кислоты, включённые в белки, находятся в диссоциированом состоянии, что придаёт молекуле сильный отрицательный заряд. Поэтому фосфопротеины могут легко взаимодействовать с лигандами или отталкивать их. Так, например, они связывают ионы Са 2+ и транспортируют их.
Но главная особенность данной простетической группы – это возможность изменения конформации и заряда белковой молекулы, что сказывается на её свойствах и функциях. Реакция взаимодействия с фосфорной кислотой называется фосфорилирование или дефосфорилирование и используется, например, для регулирования активности ферментов и изменения функциональной активности биомембран (проницаемости и др.).
Фосфопротеины необходимы для развития зародыша, плода, новорожденного, т.к. содержат оптимальный набор аминокислот, а фосфорная кислота используется для формирования скелета (связывание ионов Са 2+ ), для образования макроэргов – АТФ, АДФ и др., которые требуются в качестве источников энергии в реакциях синтеза, особенно интенсивно протекающих в растущем организме.
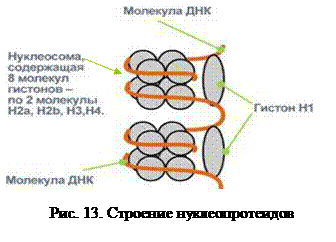
Нуклеопротеины – сложные белки, простетической группой которых являются нуклеотиды, и в первую очередь нуклеиновые кислоты – ДНК и РНК. В качестве апопротеина выступают белки гистоны, реже протамины. Так как эти протеины положительно заряжены, а нуклеиновые кислоты – отрицательно, то связь, образуемая между ними, ионная. Множество октамеров гистонов, комплексируясь с полинуклеотидом, образует нуклеосомы, которые затем компактно укладываются в органоидах (рис. 13).
В функциональном отношении они отвечают за хранение и передачу наследственной информации и процессы биосинтеза белка.
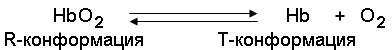
Хромопротеины («цветные белки») своей окраской обязаны простетической группе – пигменту. В зависимости от строения различают следующие подклассы: гемопротеины, флавопротеины, родопсин.
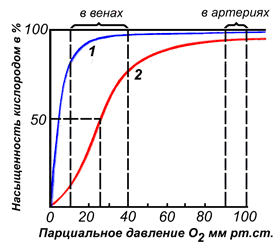
Миоглобин – небольшой глобулярный белок (Mr 16500 Да); молекула его состоит из одной полипептидной цепи (153 а/к) и одного гема. Сродство к кислороду у данного гемопротеида значительно больше, чем у гемоглобина, поэтому он может принимать газ от последнего для сохранения или использования его в мышечных клетках.
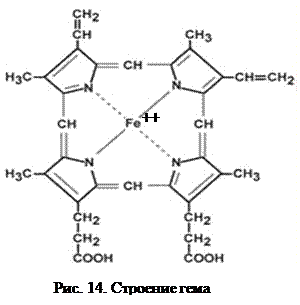
Гем b является также структурной единицей ферментов каталазы и пероксидазы, обезвреживающих пероксиды, и цитохромов – митохондриальных белков, участвующих в переносе электронов от окисляемых веществ в конечном итоге на кислород за счёт своей способности изменять валентность железа.
Гем а встречается в растительных гемопротеинах и участвует в процессе фотосинтеза.
Металлопротеины – сложные белки, где роль небелкового компонента выполняют катионы металлов. Связь между ними ионная или координационная (донорно-акцепторная). Типичными представителями таких белков являются железосодержащие белки.
Ферритин. В его составе ионы Fe 3+ депонируются в клетках селезёнки, костного мозга, но богаче всего этим белком печень. Там может накапливаться до 700 мг железа, которое используется по мере надобности для синтеза гема. Гемосидерин – это комплекс гликопротеина и ионов железа, образуется в тканях при кумулировании избытка железа. Трансферрин – растворимый в воде железопротеин, содержащий ещё олигосахариды (металлогликопротеин). Этот белок вырабатывается гепатоцитами и секретируется в кровь, где служит для транспорта катионов этого металла к клеткам других органов. Молекула трансферрина удерживает два иона железа, которые захватывает в кишечнике или местах распада гема, и осуществляет их перенос к точкам депонирования и утилизации. Церулоплазминаналогично трансферрину обеспечивает транспорт катионов металла, только восьми ионов меди.
Гликопротеины,или гликоконъюгаты. В них простетическая группа представлена углеводными компонентами и связана с белком О-гликозидными (реже N-гликозидными) связями. Небелковый фрагмент некоторых гликопротеидов редко бывает представлен одним моносахаридом; как правило, это олиго- или полисахаридные разветвлённые цепочки. Причём на долю углеводов может приходиться от 1 до 85%.
Исходя из вклада в общую копилку, выделяют два подкласса белков, содержащих углеводы: протеогликаныи гликопротеины. Между ними имеются существенные отличия:
ФОСФОПРОТЕИНЫ
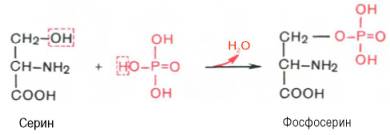
К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб, и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Фосфопротеины занимают особое положение в биохимии фосфорсодержащих соединений не только в результате своеобразия структурной организации, но и вследствие широкого диапазона функций в метаболизме. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата.
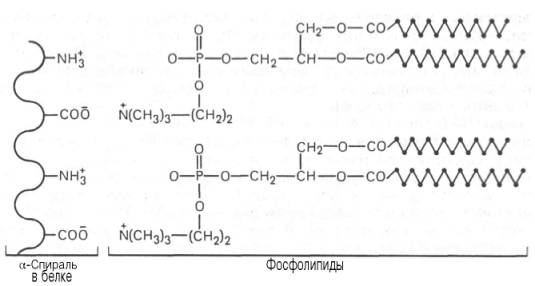
Рис. 2.4. Ионный тип связи между белками и фосфолипидами.
Новые данные свидетельствуют о том, что в клетках фосфопротеины синтезируются в результате посттрансляционной модификации, подвергаясь фосфорилированию при участии протеинкиназ. Этот процесс подробно рассматривается в главе 14. Здесь лишь укажем на существенную роль специфической протеинкиназы, катализирующей фосфорилирование ОН-группы тирозина, в биосинтезе онкобелков. Таким образом, уровень фосфопротеинов в клетке зависит в значительной степени от регулирующего действия ферментов, катализирующих фосфорилирование (протеин-киназы) и дефосфорилирование (протеинфосфатазы). Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, также существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение фосфорилирования–дефосфорилирования в процессах химической модификации макромолекул, участвующих в интегральных процессах метаболизма.
Структура и функции сложных белков: гликопротеиды, протеогликаны, нуклеопротеиды, фосфопротеиды, липопротеиды, хромопротеиды, металлопротеиды.



Сложные белки содержат два компонента – простой белок и небелковое вещество. Последнее называют простетической группой.
Гликопротеины– сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов.
К типичным гликопротеинам относят большинство белковых гормонов, мембранные сложные белки, все антитела, белки плазмы крови, молока, и др. Функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие.
Химический состав гликопротеинов: к полипептиду присоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловой кислотой.
2 типа нуклеопротеинов:– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Они осуществляют такие важные процессы как: репликация, транскрипция и трансляция, транспорт нукл.кислот из ядра в клетку.
Нуклеопротеиды образуются в результате нековалентных взаимодействий белков и нук. кислот.
Фосфопротеиды, содержащие ковалентно связанные остатки фосфорной кислоты(простетическая группа). К фосфопротеидам относятся казеины молока, белки яйца и некоторые тканевые ферменты (фосфорилаза А, гексокиназа и др.), с помощью которых осуществляется перенос фосфатных групп. Большое количество фосфопротеинов содержится в клетках ЦНС. Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала.
Липопротеины. Этот класс сложных белков состоит из белка и простетической группы, представленной каким-либо липидом. Они входят в состав клеточной мембраны и внутриклеточных биомембран ядра, митохондрий, а также присутствуют в свободном состоянии (главным образом в плазме крови). Различают ЛП низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности (ЛПОВП) и ЛП промежуточной плотности (ЛППП). Установлено, что липопротеины участвуют в структурной, комплексной организации миелиновых оболочек, нервной ткани, хлоропластов, фоторецепторной и электронно-транспортной систем, палочек и колбочек сетчатки и др.Большинство ЛП синтезируется в печени или в слизистой оболочке кишечника.
Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо),ифлавопротеины (содержат производные изоаллоксазина). Хромопротеины участвуют в фотосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др.
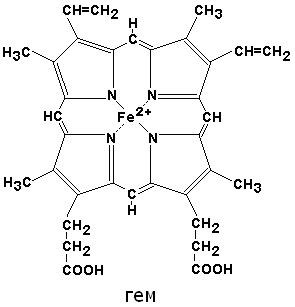
К группе гемопротеинов относятся гемоглобин и его производные.Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем.
Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми производными – окисленными флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. Типичными представителями флавопротеинов, являются ксантин-оксидаза, альдегидоксидаза, ацил-КоА-дегидрогеназа.
К металлопротеинам относятся биополимеры, содержащие, помимо белка, ионы какого-либо одного металла или нескольких металлов. К таким белкам принадлежат, например, белки, содержащие негемовое железо, а также белки связанные с атомами металлов в составе сложных белков-ферментов.
Типичными представителями первых являются железосодержащие белки ферритин(в селезенке, печени, костном мозге, выполняя роль депо железа в организме.), трансферрин(в сыворотке крови, служит физиологическим переносчиком железа в организме.) и гемосидерин(в ретикулоэндотелиоцитах печени и селезенки.).
Ко второй группе металлопротеинов относится ряд ферментов: ферменты, содержащие связанные с молекулой белкаионы металлов, определяющих их функцию(металлоферменты).
Структура и функция азотистых оснований, нуклеозидов, нуклеотидов. Участие в регуляции метаболизма (вторичные месенджеры цГМФ, цАМФ) коферментнАЯ функция, обеспечение энергией (нуклеозид 3 фосфаты) образование активных форм соединений.
Азотистые основания —это ароматические гетероциклические соединения, производные пиримидина или пурина. Азотистые основания выполняет в клетке метаболическую функцию, т.е. входят в состав нуклеозидов.
Пуриновые азотистые основания: Пирамидиновые азотистые основания:

Нуклеозиды.Соединения азотистых оснований с рибозой или 2-дезоксирибозой носят название нуклеозиды. Нуклеозиды выполняют только метаболическую функцию, входят в состав нуклеотидов. Нуклеозиды делятся на:
А) рибонуклеозиды, например: уридин, цитидин, тимидин.
В) дезоксирибонуклеозиды, например: дезокситимидин, дезоксицитидин, дезоксиурацидин.
А) рибонуклеозиды, например: аденазин, гуанозин.
В) дезоксирибонуклеозиды, например: дезоксиаденазин, дезоксигуанозин.
Нуклеотиды образуются из нуклеозидов за счет образования фосфоэфирной связи между фосфатным остатком и 5’ гидроксильной группы. К нуклеозиду может присоединится от 1 до 3 фосфатных остатков(нуклеозидмонофосфат,дифосфат,трифосфат). При расщеплении одной фосфатной группы выделяется 36,36 кДж энергии.
Функции1. метаболическая – нуклеотиды входят в состав нуклеиновых кислот.2. энергетическая – в качестве источника энергии используются НТФ и в частности АТФ и ГТФ, т.к. они содержат макроэргические связи3. регуляторная
цАМФ наделен рядом уникальных функций и высокой биологической активностью в регуляции процессов обмена, выполняя роль медиатора внеклеточных сигналов в клетках животных.
Атомы водорода передаются на вторичные дегидрогеназы, флавопротеиды, коферментом которых служит ФАД(производное вит В2). Основная функция флавопротеидов в цепи тканевого дыхания — перенос водорода.
НАД(производное витВ5)функции которого состоят в переносе водорода.
НАДФ кофермент многих оксидоредуктаз, выполняющий функцию переносчика электронов и протонов.
ФАФС, активированная форма серной кислоты. Участник универсальной системы детоксикации.
Активной формой метионина является S-аденозилметионин SAM.Отдает метильные группы при синтезе адреналина,кератина.
Аминоациладенилат представляет собой активированную аминокислоту. Активированная аминокислота в виде аминоациладенилата вступает под влиянием специального фермента во взаимодействие с находящейся в цитоплазме транспортной РНК.дЛя каждой аминокислоты совят РНК.
15.Структура и функция тРНК, иРНК, рРНК. Транскрипция, процессинг и сплайсинг мРНК.
Структура и функции тРНК,иРНК,рРНК Транспортная РНК, тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм.тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь — будучи в комплексе с аминокислотой — к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса. Матричная рибонуклеиновая кислота (иРНК) — РНК, содержа информ о первичной структуре (аминокислотной последовательности) белков.иРНК синтезна основе ДНК в ходе транскрипции, после чего, используется в ходе трансляции как матрица для синтеза белков. Тем самым иРНК играет важную роль в «проявлении» (экспрессии) генов.
Процессинг мРНК включает:
вырезание неинформативных участков – интронов (рисунок 8.2, в);
сращивание (сплайсинг) информативных участков – экзонов (рисунок 8.2, г);
защиту концевых участков от действия нуклеаз (рисунок 8.2, д):
присоединение 7-метилгуанилата («колпачок») к 5’-концу 5’,5’- фосфодиэфирной связью;
присоединение полиаденилового нуклеотида к 3’-концу.
Образующаяся мРНК поступает из ядра в цитоплазму клеток.
Структура и функция ДНК. Физико-химические свойства (вязкость, температура плавления, поглощение УФ, заряд, пространственная организация). Репликация ДНК, формирование нуклеосом и хроматина.
ОТВЕТ:Структура и функция ДНК служит универсальным хранителем и источником наследственной информации, записанной в виде специальной последовательности нуклеотидов и определяющей свойства живого организма.молекулярная масса от 107 до 109, а число нуклеотидных остатков в молекуле достигает нескольких сотен тысяч и даже миллионов. В ДНК содержится аденин, гуанин, цитозин и тимин. Молекула ДНК состоит из двух полинуклеотидных цепей, закрученных вправо вокруг одной и той же оси образуя двойную спираль. В силу пространственного соответствия структур двух молекул соединяться водородными связями могут лишь аденин с тимином и наоборот, а также гуанин с цитозином и наоборот. Причем между аденином и тимином образуются две вородные связи, а между гуанином и цитозином – три.
Растворы ДНК характер аномальной вязкостью объясняющ удлиненной формой мол, и в потоке обладают двойн, лучепреломлением. УФ излуч не поглощается основными цепочками ДНК, а только пуреиновыми и пиримидиновыми основаниями, благодаря заряду фосфатных гр ДНК имеет заряд «-». Репликация – осуществл по полуконсервативному механизму, процесс реплкации требует дезоксирибонуклеотид 3 фосфат, различных ферменов и аденозин 3 фосфорную к-ту. Задача репликации – снять суперсперелизацию ф-т хиликаза – разрыв связи. Нуклеосомы формир в результате взаимод 4х классов основных белков гистонов H2A, H2B, H3, H4, причем мол 2х последн гистонов могут формиров тетрамер, к к-му присоед 2 димера H2A, H2B. Структуру хроматина формир элементарн фибрилла диаметр 10нм. Для нее известн 4 уровня укладки в более сложные структуры. «регулярная спираль» и «бусы на нитке»
Простые и сложные ферменты, зимогены, изоферменты. Замена эмриональных ферментов из ферментов взрослого человека после рождения. Строение и функции активных и аллостерических центров фермента. Факторы определяющие каталитическую активность ферментов.
Ферменты являются белками, и поэтому подобно белкам делятся на простые и сложные. Простые ферменты состоят только из аминокислот. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминоксилот –апофермент, и небелковую часть-кофактор. Кофактор может называться коферментом или простетической группой. Пример: аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гемм).
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате неольших генетических различий в первичной структуре фермента. Различные ферменты определяют скорость и направление реакции. Примером фермента, имеющего изоферменты,является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов.
В составе фермента выделяют области, с разными функциями.
2.Аллостерический центр- центр регуляции активности фермента, который пространственно отделен от активного центра и есть не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы вызывает изменение конфигурации белка-фермента, а значит и скорости ферментативной реакции.
Различные химические соединения, связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций. На каталитическую активность ферментов влияют и многие другие факторы, которые могут изменять строение или химическую природу ферментов. К числу таких факторов относятся:
1. рН. 2.темпер.3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение) 4. Химические агенты (спирт, мочевина или пероксид водорода)5. Облучение (свет, звук, ионизирующая радиация)
Иногда снижение каталитической активности, вызванное, например изменением рН, обратимо. В таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента.
Специфичность действия ферментов (абсолютная, относительная). Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, температуры,РН. Ингибирование и активирование ферментов – биомедицинские ферменты.
От концентрации субстрата и фермента:
-При увеличении кол-ва молекул фермента скорость реакции возрастает непрерывно и прямо пропорц-но кол-ву фермента.
-При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул ферм-та, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшей увеличении скорости субстрата м/у его молекулами возникает конкуренция за акт.центр. и скорость реакции снижается.
Зависимость от температуры:
Изучение действия различных ингибиторов на ферментативные реакции имеет очень большое значение в медицине. Например, сульфамидные препараты обладают бактериостатическим действием и применяются для лечения многих инфекционных заболеваний. Сульфамидные препараты похожие по строению на п-аминобензойную кислоту, ингибируют синтез фолиевой кислоты, которая необходима для синтеза нуклеиновых кислот в бактериальных клетках. Благодаря этому сульфаниламидные препараты тормозят процесс деления бактерий, оказывая бактериостатическое действие.
Структура и функции сложных белков. Строение и функции миоглобина и гемоглобина.
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.