Фосфор в честь чего назван элемент
Глоссарий. Химия
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятных запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности. Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем. Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году. Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом. Существуют данные, что фосфор умели получать еще арабские алхимики в XII в. То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С: 2Ca3(PO4)2 + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3. Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту: 4HPO3 + 12C → 4P + 2H2 + 12CO.
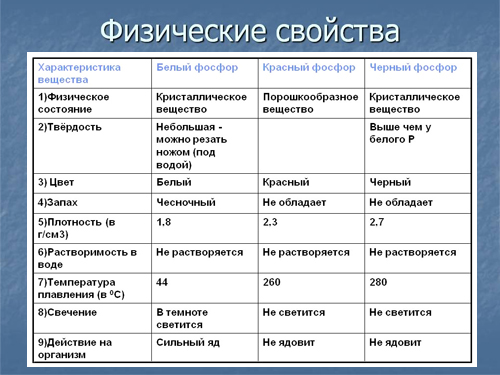
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, черный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов. В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
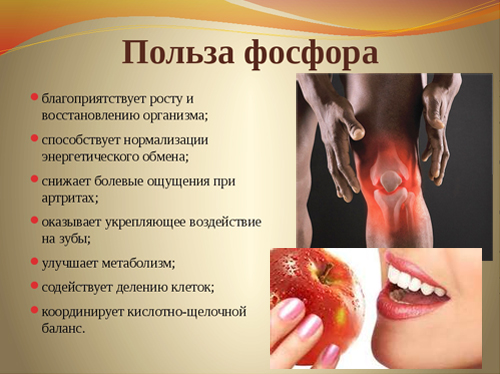
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Фосфор в честь чего назван элемент
Re: 109
санскрит
Re: санскрит
Да, ещё. Информация об элементах у тебя неполная.
110. Ds — Darmstadtium (пресс-релиз ИЮПАК)
111. Rg — Roentgenium (пресс-релиз ИЮПАК)
112. Uub
113. Uut
114. Uuq
115. Uup
В районе озера Вади-эн-Натрун, недалеко от Каира, с давних пор добывалась сода. От названия озера произошло арабское слово natrun (u-долгое) «природная сода». Из него возникло средневековое латинское natrium «сода».
Хэмфри Дэви, выделивший чистые натрий, магний, кальций, барий, стронций и калий методом электролиза, называл натрий по-другому – sodium. Это название и сейчас используется в английском языке. Оно происходит от слова soda, которое появилось средневековой латыни и широко распространилось в языках Европы. Считается, что и у этого слова арабское происхождение, suwwad арабы называли прибрежное морское растение, из которого на острове Сицилия добывали соду.
Открытие Дэви оставило своеобразный след и в английской литературе. В 1880-х годах школьник Эдмунд Клерихью Бентли сочинил комическое стихотворение, посвященное Дэви. Потом этим размером было написано еще много четверостиший, жанр которых назвали в честь школьника – clerihew. Вот самое первое стихотворение этого жанра:
Sir Humphrey
DavyDetested gravy.
He lived in odium
Of having discovered sodium.
Борнокислый натр (Na2B4O7 * 10 H2O) арабские химики называли boraq, в латыни это слово превратилось в borax, а на Руси – в слово бура. Позднее, когда содержащийся в буре элемент был выделен в чистом виде, он получил название бор.
Про медь не до конца ясно. Есть гипотезы, связывающая его с названием иранской области Мидии, где в древности добывали медь. Другие ученые связывают его со miti-, mita- «красный» на языке хеттов.
и про галлий еще
Re: и про галлий еще
Cпасибо за очень интересную и нужную тему.
К данным переводного варианта «Википедии» стоит относится с долей скепсиса, так как она находится в стадии разработки и такое впечатление, что многие сведения в ней не проверяются. Наиболее интересная и полная информация о происхождении названий элементов в свете открытия самих элементов содержится, пожалуй, в «Библиотеке химических элементов». Кроме того, для таких древних славянских названий, как СЕРЕБРО, ЗОЛОТО, ОЛОВО и т. п. целесообразно опираться на «Этимологический словарь» Фасмера, более чем на какое бы то ни было энциклопедическое издание.
Введение
С фосфором знакомы все, кто хотя бы раз держал в руках коробку спичек. Более того, каждый из нас носит в себе довольно много (4,5 кг) этого элемента, но, конечно, в виде химических соединений. Фосфорсодержащие белки присутствуют в мышцах, мозговой ткани и нервах. Но особенно много фосфора содержат кости и зубы: их химический состав почти точно совпадает с формулой минерала фосфорита Ca3(PO4)2.
Название элемента фосфор (светоносец) происходит от латинского фосфорус (светящий) и связано с его открытием – получением белого фосфора. Это было первое точно датированное открытие нового химического элемента.
История открытия элемента
Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.
Несколько позже фосфор был получен другим немецким химиком – Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор – простое вещество, доказал Лавуазье.
Характеристика элемента
Фосфор-химический элемент 15-й группы (по устаревшей классификации – главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор – один из распространённых элементов земной коры: его содержание составляет 0,08–0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ,ДНК), является элементом жизни.
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все возможные аллотропические модификации фосфора пока (2014 г.) до конца не изучены. Традиционно различают четыре его модификации: белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особо, по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора –P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05–0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма – мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор – это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии – тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240–250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» – промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор – это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·10 5 Па.
Металлический фосфор
При 8,3·10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·10 11 Па – ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
(с избытком кислорода)
(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами – галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами – окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами – восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) – РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Простое вещество
Получение
Фосфор получают восстановлением фосфоритов или апатита коксом в присутствии SiO2 в электропечах при 1300-1500 0 C по реакции:
Красный фосфор получают нагреванием белого без доступа воздуха в течение нескольких часов при 375-400 0 C.
Очищают белый фосфор отстаиванием или фильтрованием расплава, переплавкой под слоем разбавленной хромовой смеси, обработкой 10-20%-ным раствором KOH при 90-100 0 C, 50%-ной H2SO4 и деионизированной водой при 41-50 0 C,сублимацией или перегонкой в вакууме либо перегонкой с водяным паром в атмосфере CO2, высокотемпературной обработкой паров (900-1200 0 C) на кварцевой насадке, зонной плавкой. Кристаллы белого фосфора получают испарением растворителя из его растворов в CS2 или бензоле.
Нахождение в природе
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
для взрослых 1,0–2,0 г
для беременных и кормящих женщин 3–3,8 г
для детей и подростков 1,5–2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5–2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Токсикология элементарного фосфора
-Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2–3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении – промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений – 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе – 0,0005 мг/м³, ПДК в питьевой воде – 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества – зарин, зоман, табун, V-газы являются соединениями фосфора.
Использование
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, – это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор – основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) – один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений –суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
-в качестве комплексообразователей (средства для умягчения воды),
-в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Заключение
Фосфор – шестой по содержанию элемент в организме человека после кислорода, водорода, углерода, азота и кальция.