Фосфорная кислота что разъедает
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
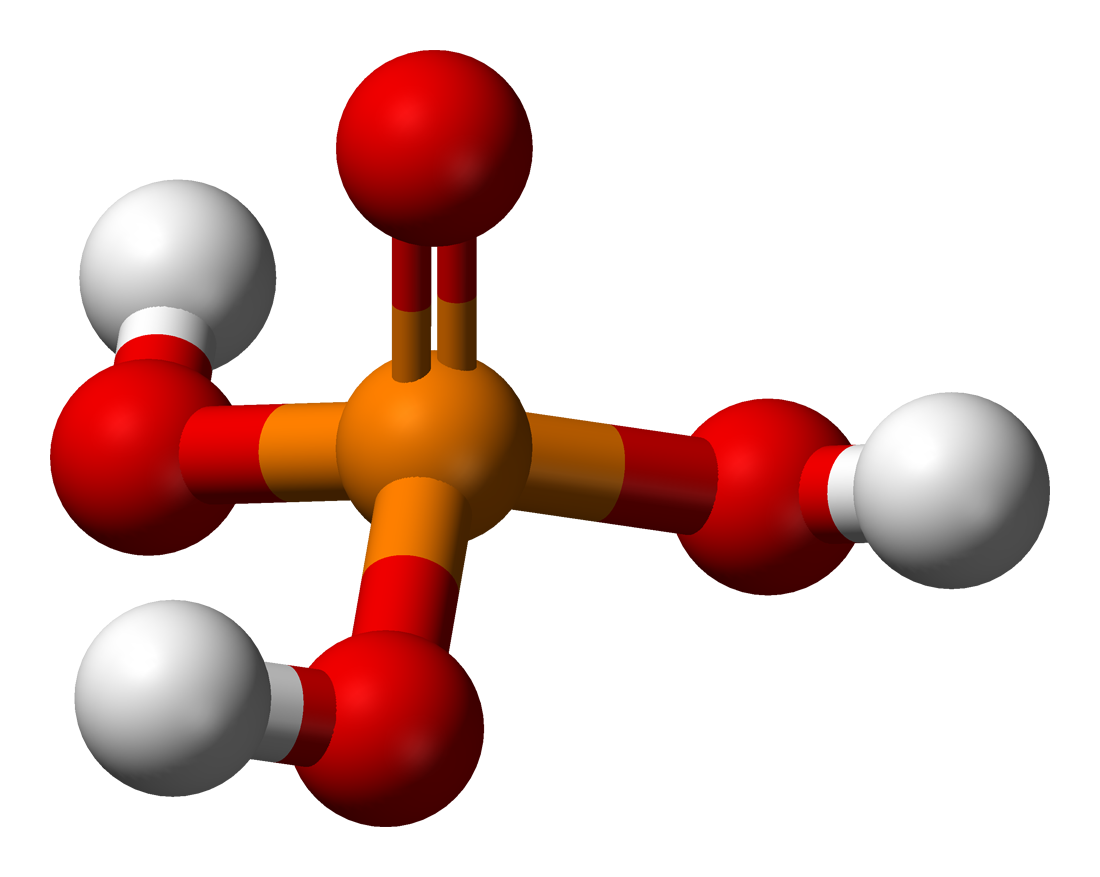
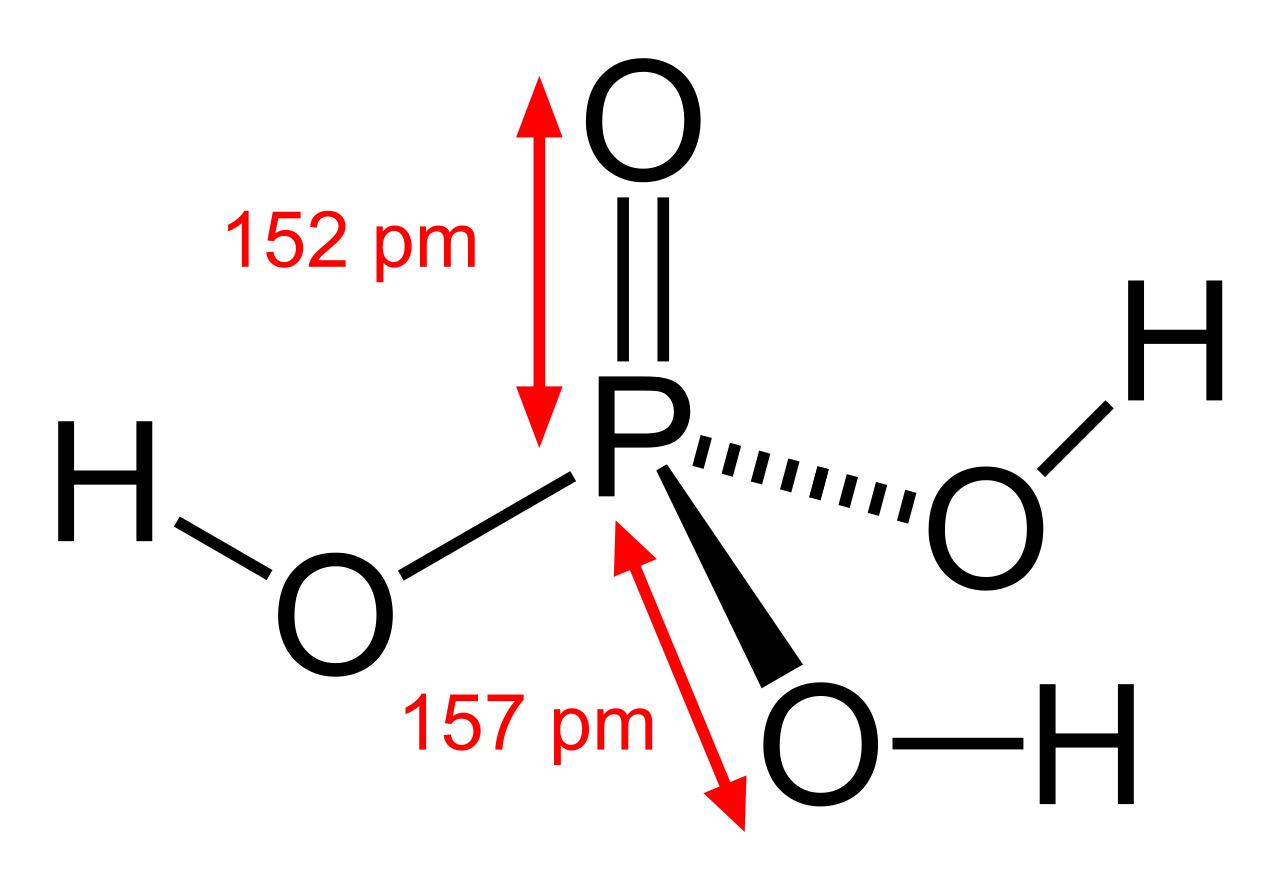
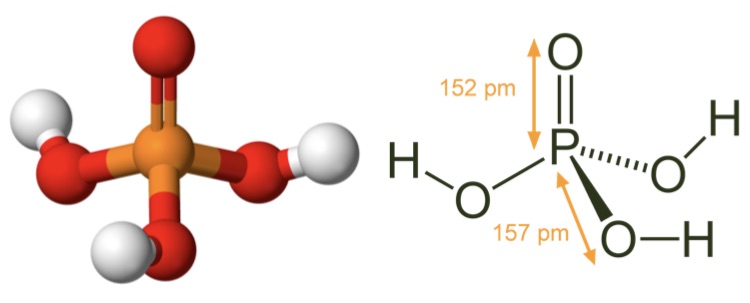
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
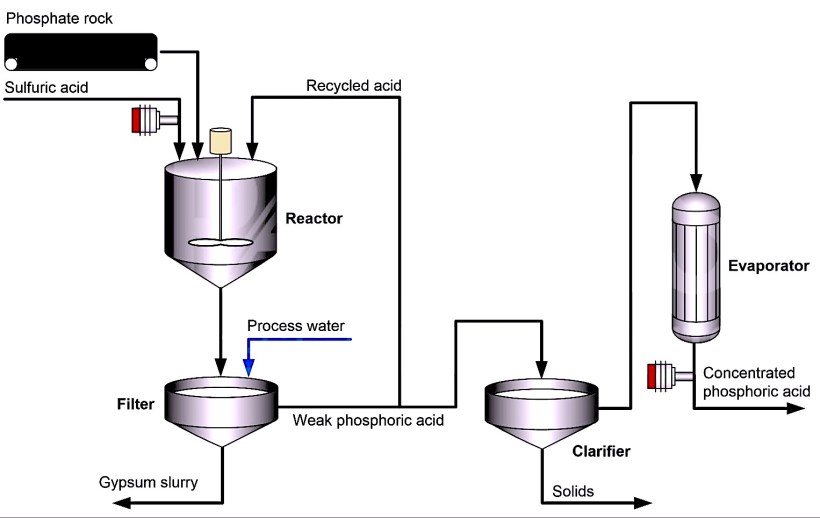
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.
В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Применение ортофосфорной кислоты
Нередко металл и изделия из него подвергаются характерной «болезни», которая проявляется в виде рыжего налета, разъедающего металл. Речь идет о ржавчине. Ее образование происходит благодаря воздействию на поверхность металлического изделия углекислого газа, кислорода и воды. Безусловно, для того чтобы продлить срок службы изделия из металла необходимо как можно скорее начать борьбу с коррозией. Помочь в этом может обработка ортофосфорной кислотой.
Характеристики ортофосфорной кислоты
Ортофосфорная или попросту фосфорная кислота представляется в виде продукта, имеющего неорганическое происхождение. В условиях нормальной комнатной температуры ортофосфорная кислота имеет вид небольших ромбовидных кристалликов.
Чаще всего же ортофосфорная кислота имеет вид сиропообразного 85%-процентного раствора, не имеющего характерного запаха. Кристаллики ортофосфорной кислоты довольно хорошо растворяются в воде или этаноле.
Уравнение ортофосфорной кислоты
Применяется ортофосфорная кислота в следующих отраслях человеческой деятельности:
Если температура окружающей среды, например, в условиях лабораторных исследований превышает показатели в 213 градусов Цельсия, ортофосфорная кислота преобразуется в пирофосфорную кислоту. Состав ортофосфорной кислоты и ее химическая формула, соответственно, изменяется.
Таблица 1. Физико-химические показатели ортофосфорной кислоты согласно ГОСТ 10678-76.
| Наименование показателя | Норма | ||
|---|---|---|---|
| Марка А | Марка Б | ||
| 1-й сорт | 2-й сорт | ||
| 1. Внешний вид | Бесцветная жидкость прозрачная в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или со слабо-желтым оттенком жидкость в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или окрашенная жидкость с оттенком от слабо-желтого до коричневого, не прозрачная в слое 15-20 мм при рассмотрении на белом фоне |
| 2. Массовая доля ортофосфорной кислоты (H3PO4), %, не менее | 73 | 73 | 73 |
| 3. Массовая доля хлоридов, %, не более | 0,005 | 0,01 | 0,02 |
| 4. Массовая доля сульфатов, %, не более | 0,010 | 0,015 | 0,020 |
| 5. Массовая доля нитратов, %, не более | 0,0003 | 0,0005 | 0,0010 |
| 6. Массовая доля железа, %, не более | 0,005 | 0,010 | 0,015 |
| 7. Массовая доля тяжелых металлов сероводородной группы, %, не более | 0,0005 | 0,002 | 0,005 |
| 8. Массовая доля мышьяка, %, не более | 0,0001 | 0,006 | 0,008 |
| 9. Массовая доля восстанавливающих веществ, %, не более | 0,1 | 0,2 | Не нормируется |
| 10. Наличие метафосфорной кислоты | Выдерживает испытание | ||
| 11. Массовая доля взвешенных частиц, %, не более | Выдерживает испытание | 0,3 | |
| 12. Наличие желтого фосфора | Выдерживает испытание | Не нормируется | |







 Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты.
Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты. Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами.
Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами. Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности.
Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности. Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.
Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.

