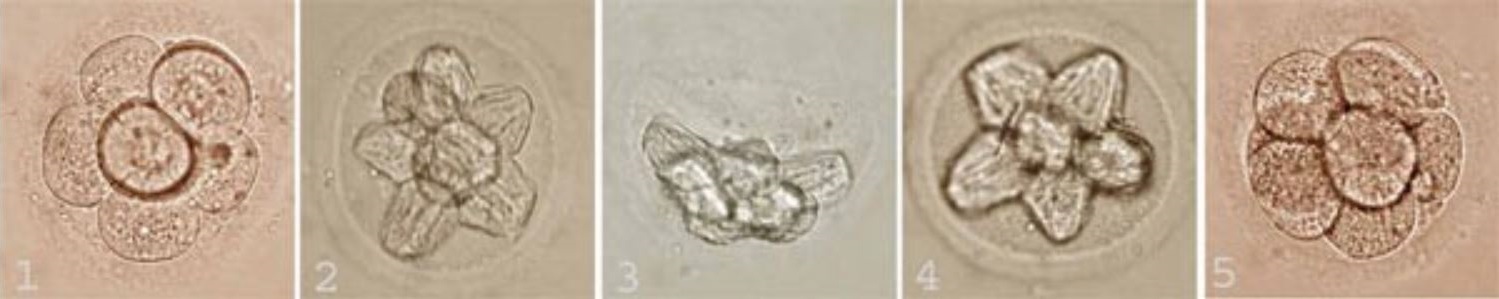
Фрагментация эмбриона при эко что это значит
Неудачи ЭКО: эмбриологический этап

У пациенток младше 35 лет, довольно редко, но также возможно получение яйцеклеток низкого качества. В таких ситуациях крайне сложно ответить на вопрос, с чем может быть это связано, но, как правило, с генетикой, с гормональной стимуляцией, эндометриозом, с различными эндокринными нарушениями (особенно часто с ожирением).
Сейчас активно ведутся исследования по изучению данного фактора бесплодия. Но, к сожалению, пока они не завершены и не имеют практического значения.
В случае установления ооцитарного фактора (а понять это возможно только при получении ооцитов при пункции фолликулов) предлагается замена протокола гормональной стимуляции, переход на ЭКО в естественном цикле. При неэффективности этих схем, переход на ЭКО с донорскими ооцитами.
Плохое качество сперматозоидов не так прямо связано с возрастом мужчины, больше с различными внутренними и внешними неблагоприятными факторами, но также может быть причиной неудач ЭКО.
2. Неправильное оплодотворение
Пронуклеусы в оплодотворённой яйцеклетке становятся видны через 12-14 ч после проникновения в неё сперматозоида. Через 19-22 часа пронуклеусы исчезают и формируется метафазная пластинка, а ещё через 3-4 часа начинается деление зиготы.
Встречаются следующие патологии формирования пронуклеусов:
— * оплодотворении одной яйцеклетки 2-мя сперматозоидами;
— * формирование 3-го пронуклеуса из материала невыделившегося второго полярного тельца;
— * формирование 3-го пронуклеуса путём аномального формирования ядерной мембраны ;
— реже встречаются >3 pn.
ИКСИ (введение одного сперматозоида в цитоплазму яйцеклетки) не гарантирует правильного оплодотворения. Это объясняется главным образом сохранением второго полярного тела во время второго мейотического деления ооцита. Но 3 pn при этом варианте оплодотворения встречается реже, по разным данным
В неправильном оплодотворении могут играть роль следующие факторы:
— повышенные уровни эстрогенов в стимулированном цикле;
— продолжительность гормональной стимуляции;
— качество ооцита («гигантские» ооциты предрасположены к неправильному оплодотворению);
— поздний репродуктивный возраст женщины (по данным американских учёных H. J. Kang, Z. Rosenwaks частота оплодотворения и 3 pn достоверно выше у пациенток после 39 лет, несмотря на метод оплодотворения)
3. Остановка развития эмбрионов после правильного оплодотворения
В современных эмбриологических лабораториях процесс культивирования эмбрионов отработан до мелочей и тщательно соблюдается: индивидуальное культивирование эмбриона в планшетных инкубаторах; постоянный многоуровневый контроль условий культивирования; своевременная смена питательных сред, если культивирование происходит в двухступенчатых средах.
Поэтому при стабильных условиях культивирования, причину плохого развития остается искать только в качестве самого материала.
На остановку эмбриогенеза влияет качество как самих яйцеклеток, так и качество сперматозоидов.
Как правило, основное влияние на ход эмбриогенеза оказывает возраст родителей. Хотя и в молодом возрасте может наблюдаться снижение качества яйцеклеток, например, при эндометриозе, неясном генезе бесплодия. Причиной могут быть аномалии в хромосомном наборе самих родителей.
Принято считать, что до 3 дня развития эмбрион живет и развивается на материнских запасах, то есть, остановка или ухудшение развития до 3 суток указывает на плохое качество яйцеклетки.
На 3 сутки развития начинает работать сам геном эмбриона. И здесь добавляются факторы, привнесенные в эмбрион сперматозоидом. К сожалению, очень многие отклонения от нормы в качестве сперматозоидов и хроматина внутри них оказывают влияние на развитие эмбриона и могут вызывать анеуплоидии или недостаточность генома эмбриона. Качество конденсации и организации ДНК сперматозоида является важным фактором развития эмбриона, даже при выполнении ИКСИ.
Но есть данные, что некоторое количество материнской мРНК сохраняется до стадии бластоцисты и может также участвовать в остановке развития.
Хромосомные аномалии, несомненно, вызывают большой процент потерь эмбрионов. Генетические факторы регулируют скорость предимплантационного развития эмбриона. Существует тенденция к увеличению количества анеуплоидных эмбрионов с увеличением возраста. Большая часть анеуплоидий летальна для эмбриона на ранних стадиях развития. Но некоторые анеуплоидии не мешают эмбриону стать бластоцистой хорошего качества, например, при трисомии по 21 хромосоме, или синдроме Дауна.
В связи с этим, пациентам позднего репродуктивного возраста рекомендуется проведение предимплантационного генетического скрининга до переноса эмбриона в полость матки.
Кроме того, у пар более молодого возраста, если в нескольких циклах ЭКО при переносе эмбриона хорошего качества на стадии бластоцисты в однородный, достаточной толщины и хорошо кровоснабжающийся эндометрий беременность не наступает, необходимо выполнение предимплантационного генетического скрининга на все хромосомы. И, соответсвенно, переносить в полость матки эмбрион только с полным хромосомным набором.
Эмбриологические аспекты ЭКО/ИКСИ
Яйцеклетки (ооциты) полученные во время трансвагинальных пункций в программе ЭКО
День 1. Эмбрионы — оплодотворенные яйцеклетки
День 2. Эмбрионы — классификация качества
Оценка качества эмбрионов по степени фрагментации (A. VanSteiterghemetal., 1995)
— Тип A — эмбрион отличного качества без ануклеарных (безъядерных) фрагментов (4А)
— Тип В — эмбрион хорошего качества с содержанием ануклеарных фрагментов до 20% (4В)
— Тип С — эмбрион удовлетворительного качества с содержанием ануклеарных фрагментов от 21% до 50% (4С)
— Тип D — эмбрион неудовлетворительного качества с содержанием ануклеарных фрагментов более 50% (4D)
День 3. Эмбрионы
На 3-и сутки эмбрион уже состоит из 6-8 бластомеров. До этого момента эмбрион развивался как бы «по инерции», исключительно на материнских «запасах», накопленных в яйцеклетке за время ее роста и развития в яичнике. Если «генетическая книга», в которой закодирована программа нормального развития эмбриона, содержит ошибки, эмбрион останавливается в развитии. Это природный процесс отбора генетически нормальных эмбрионов. Поэтому именно на стадии 4-8 бластомеров 4-19% эмбрионов останавливаются в развитии (так называемый «блок развития»).
День 4. Морула
На 4-е сутки развития эмбрион человека состоит уже, как правило, из 10-16 клеток, межклеточные контакты постепенно уплотняются и поверхность эмбриона сглаживается (процесс компактизации) – начинается стадия морулы (от лат. Morulae – тутовая ягода). Именно на этой стадии invivo (в организме матери) эмбрион попадает из маточной трубы в полость матки. К концу 4-х суток развития внутри морулы постепенно образуется полость – начинается процесс кавитации.
День 5. Бластоцисты
Перенос бластоцисты (перенос на 5-е сутки) имеет большую частоту успешной имплантации, позволяя переносить меньшее количество эмбрионов высокого качества, снижать риск многоплодной беременности при увеличении частоты наступления беременности.
Развитие бластоцисты и имплантация
Вероятность формирования бластоцисты
Преимущества переноса бластоцисты в ЭКО
Вспомогательный хэтчинг
Одним из основных факторов, от которого зависит успех лечения бесплодия методом экстракорпорального оплодотворения является способность эмбриона имплантироваться в стенку матки.
Яйцеклетка человека и эмбрион на ранних стадиях развития окружены защитной двухслойной оболочкой (zona pellucida – блестящая оболочка).
Она играет очень важную роль:
Оболочка эмбриона может быть очень толстой и плотной, и это может мешать его нормальному прикреплению к стенке матки.
Считается, что у «лабораторных» эмбрионов может снижаться выделение специальных ферментов, которые растворяют оболочку, делают её тоньше, способствуя выходу эмбриона. Поэтому было разработано искусственное подобие хетчинга, которое так и назвали – вспомогательный хэтчинг.
Суть метода вспомогательного хетчинга – искусственное истончение блестящей оболочки эмбриона различными способами:
Для этой процедуры мы используем лазерный аппарат OCTAX Laser Shot ТМ (Германия).
OCTAX Laser Shot ТМ — это передовая лазерная технология для ВРТ с цифровым управлением, цифровой обработкой, использованием последних компьютерных технологий и оптики высокого качества.
Суть метода лазерного хетчинга — это использование лазерного луча, что позволяет сделать высокоточный надрез необходимого размера. Лазерный хэтчинг делается только эмбрионам, предназначенным для переноса. Для этого эмбрион фиксируется микропипеткой и высокоточным лазером делается небольшое отверстие в наружной части его оболочки или несколько насечек для истончения ее слоя.
Лазерный хэтчинг практикуется в ведущих центрах всего мира. Исследования утверждают, что его использование повышает шансы наступления беременности (для пациентов которым показана эта процедура). Нет никаких данных о негативном влияние хэтчинга на результат программы лечения бесплодия, эта процедура абсолютно безопасна для самого эмбриона.
Лазерный хэтчинг назначается:
Криоконсервация эмбрионов
Одной из стремительно развивающихся технологий является замораживание или криоконсервация эмбрионов и яйцеклеток с последующим долговременным хранением. Первая беременность, полученная при переносе замороженных эмбрионов человека, наступила ещё в 1983 году. С этого момента технологии криконсервации совершенствовались, отрабатывались и проверялись исследователями и временем. Было установлено, что заморозка не ухудшает качества эмбрионов, но и не улучшает его. Только здоровые, крепкие эмбрионы переживают режим «заморозка / оттаивание».
Что же дает эта процедура пациентам, нужна ли она?
Конечно, нужна, особенно если в цикле ЭКО остаются «неперенесенные» эмбрионы хорошего качества. Такой случай возможен по нескольким причинам.
Во-первых, когда на пункции яичников было получено большое количество яйцеклеток, а в последствии и нормальных, жизнеспособных эмбрионов. Кстати, такой исход возможен не всегда, и пара которой предложили криоконсервацию — счастливчики.
Это дает некую подстраховку и уверенность в будущем. При удачной попытке в цикле стимуляции хранящиеся эмбрионы можно использовать для рождения второго и третьего ребенка, а в случае неудачи — повторить попытку в естественном цикле без большой гормональной нагрузки и операции.
Криоконсервации можно подвергнуть и яйцеклетки. Особенно это актуально в том случае, когда женщина планирует отсрочить материнство до наступления более подходящих социально-экономических условий. С возрастом организм женщины все хуже откликается на гормональную стимуляцию, и получить достаточное количество яйцеклеток хорошего качества не всегда возможно. Новые технологии дают возможность сохранить фертильность пациентам, планирующим химио- и радиотерапию. Криоконсервация в этих случаях дает возможность сохранить молодые, более здоровые яйцеклетки, и в последующем родить своего биологического ребенка.
Методов криоконсервации на сегодняшний день разработано несколько. В эмбриологической лаборатории центра «Тонус МАМА» используется метод ультра быстрого замораживания — витрификация по методу доктора М. Куваямы. Эмбриологи «Тонус МАМА» считают именно его наиболее эффективным, опираясь на многочисленные статистические исследования мирового уровня. Этот метод используется в клинической практике с 2000 года.
При витрификации (от лат. vitrum — стекло и facio — делаю, превращаю) происходит охлаждение до температуры жидкого азота, и переход яйцеклеток и эмбрионов в твердое, стекловидное состояние. Такой особенный вид заморозки возможен благодаря действию специальных веществ — криопротекторов.
Но криопротекторы — это не естественные для клеток составляющие, они токсичны. Чтобы криопротекторы в меньшей степени успели проявить свою токсичность, процедура витрификации проводится достаточно быстро, в чем и состоит преимущество этого метода заморозки. Только эмбрионы и яйцеклетки, застывшие в виде аморфной стекловидной массы, могут долго сохранять жизнеспособность, а при осторожном размораживании их жизнедеятельность полностью восстанавливается, что повышает возможность наступления беременности.
Полное освобождение от криопротекторов происходит приблизительно за 3 часа. По прошествии этого времени эмбрион полностью восстанавливается и готов для переноса в полость матки, а яйцеклетка к процедуре оплодотворения методом ИКСИ.
Особенностью криоконсервации является уплотнение оболочки яйцеклетки или эмбриона, но эта проблема легко решается. В случае разморозки эмбриона проводят вспомогательный хэтчинг (дополнительное рассечение оболочки для выхода из нее эмбриона и удачной имплантации в эндометрий). А в случае яйцеклеки проводят оплодотворение при помощи ИКСИ, и также вспомогательный хэтчинг развившемуся эмбриону.
Таким образом, витрификация позволяет:
Все это значительно увеличивает результативность процедуры ЭКО, сокращает ее стоимость и затрачиваемое время и дает возможность оказать помощь большему количеству семей, желающих иметь ребенка.
Фотографии эмбрионов человека, полученные на различных этапах витрификации
1 — эмбрион до криоконсервации;
2, 3, 4 — так выглядит эмбрион при температуре жидкого азота (−196 °C) — его клетки сильнее обезвожены, но живы;
5 — восстановление размера клеток эмбриона после разморозки (оттаивания).
Записаться на прием к акушеру-гинекологу, репродуктологу вы можете по телефону 8 (831) 411-11-20
Что такое фрагментация?
Понедельник, 1 Июнь 2009
Каждый раз перед переносом эмбрионов в полость матки врач подробно рассказывает пациентке о полученных в программе ЭКО эмбрионах: их количестве и качестве. Качество эмбрионов оценивается в процессе культивирования и непосредственно перед переносом. И нередко среди характеристик качества эмбрионов звучит такая, как «степень фрагментации». Так что же это за явление – фрагментация?
Сначала коротко остановимся на строении бластомера – эмбриональной клетки.
Бластомеры, из которых состоит эмбрион, имеют то же строение, как и большинство соматических клеток взрослого организма.
Снаружи клетка окружена мембраной, а внутреннее содержимое клетки – цитоплазма, представлено гелеобразным веществом. В цитоплазму погружено ядро клетки, содержащее генетический материал. Также в цитоплазме находятся различные органеллы и органические вещества.
Цитоплазматическая фрагментация бластомера – это отделение от клетки фрагментов цитоплазмы, окруженных мембраной. При этом фрагменты не несут ядерного содержимого, то есть весь генетический материал остается в клетке.
Степень фрагментации характеризует количество образовавшихся фрагментов. Для ее оценки во всем мире разработано много классификаций, которые в общих чертах сходны
Степень фрагментации до 25% считается вариантом нормы, поскольку в большинстве случаев такие эмбрионы нормально развиваются и имплантируются. Большая степень фрагментации является признаком сниженной жизнеспособности эмбрионов, при этом, чем сильнее она выражена, тем хуже прогноз на дальнейшее развитие. Но, тем не менее, даже сильно фрагментированные эмбрионы в некоторых случаях могут дать нормальную беременность.
Каковы причины фрагментации? К сожалению, до конца этот вопрос еще не изучен и вызывает много научных споров. По своей природе причины фрагментации можно разделить на две категории: генетически обусловленные и не связанные с генетикой. В первом случае фрагментация возникает у эмбрионов, имеющих серьезные генетические нарушения. Такие эмбрионы, по закону природы, гибнут, и одним из проявлений клеточной гибели является фрагментация. При гибели генетически аномального эмбриона фрагментация, как правило, сильно выражена и наблюдается во всех клетках.
Если эмбрион генетически нормальный, то фрагментация может быть признаком нарушения физиологии отдельных клеток, реакции клеток на негативные воздействия (например, загрязнение окружающей среды, такие заболевания женщины, как ожирение, поликистозные яичники, эндометриоз, возрастные изменения в организме будущей мамы). Также к негативному фактору в период созревания яйцеклеток, из которых получен эмбрион, можно отнести гормональную стимуляцию овуляции. В своей практике наша клиника использует легкую или минимальную стимуляцию.
Снизить вероятность фрагментации эмбрионов, вызванную негативными воздействиями, возможно улучшенными условиями культивирования.
В заключение хотелось бы отметить следующее:
1. Определить причину фрагментации по внешнему виду эмбриона невозможно.
2. По степени фрагментации можно предположительно оценить жизнеспособность эмбриона. Чем выше степень фрагментации – тем больше вероятность генетических нарушений и гибели эмбриона.
3. Фрагментация может быть обратимой, т.е. появившиеся фрагменты способны «возвращаться на место».
4. Фрагментация может быть индивидуальной особенностью нормальных эмбрионов.
Цитоплазматическая фрагментация предимплантационных эмбрионов человека
1) Клиника репродукции человека «АльтраВита», ООО «ЭКО ЦЕНТР», Москва, Россия;
2) ФГБОУ ВО «Московский государственный университет имени М.В. Ломоносова», физический факультет, Москва, Россия
В настоящей работе предпринята попытка обобщить и систематизировать знания относительно феномена цитоплазматической фрагментации эмбрионов, раскрыть причины и механизмы ее возникновения, а также описать ее влияние на жизнеспособность эмбрионов и клинические исходы программ экстракорпорального ЭКО. Поскольку с фрагментацией эмбрионов человека чаще всего сталкиваются во время эмбриологического этапа программ ЭКО, само явление изучено недостаточно. Редкие попытки исследовать этот феномен были узко сфокусированы на связи фрагментации с апоптозом. Причинами такого ограниченного знания явились этические препятствия и практические трудности, связанные с использованием для экспериментов яйцеклеток и эмбрионов человека. Отсутствие подходящей модели среди эмбрионов животных и относительно низкая встречаемость и значимость фрагментации в экспериментальной эмбриологии (у эмбрионов мыши) также способствовали исключению феномена фрагментации как достойного объекта исследования. В обзор вошли данные, полученные за достаточно обширный период, и предпринята попытка всесторонне охватить тему, касающуюся фрагментации эмбрионов. Заключение. Несмотря на то что влияние низкой доли фрагментации (25–30%) снижает жизнеспособность эмбрионов. Результаты исследований по микрохирургическому удалению цитоплазматических фрагментов, его положительному влиянию на жизнеспособность эмбрионов и клинические исходы программ ЭКО являются спорными и требуют дальнейшего подтверждения.
В рамках программ экстракорпорального оплодотворения (ЭКО), при культивировании эмбрионов in vitro, часто наблюдается их атипичное развитие. Появление плеоморфной популяции цитоплазматических фрагментов под zona pellucida является общей чертой ранних эмбрионов. У более чем 50% получаемых in vitro эмбрионов человека можно наблюдать присутствие цитоплазматической фрагментации, то есть наличие в перивителлиновом пространстве эмбриона фрагментов бластомеров различного размера, не содержащие ядра или содержащих фрагменты ядерного материала. Наблюдения показали, что наличие фрагментации часто сопровождается другими аномалиями в развитии, такими как мультиядерность бластомеров, дезорганизация и несоответствие размеров бластомеров стадии развития эмбриона, уменьшение межклеточной адгезии, увеличение толщины zona pellucida.
У эмбрионов человека, полученных посредством ЭКО, фрагментация была впервые описана в 1970 г. [1], однако этот феномен не является уникальным ни для метода ЭКО, ни для эмбрионов человека. Данное явление было описано как у эмбрионов человека, развивающихся in vivo [2–5], так и у эмбрионов практически всех видов млекопитающих, развивающихся в условиях как in vivo, так и in vitro.
Давно известно, что фрагментация эмбрионов человека ассоциирована со снижением их жизнеспособности [6] и представляет собой большую проблему в рамках повышения эффективности вспомогательных репродуктивных технологий (ВРТ). Причины возникновения фрагментации и ее влияние на жизнеспособность эмбриона являются актуальными вопросами как биологии развития, так и практической репродуктивной медицины.
Феномен фрагментации эмбрионов
В 70-х гг. прошлого века Эдвардс при in vitro культивировании эмбрионов человека наблюдал явление, которое он описал как «деление клеток без деления ядра» [1]. Этот феномен наблюдался как у развивающихся, так и у остановившихся в развитии эмбрионов.
В редких случаях фрагментация может возникать на стадии зиготы, перед сингамией, и связана с зиготической/эмбриональной остановкой в развитии. Значительная часть эмбрионов, подвергшихся фрагментации на стадии пронуклеусов, останавливаются в развитии на 1–2-й день либо становятся чрезмерно фрагментированными на 3-й день и непригодными ни для переноса эмбриона, ни для криоконсервации [7]. Цитоплазматическая фрагментация является наиболее распространенной аномалией развития эмбрионов человека, развивающихся in vitro.
Таким образом, фрагментация – это явление, в результате которого образуется плеоморфная популяция безъядерных/микроядерных/мультиядерных, ограниченных оолеммой цитоплазматических структур предимплантационного эмбриона, обнаруживаемых в перивителлиновом пространстве между бластомерами или между бластомерами и zona pellucida.
Фрагментация в условиях in vivo
Фрагментация не является феноменом, наблюдаемым исключительно в условиях in vitro. Эмбрионы различных видов животных, включая приматов и сельскохозяйственных животных, полученные in vivo, также могут быть фрагментированы.
Является ли фрагментация эмбрионов человека столь же распространенным явлением in vivo, как и in vitro, пока неясно. Информация о морфологических особенностях эмбрионов человека, развивающихся in vivo, весьма ограничена. С середины прошлого века было проведено 3 значимых исследования, которые отвечают на некоторые вопросы относительно феномена фрагментации эмбрионов, полученных in vivo [2–4].
В исследованиях Hertig (1954) 4 эмбриона были оценены как аномальные. Помимо присутствия многоядерных бластомеров, при анализе тонких срезов эмбрионов авторы обнаружили в них признаки «клеточной дегенерации или некробиоза», что можно интерпретировать как наличие фрагментации [2].
Ortiz и Croxatto (1979) ассоциировали феномен цитоплазматической фрагментации со «старением» неоплодотворенного ооцита: фрагментация была зафиксирована у 42% неоплодотворенных яйцеклеток, полученных через 96 ч и более, после овуляторного пика лютеинизирующего гормона (ЛГ) у женщин, воздерживающихся от половых контактов. Они также обнаружили 25 аномальных яйцеклеток, полученных из половых путей женщин, у которых были половые контакты. Неясно, была ли фрагментация вызвана «старением» неоплодотворенного ооцита или произошла после оплодотворения [3].
В исследовании Buster et al. (1985) было обнаружено, что 4 яйцеклетки, полученные при лаваже матки через 100 ч и более после овуляции у фертильных доноров ооцитов были полностью интактными. Другие 15 эмбрионов содержали от 2 до 16 бластомеров. Один 6-клеточный эмбрион имел полностью интактные, хотя и неравного размера, бластомеры. Некротический дебрис содержался в перивителлиновом пространстве одного 2-клеточного эмбриона (возможно, вследствие лизиса одного из бластомеров). Другой эмбрион, оцененный как 14-клеточный с неравномерным дроблением, мог фактически содержать цитоплазматические фрагменты, однако сейчас это уже трудно установить [4].
В целом фрагментация присуща эмбрионам, полученным как in vitro, так и in viv.
Оценка качества эмбрионов в программах ЭКО
Несмотря на то что результативность программ ЭКО зависит от множества факторов, главным и решающим этапом, практически определяющим успешность программы, является эмбриологический. А так как различные манипуляции с эмбрионом человека – это передний край современной науки, можете представить себе сложность терминологии, которую используют эмбриологи в своей повседневной деятельности. Ясности не добавляет и обилие различных классификаций и методов оценки качества используемых клеток.
Мы постараемся доступным языком объяснить, что подразумевается под непонятными сочетаниями букв и цифр и дать понимание того, на основе каких данных врачи принимают решения и дают прогнозы на исход программ ЭКО.
Главный эмбриолог, к.б.н.
Хотим сразу предупредить — ни в коем случае не стоит забывать, что для того, чтобы самостоятельно оценить перспективы и принять решение о переносе эмбриона нужно быть настоящим специалистом, имеющим помимо специального образования достаточный опыт.
В каждом конкретном случае решение и прогноз основывается на совокупности всех известных данных и чаще всего является коллективным решением врача и эмбриолога. Главная сложность состоит в том, что каждому этапу развития эмбриона соответствует своя система оценки качества и способ записи этой оценки. И для того чтобы понимать обозначения вроде «8с» необходимо хотя бы немного разобраться в содержании этих этапов и сопутствующих терминах.
День первый
На первом этапе эмбриолог оценивает признаки оплодотворения после проведенной процедуры ЭКО, ИКСИ, ИМСИ или PICSI. На этом этапе в эмбрионе оценивают наличие, количество, симметричность, внутреннее строение и внешний вид пронуклеусов.
Пронуклеусы — это ядра мужской и женской половых клеток еще не слившихся и несущих одинарный набор хромосом.
По их количеству и внешнему виду оценивают жизнеспособность эмбриона и перспективы возникновения патологий. В норме их должно быть два, они должны иметь относительно равные размеры, находиться рядом и иметь внутри «ядрышки» — пронуклеоли тоже в определенном количестве и расположенные определенным образом. На этом этапе может формироваться множество патологий, например, при присутствии только одного пронуклеуса оплодотворение и не сможет произойти, ведь именно это образование и есть носитель генетического материала, а без участия противоположного пола размножаться мы еще не научились. Пронуклеусов может оказаться и три. Такие эмбрионы часто несут аномальный, тройной набор хромосом и нежизнеспособны. Обычно они погибают до имплантации (прикрепления к стенке матки) или приводят к замершей беременности. Такие эмбрионы отбраковываются и не используются в программах ЭКО.
День второй
Вторые сутки знаменуются соединением ядер женской гаметы и мужской, а также процессом дробления зиготы, которая на этой стадии становится эмбрионом. Численность бластомеров (эмбриональных клеток) – 2–4, но их объем не увеличивается.
Дробление эмбрионов оценивается специалистом по таким критериям:
Уровень фрагментации и численность бластомеров классифицируется по типам следующим образом:
Самый качественный эмбрион — 4А, где 4 — количество бластомеров, А — отсутствие фрагментации.

День третий
Продолжается дробление эмбриона, у которого насчитывается от 4 до 9 бластомеров. В начале третьего дня развития запускается собственная генетическая программа, которая в некоторых случаях содержит «опечатки». До этого эмбрион для своего роста «пользуется» веществами, накопленными яйцеклеткой во время ее созревания. Если эмбрион имеет мутации в программе («блок развития»), то далее он не развивается. Это происходит примерно в 20% случаях.
Причиной «блока развития» может быть низкокачественная семенная жидкость или яйцеклетка. Изначальное неудовлетворительное развитие эмбриона свидетельствует о проблемах с яйцеклеткой, если эмбрион «страдает» с третьих суток культивирования, то сперма была ненадлежащего качества. «Блок развития» – это так называемый естественный отбор, эволюционный спасительный механизм, который останавливает развитие некачественных эмбрионов. Как в дальнейшем будет развиваться и расти эмбрион зависит от сформированного генома и своевременности начала его функционирования.

День четвертый
К этому сроку эмбрион содержит до восьми бластомер. Клетки контактируют значительно активнее, поверхность у эмбриона немного сглаживается. Культивирование эмбриона третьи сутки характеризуется началом такого процесса, как компактизация, когда границы эмбриональных клеток различить невозможно. Компактизация бывает частичная или полная. Если этот процесс произошел на второй день, то возможно эмбрион развивается неправильно, с отклонениями, что отображается в эмбриологическом протоколе. Готовится переход эмбриона в бластоцисту.
В моруле (трехдневный эмбрион) содержится до 16 бластомеров.
При естественном зачатии на этом сроке эмбрион транспортируется из фаллопиевых труб в матку. По окончании четвертых суток происходит кавитация, когда внутри эмбриона образуется пустота. В процессе эмбрионального роста за пределы зародышевой оболочки выходит определенное количество клеток. Эти клетки при необходимости генетического исследования забирают на анализ. Диагностику проводит эмбриолог на 5–6 сутки, прокалывая зародышевую оболочку. Биопсия абсолютно безопасна для эмбриона и не вредит его развитию. До получения диагностических данных эмбрионы криоконсервируют.
Результаты исследования напрямую повлияют на дальнейшую «судьбу» эмбриона, характеристики которого никак не меняются после размораживания. Современные безопасные технологии замораживания биоматериала позволили широко внедрить в различные программы ВРТ генетическую диагностику. На четвертый день оценка эмбриона малоинформативна, но его можно оценить по численности компактизированных клеток. Чем больше таких клеток, тем вероятнее эмбрион станет бластоцистой.
Оценивание компактизации происходит по классам:
Не во всех лабораториях происходит оценка по такому критерию.

День пятый
На данном этапе, включающем период с конца четвертого до начала шестого дня, морула, полость которой составляет половину своего объема, становится бластоцистой, состоящей из двух типов клеток:
Ооцит окружен блестящей оболочкой плотной консистенции (Zona pellucida), выполняющей две функции: она препятствует проникновению в яйцеклетку более одного спермия и удерживает вместе бластомеры. По мере роста внутриэмбриональная полость расширяется, приводя к разрыву оболочки, в результате чего происходит выход бластоцисты или «хэтчинг» (вылупление). На этом этапе оценка эмбриона происходит по таким критериям:
Качество обозначается цифрами (1–5), количество — буквами (А-С).
На пятый день бластоцисты переносят в матку или замораживают. Бластоцисты оценивают по степени зрелости (бластуляция):

Оценка эмбриобласта
Важнейший критерий внутриклеточной массы (ВКМ) – плотность, сгруппированность. Эмбрион считается более качественным, если отмечается высокая плотность ВКМ.
Критерии трофэктодермы – количество и маленький размер:
Степень приживаемости эмбрионов в полости матки оценивают спустя две недели по исследованию крови на ХГЧ. Более достоверная информация будет получена с помощью УЗ-диагностики через три недели. Вероятность наступления беременности зависит во многом от качества имплантированных эмбрионов. Морфологические данные, используемые для оценивания эмбрионов, являются необходимыми и основными, но этого не всегда достаточно. Иногда при переносе высококачественных эмбрионов они не имплантируются. В других случаях при переносе эмбрионов невысокого качества наступает беременность. Поэтому эмбриологи используют дополнительные варианты оценивания, позволяющие спрогнозировать имплантацию.
Развитие эмбрионов является сложным трудоемким процессом, в котором нужно учитывать массу тонких нюансов, что под силу только высокопрофессиональным специалистам. Если в ходе проведения программы ЭКО удалось довести 40% эмбрионов до этапа бластоцисты отличного качества, то программа считается успешной.
В этом плане криотехнологии, применяемые в протоколах ЭКО, неоценимы, поскольку есть возможность не только перенести в матку высококачественные эмбрионы, но и заморозить оставшиеся. Это преимущество позволяет использовать криозамороженный биоматериал при следующем переносе, минуя несколько небезопасных для здоровья и дорогостоящих этапов.
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.