Фуцидин или банеоцин что лучше
Банеоцин — местный комбинированный антибактериальный препарат в двух лекарственных формах (порошок и мазь), содержащий в своем составе два бактерицидных антибиотика (неомицин и бацитрацин). Совместное действие антибиотиков повышает эффективность препарата против ряда микроорганизмов, в частности стафилококков. Он предназначен для лечения бытовых, спортивных и производственных ран, очаговых инфекционных поражений кожи. Не попадает в системный кровоток. Две лекарственные формы препарата применяются на разных этапах развития и заживления раневой поверхности. Действие лекарственного средства направлено на устранение воспаления и сыпи на коже.
Показания
Банеоцин в любой лекарственной форме (мазь, порошок) назначается в качестве местной терапии инфекционно-воспалительных кожных заболеваний. Такие заболевания могут быть вызваны различными микроорганизмами. Так, препарат применяют в качестве профилактики и лечения:
Противопоказания
Но даже несмотря на безопасность препарата Банеоцин и его применения при серьезных поражениях кожного покрова, у мази и порошка есть противопоказания. Их нельзя использовать при:
С осторожностью следует назначать препарат пациентам с нарушением функции печени и/или почек, ацидозом, тяжелой миастенией или другими нейромышечными заболеваниями.
Побочные эффекты
Что касается негативных реакций организма на применение порошка или мази, то клинические исследования говорят о хорошей переносимости препарата в любой его лекарственной форме. Он действует на поверхностных слоях кожи и практически не всасывается в кровь. А это значит, что вероятность возникновения побочных эффектов довольно низкая. Но использовать лекарственное средство нужно правильно – на небольших проблемных участках кожного покрова и слизистых оболочках. Если же применять препарат неправильно или не соблюдать меры предосторожности, то вероятность возникновения побочных эффектов возрастает. В основном негативные реакции возникают в местах нанесения препарата.
Банеоцин может вызвать аллергические симптомы, но такой побочный эффект довольно редкий
Итак, в инструкции к применению препарата Банеоцин указаны следующие побочные эффекты:
Инструкция по применению (порошок)
Порошок применяют 2-4 раза в день, нанося его тонким слоем на пораженные участки кожного покрова. Причем в неделю можно использовать не более 200 грамм порошка. Если терапия проводится повторно, то максимальная дозировка в неделю снижается до 100 грамм.
Если у пациента диагностированы ожоги, занимающие более 20% поверхности тела, то препарат применяют раз в 24 часа, так как через поврежденный кожный покров активные компоненты могут всасываться в системный кровоток. Это в свою очередь может привести к возникновению побочных эффектов.
Чаще всего порошок назначают в следующих случаях:
Инструкция по применению (мазь)
Банеоцин мазь (описание)
В виде мази используют 2-3 раза в сутки, нанося ее тонким слоем на пораженные участки кожи. По рекомендации врача Банеоцин можно наносить под повязку. В послеоперационный период мазь наносят прямо на бинты как дополнительную местную терапию инфицированных ран и полостей.
Чаще всего мазь назначают в следующих случаях:
Беременность и период лактации
Использование антибиотика в период беременности
Банеоцин в виде мази или порошка может использоваться беременной или кормящей женщиной только в случае назначения такой терапии врачом. И его применение оправдано только, когда положительный результат лечения превышает вред для плода или новорожденного.
Банеоцин для детей
Для лечения детей любого возраста может быть назначен только после консультации с врачом-педиатром. Обычно поводами для использования порошка или мази становятся фурункулы, карбункулы, паронихия, гнойный гидраденит, ожоги и ветряная оспа (ветрянка).
Порошок Банеоцин для новорожденных применяют с целью предупреждения гнойно-септических осложнений и как профилактику формирования пупочной инфекции.
Взаимодействие с другими лекарствами
Хоть Банеоцин применяется местно и не попадает в системный кровоток, все-таки стоит обратить внимание на взаимодействие его с другими лекарственными средствами. Например, параллельное применение аминогликозидов или цефалоспоринов повышает риск формирования нефротоксических явлений. А одновременный прием с Фуросемидом или Этакриновой кислотой увеличивает возможность возникновения нефротоксических и ототоксических реакций. Использовать Банеоцин с миорелаксантами, анестетиками и опиоидными анальгетиками нужно с осторожностью. Это может привести развитию нейромышечной блокады.
Что касается совместимости лекарства с алкоголем, то при их одновременном приеме препарат снижает свою результативность вплоть до отсутствия терапевтического эффекта. Также, алкоголь усиливает побочные действия от препарата и с большой долей вероятности вызовет высыпания на коже. Иногда отмечается сонливость и общая вялость.
Банеоцин от прыщей
Перед применением необходимо проконсультироваться с врачом
В любой его лекарственной форме считается одним из эффективных препаратов от угревой сыпи и особенно для лечения гнойных высыпаний. Следует понимать, что Банеоцин это довольно сильный антибиотик, и его применение должно быть согласовано с лечащим врачом-дерматологом.
Сам по себе Банеоцин справляется с высыпаниями, но только им одним не обойтись. Терапевтическое лечение должно быть комплексным и включать в себя тщательное очищение кожи, ежедневный уход, сбалансированное питание, применение лекарственной косметики, правильный режим дня и при необходимости медикаментозную терапию.
Частота применения препарата зависит от выраженности заболевания и от рекомендаций врача. Если высыпания незначительные, то мазь или порошок применяют 1 раз в день. Если поражение кожных покровов обширное, то частота увеличивается до 2-4 нанесений в сутки. Чтобы не пересушить кожу, Банеоцин применяется точечно. Если воспален большой участок кожи, то разрешено нанести Банеоцин тонким слоем на всю пораженную поверхность. Препарат следует применять ежедневно, но не более двух недель. Повторный курс разрешено проводить после 2-3 недельного перерыва
Аналоги
Аналоги мази и порошка Банеоцин представлены лечебными средствами, используемыми для местного применения (мази, аэрозоли, крема, растворы): Бактробан, Альтарго, Гентамицин, Хитозан-Гент, Левомицетин, Тирозур, Синтомицин, Фузидерм, Неомицин, Супироцин, Фузикутан.
Банеоцин или Левомеколь?
Мазь Левомеколь — это комбинированный препарат, имеющий антимикробное, противоотечное и иммуностимулирующее действие. Банеоцин — комбинированный антибиотик, имеющий две лекарственные формы (порошок и мазь). Составы лекарств Банеоцин и Левомеколь абсолютно разные. Оба препарата не попадают в системный кровоток.
Из-за содержания в составе лекарства Банеоцин двух антибиотиков, его действие широкое и мощное, в отличие от аналога Левомеколь. Но у последнего в составе есть компоненты, которые влияют на скорость регенерации тканей, чего нет у препарата Банеоцин. Также, Левомеколь быстрее очищает рану от гноя и экссудата.
Если рана начинает инфицироваться, но в ней нет или мало отделяемого и гноя, то применяют Банеоцин. Если же в полости скопилось достаточно много гноя или некротических масс, то оптимальным будет использование мази Левомеколь. Если ожог свежий и/или мокнущий, то с целью профилактики инфицирования применяют Банеоцин. При наличии отека и/или медленной регенерации тканей назначают Левомеколь.
И хоть общее действие у них схоже, каждый конкретный случай применения препаратов зависит от заболевания, его течения и наличия осложнений. Дать рекомендацию по применению может исключительно лечащий врач.
Наружная терапия пиодермии у детей
Показаны клиническая эффективность и безопасность препаратов, содержащих фузидиевую кислоту, в педиатрической практике при лечении пациентов с диффузной стрептодермией, вульгарным импетиго, атопическим дерматитом, осложненном стрептостафилодермией.
Clinical efficiency and safety of the medications containing Fuzidy acid, in pediatric practice in treatment of patients with diffusive streptococcal impetigo, impetigo vulgaris, atopic dermatitis, complicated by streptostaphyloderma.
Пиодермии являются наиболее распространенными кожными заболеваниями во всех возрастных группах. Бактериальные инфекции кожи являются междисциплинарной проблемой, они встречаются в практике хирургов, терапевтов, педиатров, гинекологов. Несмотря на очевидные успехи в разработке методов терапии пиодермий, в педиатрической практике могут возникать определенные трудности при разработке алгоритма лечения, обусловленные особенностями строения детской кожи, распространением сенсибилизации ко многим лекарственным средствам. Кроме того, широкое применение антибиотикотерапии привело к распространению резистентности ко многим препаратам.
В связи с этим особое внимание привлекают лекарственные средства для наружного применения, обладающие достаточной эффективностью и переносимостью. К ним относится фузидиевая кислота [1].
Препарат относится к лекарственным средствам с бактериостатическим типом действия, в высоких дозах в отношении наиболее чувствительных микроорганизмов проявляет бактерицидный эффект. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, она взаимодействует с так называемым фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов. Резистентность бактерий к фузидиевой кислоте развивается достаточно редко и медленно и, несмотря на длительное использование лекарственных средств, не имеет клинического значения. Среди чувствительных и устойчивых к метициллину стафилококков штаммы, резистентные к фузидиевой кислоте, регистрируются в различных странах в пределах 1–6%. В России, как правило, выделяются чувствительные штаммы. За последние годы препарат приобретает основное значение в терапии инфекций стафилококковой и стрептококковой этиологии, так как эффективен в отношении большинства полирезистентных штаммов.
В ранее представленных наблюдениях показана эффективность фузидиевой кислоты при пиодермиях [1], а в комбинации с топическими глюкокортикоидами — при аллергических дерматозах, сопровождающихся значительным распространением патогенной микрофлоры [2–5]. Представлены доказательства безопасности применения лекарственных средств, содержащих фузидиевую кислоту [4, 5].
В клинической практике используются препараты, содержащие фузидиевую кислоту: мазь и крем Фуцидин, а также комбинированные с топическими стероидами: мазь и крем Фуцикорт (с добавлением бетаметазона валерата), крем Фуцидин Г (с добавлением гидрокортизона).
Целью настоящего исследования было изучение клинической эффективности и безопасности препаратов, содержащих фузидиевую кислоту, в педиатрической практике.
Материалы и методы
Под нашим наблюдением находилось 56 детей в возрасте от 4 до 14 лет, в том числе 32 девочки, 24 мальчика. Диффузная стрептодермия была диагностирована у 12 пациентов, вульгарное импетиго — у 11 (у 6 детей — развившееся на фоне аллергического дерматита, у 5 — на фоне токсидермии), атопический дерматит, осложненный стрептостафилодермией, — у 33 пациентов.
Двум детям, страдавшим диффузной стрептодермией, ранее назначали синтомициновую эмульсию, при этом какого-либо терапевтического эффекта не отмечалось. Пациенты, страдавшие вульгарным импетиго, ранее получали антигистаминные и десенсибилизирующие средства внутрь, наружно — топические глюкокортикоидные средства, без выраженного эффекта. Все пациенты, страдавшие атопическим дерматитом, ранее получали повторные курсы антигистаминных, десенсибилизирующих средств внутрь и парентерально, наружно — топические глюкокортикоидные средства, анилиновые красители — с кратковременным терапевтическим эффектом. Десять пациентов ранее какой-либо терапии не получали.
Во всех случаях имелись характерные внешние клинические признаки перечисленных заболеваний. Пациенты с вульгарным импетиго и атопическим дерматитом предъявляли жалобы на зуд в очагах поражения.
Пациентам, страдавшим диффузной стрептодермией, назначали на очаги поражения на лице — крем Фуцидин Г, на других участках кожного покрова (на туловище, руках, ногах) — мазь Фуцидин.
Пациенты, страдавшие вульгарным импетиго, атопическим дерматитом, получали антигистаминные препараты, десенсибилизирующие средства. На очаги поражения на лице наружно назначали — крем Фуцидин Г, на других участках кожного покрова (на туловище, руках, ногах) — мазь Фуцикорт.
При проведении терапии оценивалась переносимость и эффективность лечения, а также показатели периферической крови, мочи.
Результаты
Непосредственное нанесение наружных средств, содержащих фузидиевую кислоту, не сопровождалось отрицательными эмоциями, беспокойством детей на протяжении всего курса терапии.
К концу 3-го дня от начала терапии у всех пациентов был отмечен регресс пиококковых высыпаний, уменьшение субъективных ощущений. На 10-й день терапии у всех пациентов, страдавших диффузной стрептодермией и вульгарным импетиго, отмечено выздоровление. У 16 пациентов, страдавших атопическим дерматитом, отмечено значительное улучшение, у 17 — улучшение.
Все наблюдавшиеся нами дети лечение переносили хорошо, побочных реакций и нежелательных явлений отмечено не было. Какого-либо негативного влияния терапии на показатели периферической крови и мочи отмечено не было.
Обсуждение
Представленные результаты подтверждают высокую эффективность и безопасность фузидиевой кислоты при гнойничковых поражениях кожи. Использование различных лекарственных форм, содержащих фузидиевую кислоту, отличалось высокой комплаентностью.
Во всех случаях диффузной стрептодермии в результате монотерапии достигнуто выздоровление.
Использование комбинированных препаратов в комплексной терапии позволило достичь выздоровления при вульгарном импетиго и выраженных положительных результатов при столь тяжелом хроническом дерматозе, как атопический дерматит.
Для педиатрической практики особенно важна возможность выбора различных лекарственных форм препарата. Так, мазь Фуцидин была эффективна при назначении на очаги поражения диффузной стрептодермии на туловище, руках, ногах. Применение негалогенизированного топического стероидного средства с высоким уровнем безопасности — гидрокортизона в сочетании с фузидиевой кислотой (крем Фуцидин Г) позволило достичь положительных результатов при назначении его на очаги поражения на лице у детей при диффузной стрептодермии, вульгарном импетиго, атопическом дерматите. При выраженном зуде, сопровождавшем атопический дерматит, на очаги на туловище, руках, ногах оказалось эффективным использование мази Фуцикорт.
Курс лечения составил 10 дней, для достижения терапевтических результатов не потребовалось дополнительного назначения антибактериальных препаратов внутрь либо парентерально.
С другой стороны, достигнутый терапевтический эффект косвенно доказывает отсутствие резистентности стафилококковой и стрептококковой микрофлоры кожи к фузидиевой кислоте.
Отмечена хорошая переносимость как монотерапии, так и комплексного лечения с использованием фузидиевой кислоты.
Заключение
Анализ данных литературы и собственные наблюдения свидетельствуют о высокой безопасности и эффективности наружных средств, содержащих фузидиевую кислоту. В педиатрической практике целесообразно использовать различные лекарственные формы с учетом клинической картины и локализации процесса.
Выводы
Литература
И. В. Хамаганова, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва
Содержание
Дерматология в России
Зарегистрируйтесь!
Если Вы врач, то после регистрации на сайте Вы получите доступ к специальной информации.
Если Вы уже зарегистрированы, введите имя и пароль (форма в верхнем правом углу или здесь).
Пероральные антибиотики в терапии стрептодермии
ПЕРОРАЛЬНЫЕ АНТИБИОТИКИ В ТЕРАПИИ СТРЕПТОДЕРМИИ Устинов М. В., Сирмайс Н. С. Кафедра дерматовенерологии ИПК ФМБА России ВВЕДЕНИЕ. В большинстве отечественных руководств по дерматовенерологии при лечении острых форм поверхностной стрептодермии отдается предпочтение наружной терапии. В зарубежных руководствах для обозначения вышеперечисленных форм стрептодермии мы встречаем термин «импетиго», а ведущая этиологическая роль зачастую отдается не стрептококкам, а стафилококкам или же комбинации этих бактерий. Соответственно такой же подход использован в Международной классификации болезни 10го пересмотра. При этом в зарубежных руководствах наружная терапия рекомендуется только в случаях ограниченной локализованной инфекции, во всех остальных случаях рекомендуются системные антибиотики. Пик заболеваемости импетиго приходится на конец августа — начало сентября, с возвращением детей и подростков из мест проведения летнего отдыха. Проанализировав 50 амбулаторных карт подряд без предварительного отбора с диагнозами, обозначенными по классификатору МКБ10 как L01.0, мы пришли к выводу, что пациенты с локализованными ограниченными формами, даже среди пациентов первого года жизни, на прием к специалистам не приходили. В анамнезе у многих самолечение анилиновыми красителями, фукорцином, левомеколем, линиментом по Вишневскому и другими препаратами — первое, к чему прибегают пациенты или их родители. Такое лечение нередко не только не дает искомого результата, но и приводит к распространению процесса, появлению выраженного воспаления, проявляющегося экссудацией, выраженной гиперемией и инфильтрацией краевых зон очагов, что в итоге и служит поводом для обращения в КВД. В нашей практике мы применяем современные антибактериальные мази с хорошей фиксацией к коже в зоне очагов без покрытий и повязок: Бактробан, Банеоцин, Фуцидин совместно с однократным в день нанесением Фукорцина до полной эпителизации. При локализации процесса в перианальных зонах, в складках, при выраженном воспалении в очагах и экзематизации предпочтение отдается комбинированным препаратам: Акридерм Гента или ГК, Белогент, Кандидерм, Пимафукорт, Тридерм, Фуцидин Г, Фуцикорт, манипулируя активностью входящего в состав глюкокортикостероида, так как в большинстве случаев было достаточного силы гидрокортизона. ЦЕЛЬ ИССЛЕДОВАНИЯ — оценить эффективность комбинированной терапии распространенного импетиго с использованием пероральных антибиотиков в сравнении только с наружной антибактериальной терапией. МАТЕРИАЛ И МЕТОДЫ. Исследование проводилось в условиях амбулаторнополиклинического приема в кожновенерологических диспансерах № 9 и 30 Управления здравоохранения Москвы. Верификация диагноза проводилась по клинической картине и анамнестически. Предложенная схема лечения включала использование наружного препарата (Банеоцина или Пимафукорта, в зависимости от выраженности воспалительного компонента) в контрольной группе (20 пациентов) и комбинацию наружного препарата с пероральным антибиотиком в исследуемой группе (20 больных). Больные в группы распределялись равномерно с учетом возраста и степенью распространенности процесса, возраст больных — от года и выше. В качестве антибиотиков предпочтение отдавалось препаратам пенициллинового ряда с хорошей антистафилококковой и антистрептококковой активностью: детской суспензии Аугментина (доступного по льготным рецептам), а у возрастной категории, не попадающей под действие льгот (более 3 лет), — Флемоксину Солютаб в таблетках как препарату, построенному на матрице с высоким профилем безопасности и минимальным риском развития побочных эффектов. Срок назначения — 7 дней (одна упаковка препарата в соответствующей возрастной дозировке). В случае указания в анамнезе на непереносимость пенициллинового ряда, при нежелании принимать антибиотики внутрь пациенты распределялись в контрольную группу. Больным рекомендовался рациональный, соответствующий погоде режим труда и отдыха и гигиенический режим. Лечение проводили до разрешения элементов заболевания, чаще до появления остаточной гипопигментации, и до отсутствия появления новых очагов. РЕЗУЛЬТАТЫ. Сроки лечения в контрольной группе составили 10,6 дня, в исследуемой группе — 6,8 дня; время ухода субъективной симптоматики в исследуемой группе также было значимо ниже, переносимость же и приверженность к терапии существенно не отличались. ЗАКЛЮЧЕНИЕ. Применять или не применять пероральные антибиотики — решает врач, учитывая все «за» и «против» у каждого конкретного пациента. Зачастую на такое решение имеет влияние социальная составляющая: необходимость выписки больничного листа родителям детей, изолируемых из детских коллективов, а для детей более старшего возраста — пропуски учебных занятий в школе. В таких случаях предпочтение следует отдавать применению комбинированной терапии как более надежному и быстрому способу достижения ремиссии.
ФЛЕГМОНЫ И АБСЦЕССЫ — современные возможности лечения
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?
Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
 |
| Рис. 1 |
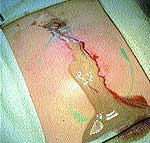
При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
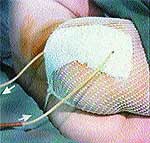 |
| Рис. 3 |
Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
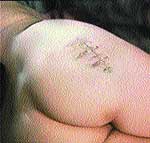 |
| Рис. 4 |
Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Выбор антисептиков, используемых для промывания ран
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
Возможности использования мазей
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
Аэрозоли
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
Масла
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Раневые покрытия
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
Гидроколлоиды
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Гентацикол
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.

