Химическая инертность что это
Химическая инертность
Из Википедии — свободной энциклопедии
В химии инертными называются вещества, не являющиеся химически активными.
Благородные газы были ранее известны как инертные газы из-за предполагаемого отсутствия участия в каких-либо химических реакциях. Причина этого заключается в том, что их крайняя электронная оболочка (валентная оболочка) полностью заполнена, так, что они имеют незначительную тенденцию к приобретению или потере электрона. [1] В настоящее время известно, что эти газы реагируют с образованием химических соединений, например, тетрафторида ксенона. Поэтому они были переименованы в благородные газы. Тем не менее для проведения таких реакций требуется большое количество энергии, как правило подводимой в виде тепла, давления, или излучения, а также присутствие катализаторов. Полученные соединения инертных газов часто неустойчивы. Инертные среды, состоящие из газов, таких как аргон или гелий широко используются в химических реакционных камерах и контейнерах для хранения реагентов.
Термин инертный также может быть применён в относительном смысле, как не реакционно-способный. Например, молекулярный азот инертен в обычных условиях, существующих в двухатомных молекулах, N2. Наличие сильной тройной ковалентной связи в N2 молекулах делает его не реакционно-способным в нормальных условиях. Тем не менее, азот реагирует со щелочным металлом литием, образуя нитрид лития (Li3N) даже в обычных условиях. При высоких давлениях и температурах и с нужным катализатором, азот становится более реактивным. Процесс Габера использует такие условия, для производства аммиака из азота воздуха. Инертная среда из азота широко используется для хранения чувствительных к кислороду или водно-чувствительных веществ, чтобы предотвратить нежелательные реакции этих веществ с кислородом или водой.
Большая Энциклопедия Нефти и Газа
Химическая инертность
Химическая инертность и слабая полярность полисилоксанов обусловливают их плохие противоизносные свойства при граничном трении. [4]
Химическая инертность и малое процентное содержание этих элементов в воздухе явились причиной того, что эти газы долгое время не были открыты. [7]
Химическая инертность и высокая теплостойкость фторопластов объясняются наличием фтороуглеродной связи, являющейся одной из наиболее прочных химических связей. [10]
Химическая инертность и малое процентное содержание этих элементов в воздухе явились причиной того, что эти газы долгое время не были открыты. [11]
Химическая инертность ; взаимодействие датчиков детектора с компонентами смеси может привести к изменению реакции чувствительных элементов и к нестабильности работы прибора. [12]
Химическая инертность и смазочные свойства графита делают его хорошим разделяющим материалом. В связи с этим он используется для покрытия прокладок коллекторов двигателей и цоколей электрических ламп. Иногда бывает очень трудно вывинтить цоколь лампы из патрона. Портер [17] показал, что пленки коллоидного графита, диспергированного в четырех-хлористом углероде или воде, хорошо удерживаются на цоколях ламп и обеспечивают легкое вывертывание ламп из патронов после длительной эксплуатации. [13]
Химическая инертность сочетается, как правило, с невоспламеняемостью газа. [14]
Химическая инертность и малое процентное содержание этих элементов в воздухе явились причиной того, что они долгое время не были открыты. [15]
Химическая инертность
| В Викисловаре есть статья « инертность » |
Инертность — в общем случае бездеятельность, пассивность, вялость. Свойство по значению прил. инертный. Свойство быть в состоянии не делать ничего или почти ничего.
В химии инертными называются вещества, не являющихся химически активными.
Благородные газы были ранее известны как инертные газы из-за предполагаемого отсутствия участия в каких-либо химических реакциях. Причина этого заключается в том, что их крайняя электронная оболочка (валентная оболочка) полностью заполнена, так, что они имеют незначительную тенденцию к приобретению или потере электрона. [1] В настоящее время известно, что эти газы реагируют с образованием химических соединений, например, тетрафторида ксенона. Поэтому они были переименованы в благородные газы. Тем не менее для проведения таких реакций требуется большое количество энергии, как правило подводимой в виде тепла, давления, или излучения, а также присутствие каталитизаторов. Полученные соединения интртных газов часто неустйчивы. Инертные среды, состоящие из газов, таких как аргон или гелий широко используются в химически реакционных камерах и контейнерах для хранения реагентов.
Термин инертный также может быть применён в относительном смысле, как не реакционно-способный. Например, молекулярный азот инертен в обычных условиях, существующих в двухатомных молекулах, N2. Наличие сильной тройной ковалентной связи в N2 молекулах делает его не реакционно-способным в нормальных условиях. Тем не менее, азот реагирует с щелочным металлом литием, образуя нитрид лития (Li3N) даже в обычных условиях. При высоких давлениях и температурах и с нужными катализатором, азот становится более реактивным. Процесс Габера использует такие условия, для производства аммиака из азота воздуха. Инертная среда из азота широко используется для хранения чувствительных к кислороду или водно-чувствительных веществ, чтобы предотвратить нежелательные реакции этих веществ с кислородом или водой.
Инертность — свойство тела в большей или меньшей степени препятствовать изменению своей скорости относительно инерциальной системы отсчёта при воздействии на него внешних сил. [2] Упоминается в русскоязычной литературе, наряду с Инерцией, как синоноим, но дается несколько различное определение. Ине́рция (от лат. inertia — бездеятельность, косность, синоним: инертность.) — свойство тел оставаться в некоторых системах отсчёта в состоянии покоя или равномерного прямолинейного движения в отсутствие или при взаимной компенсации внешних воздействий. [3] Мерой инертности в поступательном движении является масса тела. Мерой инертности во вращательном движении является момент инерции.
Федеральный закон США о Инсектицидах, Фунгицидах и Родентицидах (англ.) ( рус. делит ингредиенты в пестицидах на две группы: активные и инертные. Химически инертные, в этом контексте, это такие, которые не оказывают токсического влияния на определённые виды, для защиты которых предназначены пестициды, но это не исключает, что они всё ещё могут иметь биологическую активность на другие виды, в том числе, могут быть токсичны для человека. В частности, растворители, пропелленты, консерванты, кроме прочего, считаются инертными ингредиентами (англ.) ( рус. [4] в пестицидах. [5]
В подразделе математики теории чисел, простой идеал дедекиндова кольца называют инертным, если он по-прежнему простой, при рассмотрении в расширении поля. Такой простой идеал, возможно, вместо разбиения простых идеалов на расширения Галуа (англ.) ( рус. имеет в результате другие простые идеалы, но, будучи инертным, остается практически неизменным. [8] [9]
Материал из Википедии — свободной энциклопедии
В химии инертными называются вещества, не являющиеся химически активными.
Благородные газы были ранее известны как инертные газы из-за предполагаемого отсутствия участия в каких-либо химических реакциях. Причина этого заключается в том, что их крайняя электронная оболочка (валентная оболочка) полностью заполнена, так, что они имеют незначительную тенденцию к приобретению или потере электрона. [1] В настоящее время известно, что эти газы реагируют с образованием химических соединений, например, тетрафторида ксенона. Поэтому они были переименованы в благородные газы. Тем не менее для проведения таких реакций требуется большое количество энергии, как правило подводимой в виде тепла, давления, или излучения, а также присутствие катализаторов. Полученные соединения инертных газов часто неустойчивы. Инертные среды, состоящие из газов, таких как аргон или гелий широко используются в химических реакционных камерах и контейнерах для хранения реагентов.
Термин инертный также может быть применён в относительном смысле, как не реакционно-способный. Например, молекулярный азот инертен в обычных условиях, существующих в двухатомных молекулах, N2. Наличие сильной тройной ковалентной связи в N2 молекулах делает его не реакционно-способным в нормальных условиях. Тем не менее, азот реагирует со щелочным металлом литием, образуя нитрид лития (Li3N) даже в обычных условиях. При высоких давлениях и температурах и с нужным катализатором, азот становится более реактивным. Процесс Габера использует такие условия, для производства аммиака из азота воздуха. Инертная среда из азота широко используется для хранения чувствительных к кислороду или водно-чувствительных веществ, чтобы предотвратить нежелательные реакции этих веществ с кислородом или водой.
Пестициды
Федеральный закон США о Инсектицидах, Фунгицидах и Родентицидах (англ.) ( рус. делит ингредиенты в пестицидах на две группы: активные и инертные. Химически инертные, в этом контексте, это такие, которые не оказывают токсического влияния на определённые виды, для защиты которых предназначены пестициды, но это не исключает, что они всё ещё могут иметь биологическую активность на другие виды, в том числе, могут быть токсичны для человека. В частности, растворители, пропелленты, консерванты, кроме прочего, считаются инертными ингредиентами (англ.) ( рус. [2] в пестицидах. [3]
Боеприпасы
Открытие и список инертных газов
Инертные газы относятся к 18-й группе химических элементов периодической таблицы Менделеева. Всего существует 6 элементов, которые имеют следующие названия и формулы:
Они довольно широко представлены во вселенной. По современным подсчетам космическая масса вселенной состоит на 76% из водорода, на 23% из гелия и только 1% приходится на другие элементы.
Водород и гелий ученые относят к элементам первичной материи вселенной. В атмосфере Земли благородных газов около одного процента. В основном это аргон. Их открытие — одна из увлекательнейших страниц истории науки.
Содержание инертных газов в природе:
Первым из этих элементов был открыт гелий. В 1868 году его обнаружили в солнечном спектре. В Парижской академии газ назвали гелий или «солнечный». Британский химик Уильям Рамзай открыл гелий и на Земле, но уже после того, как был открыт аргон.
В 1892 году в Лондоне химик Джон Уильям Стретт (лорд Рэлей) опубликовывает обращение к ученым в журнале «Природа». Он обнаружил, что азот, полученный из воздуха, имеет больший вес, чем азот, полученный химическим путем. Как объяснить это явление — задал Рэлей вопрос своим коллегам?
Рамзай высказал предположение: в азоте воздуха содержится неизвестный газ. Два года совместных исследований привели к сенсационным результатам. Был открыт новый газ, он оказался инертным. Он стал называться аргон — «медленный» или «неактивный».
Физические свойства
Менделеев открытие аргона расценивал как испытание периодического закона. Ведь если аргон существует, то он должен стоять на месте калия, однако это противоречило бы закону периодической повторяемости свойств элементов.
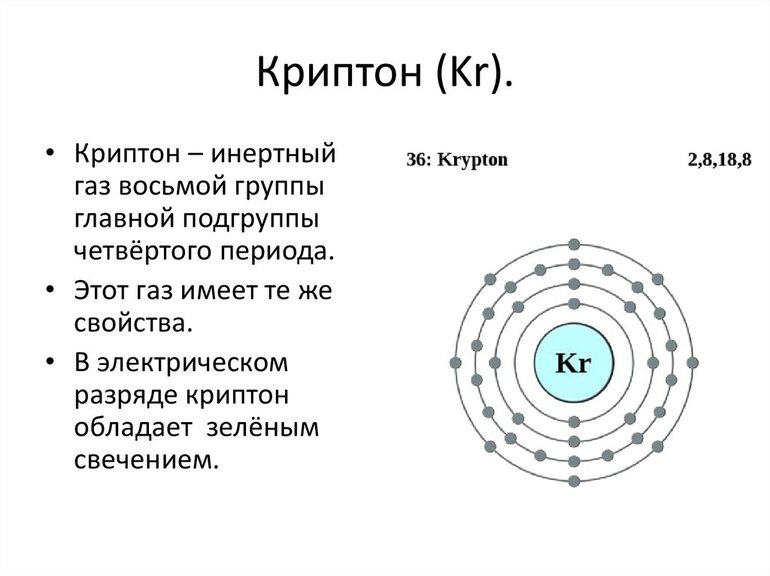
Испытание было выдержано с успехом. Открытие гелия на Земле позволило предположить наличие отдельной группы. Из-за инертности газов их выделили в нулевую группу. Рамзай был непоколебимым сторонником периодического закона Менделеева и, опираясь на него, предсказал, а потом уже открыл неон, криптон и ксенон.
Радон был обнаружен в 1900 году, как результат распада радиоактивного радия. Сам он также подвергался дальнейшему распаду. Превращаемость элементов, стала доказанным фактом и новые открытия, обусловленные развитием техники.
Инертные газы имеют следующие физические свойства:
При помощи масс-спектрографа у всех инертных газов обнаружены изотопы. В природе у гелия наименьшее количество стабильных изотопов — 2, у ксенона — наибольшее 9. У радона стабильных изотопов не обнаружено.
Строение атомов
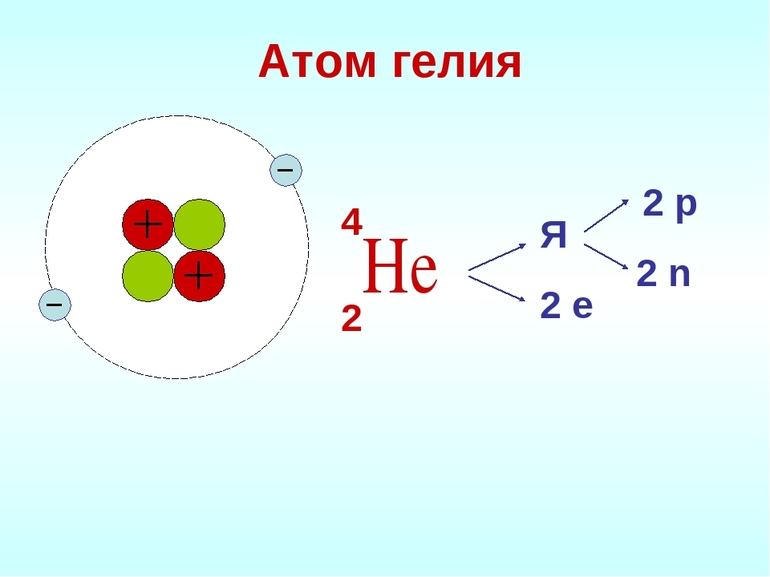
Причина инертности благородных газов в строении атомов. Исследования показали, что у них максимально заполненные энергетические уровни. Гелий обозначается как 1s 2 элемент. Он имеет самую прочную структуру атома среди всех химических элементов.
Остальные благородные газы — это p элементы. Электронное строение атома определяет многие свойства этих газов. Их молекулы одноатомные. У них низкая энергия сродства к электрону.
Завершенность внешнего энергетического уровня обусловливает диамагнитность благородных газов. Высокие потенциалы ионизации, также прямое следствие замкнутости и устойчивости электронных оболочек атомов.
С ростом порядкового номера элемента его потенциал ионизации уменьшается. При сравнении видно, что начиная с криптона, у инертных газов ионизационный потенциал уже ниже, чем у кислорода и фтора. Это обусловливает возможность взаимодействия этих элементов.
Опровержение теории химической инертности
По плотности они делятся на легкие: гелий и неон и тяжелые — все остальные. Гелий самый легкий газ в природе, он легче воздуха в 7 раз. Аргон открывает группу тяжелых газов. Жидкий аргон тяжелее не только воздуха, но и воды.
С увеличением поляризуемости от гелия к радону, увеличиваются радиусы атомов, а также возрастает растворимость в воде и абсорбируемость. Газообразный гелий с трудом можно собрать в закрытый сосуд. Аргон, по сравнению с гелием, уже более вязкий. Его можно перелить из сосуда в сосуд. С увеличением атомной массы и радиуса атома у газов уменьшается теплопроводность, повышается температура кипения. Кроме того, увеличивается возможность деформации внешних электронных слоёв, а значит создается предпосылка химической связи.
Для сжижения благородных газов нужны сверхнизкие температуры, особенно для гелия. У жидкого гелия обнаружено уникальное свойство — сверхтекучесть.
Это подтверждается простым опытом. Если погрузить пробирку в сосуд с жидким гелием, то жидкость будет ползти вверх по наружной стенке пробирки и опускаться по внутренней. Если пробирку приподнять, то гелий начинает двигаться в обратную сторону, выравнивая уровни. Когда пробирку вынимают, то гелий продолжает стекать по ней и капать вниз.
Это свойство у гелия открыл советский физик, академик Петр Леонидович Капица. В 1962 году канадский химик Нил Бартлетт, наконец, опроверг теорию химической инертности благородных газов. Ему удалось в процессе гетерогенного катализа синтезировать соединение ксенона с гексафторидом платины (Xe+PtF6=Xe (PtF6)x).
Событие это было также сенсационно, как заявление Рамзая об инертности аргона. Это позволило инертным газам покинуть нулевую группу. Инертные газы в таблице Менделеева справедливо заняли свое место в восьмой группе.
Правда, еще до открытия Бартлетта были получены клатратные соединения тяжелых инертных газов. При относительно высоких давлениях молекулы газов, в этом случае криптона, плотно окружаются молекулами гидрохинона и включаются в них.
В клатратных соединениях связь молекулярная, валентные электроны в них не взаимодействуют. Клатраты нестойкие соединения, в растворах они быстро распадаются на составные части. Их можно использовать как удобные формы для хранения благородных газов.
Фториды и оксиды ксенона
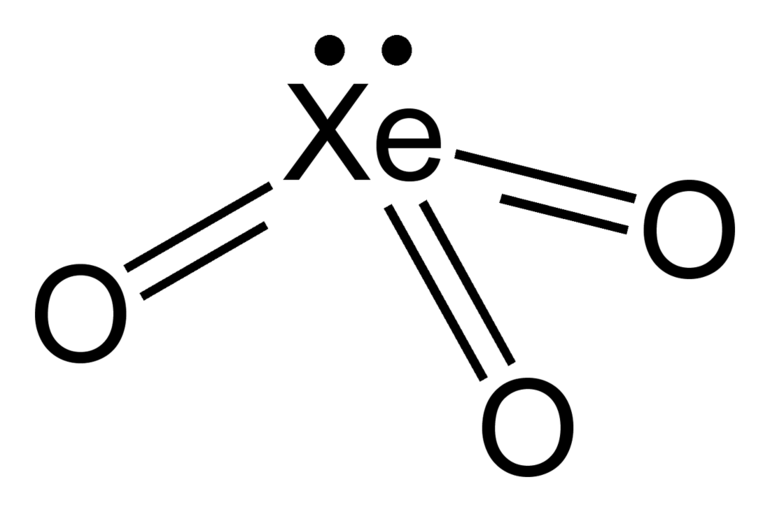
После работ Бартлетта, следующим шагом стали явились опыты по непосредственному соединению ксенона с фтором. Из смеси одного объема ксенона, варьируя условия реакции, получают фториды с различной степенью окисления ксенона. Самый устойчивый из них — тетрафторид ксенона.
Фториды ксенона довольно летучие вещества. Хранят их в тефлоновых сосудах. Они хорошие окислители и фторирующие агенты. Фториды ксенона подвержены гидролизу. В результате реакции образуются оксофториды или оксиды. Триоксид ксенона в сухом виде легко взрывается. Сила взрыва такая же, как у тротила.
Оксиды обладают кислотными свойствами. При взаимодействии с основаниями образуют соли. Триоксид образует ксенаты. Реакция диспропорционирования ксенатов приводит к образованию перксенатов. Ксенаты являются солями ксенонистой кислоты, а перксенаты — ксеноновой. Ксеноновая кислота, в свою очередь, является производной тетраоксида ксенона.
Оксиды ксенона, так же как и фториды, являются сильными окислителями. При реакции с йодом калия образуется йод и ксенон. Кристаллы дифторида ксенона можно получить, если смесь газов в кварцевой ампуле подвергнуть ультрафиолетовому облучению. Его можно получить также при помощи электрического разряда.
Химия инертных газов — это прежде всего химия ксенона. Это синтезированные и комплексные соединения фторидов, полученные катионные и анионные формы комплексов.
Получение и использование аргона
В промышленности благородные газы получили широкое применение. Наиболее доступный из них — аргон. Его получают из воздуха методом двойной ректификации при низких температурах. Воздух очищают от углекислоты и влаги, сжижают с помощью глубокого холода и подают в ректификационную колонну.
Сравнительно легко выделяют азот, а вот с кислородом труднее. Температура кипения его и аргона близки. Способом двойной ректификации кислород отделяется, и сырой аргон поступает в блок тонкой адсорбционной очистки.
Адсорбция идет на синтетических цеолитах, так называемых молекулярных ситах. Благодаря этому методу аргон получается очень чистым, практически без примеси.
Основная область применения аргона — металлургическая и металлообрабатывающая промышленность. Аргонодуговая сварка очень высокопроизводительна и обеспечивает хорошее качество шва.
Другой способ получения аргона, а также криптона и ксенона основан на методе адсорбции из отходящих газов при синтезе аммиака.
Использование в промышленности гелия и радона
Гелий получают из природных газов, которые предварительно очищаются от примесей и влаги.
Сухой газ, проходя несколько этапов, охлаждается до такой температуры, когда все его компоненты конденсируются в жидкость, лишь гелий остается газообразным. Через верхнюю часть разделительного аппарата он выводится наружу. Налажено производство и жидкого гелия. Он играет большую роль в современной физике и криогенной технике.
В газообразном виде легкий и инертный гелий — идеальный наполнитель для дирижаблей. Благодаря налаженному промышленному получению гелия, идея дирижаблестроения в стране возрождается.
Находят применение и радиоактивные изотопы благородных газов. Радиоизотопы ксенон-133 используется для исследования спинного мозга и кровотока головного мозга. Прибор, регистрирующий радиоактивность, определяет локализацию изотопа ксенона и помогает ставить правильный диагноз.
Радон — радиоактивный газ, он дочерний элемент изотопа радия-226. Используя хорошую растворимость радона в воде, медицина поставила его на службу человека. Растворенный радон диффундирует через кожу и оказывает благотворительное воздействие на центральную нервную систему, а через нее и на другие органы человека. Поэтому широко распространено лечение радоновыми ваннами.
В геологии изотопом аргон-40 определяют абсолютный возраст горных пород по методу советского ученого Герлинга. В основе метода лежит процесс распада радиоактивного изотопа калия-40 с образованием основного изотопа аргона-40.
В электровакуумной промышленности используют свойство инертных газов светиться, если через них пропускать электрический разряд. Промышленность выпускает очень широкий ассортимент газоразрядных источников света.
На основе изучения благородных газов складывался ряд фундаментальных научных законов. Все отчетливее выявляется их значение в познании Земли и космоса.