Химия n2o5 что это
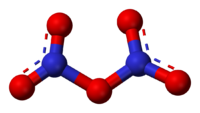
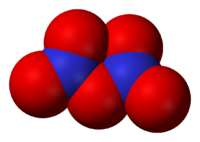
Оксид азота (V)
Оксид азота (V)
| Оксид азота(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(V) |
| Химическая формула | N2O5 |
| Отн. молек. масса | 108.01 а. е. м. |
| Молярная масса | 108.01 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00205 г/см³ |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Термические свойства | |
| Температура плавления | 32.3 °C |
| Классификация | |
| номер CAS | [10102-03-1] |
Окси́д азо́та(V) (пентаоксид диазота, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение
2) Пропуская сухой хлор над сухим нитратом серебра:
3) Путём взаимодействием оксида азота(IV) с озоном:
Свойства
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
Растворяется в щелочах с образованием нитратов:
Физиологическое действие
Как и все оксиды азота (за исключением оксида азота(I) N2O), N2O5 токсичен. Работа с N2O5 требует осторожности, поскольку реакция его разложения сильно экзотермическая. Кроме того, при разложении он даёт ядовитый NO2.
Полезное
Смотреть что такое «Оксид азота (V)» в других словарях:
Оксид азота(II) — Оксид азота(II) … Википедия
Оксид азота(I) — Газ без цвета, со сладким вкусом и запахом Общие Систематическое наименование Оксонитрид азота(I) Химическая формула N2O Физические свойства … Википедия
Оксид азота(IV) — Оксид азота(IV) … Википедия
Оксид азота (II) — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Оксид азота(V) — Оксид азота(V) … Википедия
Оксид азота (IV) — Оксид азота(IV) Общие … Википедия
Оксид азота (I) — Оксид азота(I) Общие Систематическое наименование Оксид азота(I) Химическая формула N2O Отн. молек. масса 44 а. е. м … Википедия
оксид азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen monoxide A colourless gas, soluble in water, ethanol and ether. It is formed in many reactions involving the reduction of nitric acid, but more convenient reactions… … Справочник технического переводчика
Оксид азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
оксид азота (NO) — 3.5.3 оксид азота (NO): Продукт, относящийся к классу опасности 3. Источник: ГОСТ Р 51206 20 … Словарь-справочник терминов нормативно-технической документации
Оксиды азота. Азотная кислота
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):

Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
В избытке кислорода образуется только нитрат натрия:
Ниже 22 0 С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0 С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0 С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
Как и все кислоты, она реагирует:
в) с солями более слабых кислот:
Окислительно – восстановительные свойства

Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:

Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
В промышленности получение азотной кислоты идет в три стадии:
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
*на изображении записи кристаллы нитрата меди (II)
Оксид азота V: получение и химические свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V)
1. Получить оксид азота (V) можно окислением диоксида азота :
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V) :
Химические свойства оксида азота (V)
1. При растворении в воде оксид азота (V) образует азотную кислоту:
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Еще пример : оксид азота (V) реагирует с оксидом кальция:
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
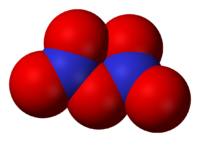
Оксид азота(V)
| Оксид азота(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(V) |
| Химическая формула | N2O5 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцв. кристаллы |
| Молярная масса | 108,01 г/моль |
| Плотность | 1,642 г/см³ |
| Термические свойства | |
| Температура плавления | 32,3 °C |
| Классификация | |
| Рег. номер CAS | 10102-03-1 |
Оксид азота(V) (пентаоксид диазота, нитрат нитроила, азотный ангидрид) N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Получение
Химические свойства
Типичный кислотный оксид. N2O5 легко летуч и крайне неустойчив. Разложение происходит со взрывом, чаще всего — без видимых причин:
Растворяется в воде с образованием азотной кислоты (обратимая реакция):
Растворяется в щелочах с образованием нитратов:
Физиологическое действие
Как и все оксиды азота (за исключением оксида азота(I) N2O), N2O5 токсичен. Работа с N2O5 требует осторожности, поскольку в стандартных условиях реакция может протекать достаточно быстро с большим выделением газообразных веществ. Кроме того, при разложении он даёт ядовитый NO2.
Полезное
Смотреть что такое «Оксид азота(V)» в других словарях:
Оксид азота(II) — Оксид азота(II) … Википедия
Оксид азота(I) — Газ без цвета, со сладким вкусом и запахом Общие Систематическое наименование Оксонитрид азота(I) Химическая формула N2O Физические свойства … Википедия
Оксид азота(IV) — Оксид азота(IV) … Википедия
Оксид азота (II) — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Оксид азота (IV) — Оксид азота(IV) Общие … Википедия
Оксид азота (I) — Оксид азота(I) Общие Систематическое наименование Оксид азота(I) Химическая формула N2O Отн. молек. масса 44 а. е. м … Википедия
Оксид азота (V) — Оксид азота(V) Общие Систематическое наименование Оксид азота(V) Химическая формула … Википедия
оксид азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen monoxide A colourless gas, soluble in water, ethanol and ether. It is formed in many reactions involving the reduction of nitric acid, but more convenient reactions… … Справочник технического переводчика
Оксид азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
оксид азота (NO) — 3.5.3 оксид азота (NO): Продукт, относящийся к классу опасности 3. Источник: ГОСТ Р 51206 20 … Словарь-справочник терминов нормативно-технической документации
Оксиды азота. Общая характеристика, химические свойства.
Важно знать, что все оксиды азота токсичны!
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
Солеобразующие оксиды азота
N2O5
с характерным острым запахом;
Хорошо растворяется в воде;
Хорошо растворяется в воде;
3) Получение в лаборатории
4) Получение в промышленности
5) Химические свойства
1) Разложение:
2) C кислотами:
3) С металлами:
4) С неметаллами:
В присутствии воды реакция идет (образование HNO3):
5) С солями:
6) С оксидами:
7) C основаниями:
2NO2 + 2KOH = KNO3 + KNO2 + H2O
1) Разложение:
2) С кислотами:
3) С металлами:
4) С неметаллами:
5) С солями:
6) С оксидами:
7) С основаниями:
1) Используется при производстве H2SO4 и HNO3;
2) Окислитель в жидком ракетном топливе;
4) Токсичен, вызывает отек легких.
1) Применение ограничено из-за взрывоопасной природы оксида азота (V);
2) Используется в качестве нитрующего агента (в органической химии).
Следующее занятие будет посвящено задачам по этой теме.





