Химия na2o что это
Оксид натрия
Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу 
| Оксид натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Химическая формула | Na2O |
| Эмпирическая формула | Na2O |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 1132 °C |
| Температура кипения | 1950 °C |
| Энтальпия образования (ст. усл.) | -416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| Номер ООН | 1825 |
| Оксид натрия | |
|---|---|
 | |
| Систематическое наименование | Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES | |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Содержание
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
2. Взаимодействие с кислотными оксидами с образованием соли:
3. Взаимодействие с кислотами с образованием соли и воды:
Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Формула оксида натрия (Na2O), свойства, риски
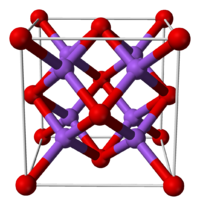
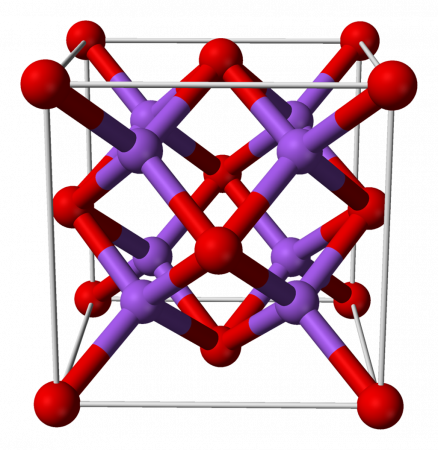
оксид натрия неорганическое соединение формулы Na2О. Как и все оксиды щелочных металлов, он имеет кристаллическую структуру, похожую на антифторит (аналог флюорита, CaF2, но с катионами и инвертированными анионами), что соответствует граням с кубической центрированностью. (Натрий: динатрийоксид, 1993-2016).
Можно сказать, что оксид натрия является ангидридом гидроксида натрия, поскольку он реагирует с водой, образуя два моля этого соединения следующим образом:
Как правило, название KNaO можно найти, ссылаясь на оксид натрия или оксид калия. Это связано с тем, что два оксида имеют сходные свойства с точки зрения цвета и скорости расширения и сжатия..
Часто нерастворимые источники оксида натрия включают следы оксида калия, например, в полевых шпатах (рисунок 2), которые являются основным источником натрия в определенных эмалях (Britt, 2007).
Физико-химические свойства
Оксид натрия представляет собой белое кристаллическое твердое вещество (фиг.3). Он имеет молекулярную массу 61,98 г / моль, плотность 2,27 г / мл и температуру плавления 1275 ° С..
Соединение имеет температуру кипения 1950 ° C, где оно начинает разлагаться до натрия и пероксида металла натрия, однако, интересным свойством является то, что оксид натрия начинает сублимировать при 1100 ° C (Национальный центр биотехнологической информации, SF ).
Реагирует бурно с водой и спиртом с образованием гидроксида натрия. Оксид натрия, Na2Или он обратимо поглощает водород (H2), с образованием гидрида натрия (NaH) и гидроксида натрия (NaOH), который потенциально может найти свое применение для обратимого хранения водорода.
Реактивность и опасности
Оксид натрия является стабильным негорючим соединением, но может бурно реагировать с кислотами и водой. Это может также увеличить сгорание других веществ. Он классифицируется как разъедающий и может обжечь кожу и глаза (Королевское химическое общество, 2015).
Раствор в воде является сильной основой, поскольку он бурно реагирует с кислотами, вызывающими коррозию. При бурной реакции с водой образуется гидроксид натрия, который в присутствии воды атакует многие металлы.
Вещество также вызывает коррозию дыхательных путей и проглатывания. Вдыхание аэрозоля может вызвать отек легких (Национальный институт безопасности и гигиены труда, 2014).
В случае вдыхания пострадавшего следует перенести в прохладное место. Если пострадавший не дышит, следует применять искусственное дыхание. Тогда сходите или обратитесь к врачу как можно скорее.
В случае попадания на кожу загрязненную одежду и обувь следует немедленно снять и вымыть большим количеством воды..
При попадании в глаза промойте их большим количеством воды не менее 15 минут и обратитесь к врачу. В случае проглатывания не думайте о рвоте, а прополощите рот водой и обратитесь к врачу..
Наиболее важными симптомами и эффектами могут быть: судороги, отек и отек гортани и бронхов, пневмонит, отек легких, ощущение жжения, кашель, одышка, ларингит и затрудненное дыхание (оксид натрия (Na2O) (cas 1313- 59-3) MSDS, 2010-2017).
Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Поэтому отдых и медицинское наблюдение необходимы.
Оксид натрия следует хранить в сухом месте и отделять от сильных кислот. Поскольку соединение бурно реагирует с водой, в случае пожара не следует использовать огнетушители или разбрызгиватели на водной основе. Рекомендуется использовать сухие порошки или песок.
приложений
Основное использование оксида натрия в производстве стекла. Это используется в керамике и очках, хотя не в необработанном виде. Оксид натрия обычно составляет около 15% химического состава стекла.
Это снижает температуру, при которой расплавляется диоксид кремния (состав стекла на 70%), что делает его более дешевым и более эффективным для производства стекла, поскольку требует меньших затрат энергии со стороны производителя (Джордж Самнер, научный сотрудник ).
Натриево-известковое стекло является наиболее распространенной формой производимого стекла, состоящего примерно из 70% диоксида кремния (диоксид кремния), 15% соды (оксид натрия) и 9% извести (оксид кальция), причем гораздо больше небольшое количество других соединений.
Оксид натрия служит флюсом для понижения температуры, при которой кремнезем плавится, а известь действует как стабилизатор для кремнезема. Натриево-известковое стекло дешевое, химически стабильное, достаточно твердое и чрезвычайно работоспособное, поскольку его можно несколько раз смягчить при необходимости.
Эти качества делают его пригодным для изготовления широкого ассортимента стеклянных изделий, в том числе лампочек, стаканов, бутылок и предметов искусства..
С другой стороны, оксид натрия и диоксид кремния содержат кристаллы воды, также называемые силикатом натрия или жидким стеклом, которые образуют стекловидное тело с очень полезным свойством растворимости в воде..
Жидкое стекло продается в виде твердых комочков или порошков или в виде прозрачной сиропообразной жидкости. Он используется в качестве удобного источника натрия для многих промышленных продуктов, таких как: производитель моющих средств для стирки, в качестве связующего вещества и клея, в качестве флокулянта на водоочистных сооружениях и во многих других применениях (Enciclopaedia britannica, 2017).
Оксидные соединения не приводят к электричеству. Однако некоторые структурированные оксиды перовскита являются электронными проводниками для применения в катоде твердооксидных топливных элементов и систем генерации кислорода (American Elements, 1998-2017)..
Оксид натрия
Характеристики и физические свойства оксида натрия
Оксид натрия имеет структуру антифлюорита. Эта структура родственна CaF2, однако катионы и анионы в ней меняются местами, так что атом натрия занимает место фтора, а кислород – кальция.
Рис. 1. Оксид натрия. Внешний вид.
Таблица 1. Физические свойства оксида натрия.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Получение оксида натрия
Оксид натрия синтезируют взаимодействием пероксида, гидроксида, а предпочтительнее всего нитрита натрия с металлическим натрием:
В последней реакции натрий можно заменить азидом NaN3, при этом образуются те же продукты.
Химические свойства оксида натрия
Оксид натрия проявляет сильные основные свойства. Он бурно реагирует с водой с образованием гидроксида натрия и выделением большого количества теплоты:
Оксид натрия реагирует с кислотами (1), кислотными (2, 3) и амфотерными оксидами (4), жидким аммиаком (5):
При нагревании до температуры выше 700 o С оксид натрия разлагается на пероксид натрия и натрий:
Применение оксида натрия
Основное направление использования оксида натрия – неорганический синтез: производство гидроксида натрия и других веществ.
Примеры решения задач
| Задание | Вычислите массу оксида натрия, который потребуется для получения карбоната натрия по реакции взаимодействия с диоксидом углерода массой 5,5 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и диоксида углерода с образованием карбоната натрия: |
Рассчитаем количество вещества диоксида углерода (молярная масса – 44 г/моль):
n (CO2) = 5,5 / 44 = 0,125моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
m (Na2O) = 0,125 × 62 = 7,75г.
| Задание | Вычислите массу оксида натрия, который потребуется для получения гидроксида натрия по реакции взаимодействия с водой массой 100 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида натрия и воды с образованием гидроксида натрия: |
Рассчитаем количество вещества воды (молярная масса – 18 г/моль):
n (H2O) = 100 / 18 = 5,6 моль.
Найдем массу оксида натрия (молярная масса – 62 г/моль):
Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
Na2O + H2O = 2NaOH
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия: