Хлорид натрия что это соль
Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Хлористый натрий
Хлористый натрий
| Хлорид натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | хлорид натрия / Sodium chloride |
| Химическая формула | NaCl |
| Молярная масса | 58.44277 г/моль |
| Физические свойства | |
| Плотность вещества | 2.165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Химические свойства | |
| Растворимость в воде | 35.9 г/100 мл |
| Классификация | |
| номер CAS | [7647-14-5] |
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов.
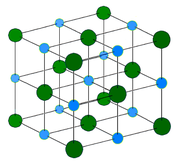
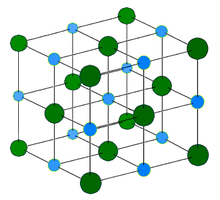
Кристаллическая структура
Хлорид натрия образует кристаллы с кубической симметрией. Более крупные ионы хлора образуют плотную кубическую упаковку, в свободных узлах которой (в вершинах правильного октаэдра) расположены ионы натрия.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль K) |
| S 0 l, 1 bar | 95,06 Дж/(моль K) |
| S 0 s | 72,11 Дж/(моль•K) |
Диэлектрическая проницаемость NaCl — 6,3
См. также
Полезное
Смотреть что такое «Хлористый натрий» в других словарях:
ХЛОРИСТЫЙ НАТРИЙ — Поваренная соль. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ХЛОРИСТЫЙ НАТРИЙ То же, что поваренная соль. Словарь иностранных слов, вошедших в состав русского языка.… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ НАТРИЙ — (ХН) – кристаллический порошок белого цвета, растворимый в воде; должен храниться в условиях исключающих увлажнение. [Изотов В.С. Химические добавки для модификации бетона: монография / В.С. Изотов, Ю.А. Соколова. М.: Казанский Государственный… … Энциклопедия терминов, определений и пояснений строительных материалов
Хлористый натрий — см. Соль поваренная, Каменная соль и Натрий … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлористый натрий — хлорид натрия … Cловарь химических синонимов I
НАТРИЙ — НАТРИЙ. Natrium, химич. элемент, симв. Na, серебристобелый, блестящий, при обыкновенной t° восковой плотности одноатомный металл, делающийся хрупким на холоду и при ярко краснокалильном жаре перегоняющийся; открыт Де.ви (1807) электролизом… … Большая медицинская энциклопедия
хлористый — прилагательное от слова хлор; хлористый этил – жидкость, получаемая из винного спирта и соляной кислоты; ввиду её быстрой испаряемости ею пользуются в медицине для местной анестезии; хлористый кальций – вещество, получаемое при растворении… … Словарь иностранных слов русского языка
ХЛОРИСТЫЙ — ХЛОРИСТЫЙ, хлористая, хлористое (хим.). Находящийся в соединении с хлором, содержащий в себе хлор. Хлористый кальций. Хлористый натрий. Хлористый водород. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
НАТРИЙ — (греч. nitron, лат. natrum). Металл белого цвета, составляющий часть поваренной соли, соды, селитры и др. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. НАТРИЙ белый блестящий мягкий металл, быстро окисляющийся в… … Словарь иностранных слов русского языка
НАТРИЙ — щелочный металл белого цвета, блестящий, быстро тускнеющий на воздухе; при соединении с водой образует едкий натр, энергично выделяя водород. Физические свойства Н.: уд. вес 0,97, темп pa плавления 97,7°. Чистый Н. хранится только в керосине. В… … Технический железнодорожный словарь
Натрий* — (хим.; нем. Natrium, франц. и англ. Sodium). Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον, лат. nitrum) встречается в Библии как название вещества, которое, по Соломону,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлорид натрия
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Содержание
Нахождение в природе и производство
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п. [4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д. [4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды [4] :
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
Залежи
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы [6] :
 | …на мори от чрена и от салгы по пузу… |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
CaR2 + 2NаСl = 2NаR + CaСl2. МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах [13] [14] :
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO [14] :
2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия [14] [16] :
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH 0 g | −181,42 кДж/моль |
| ΔfH 0 l | −385,92 кДж/моль |
| ΔfH 0 s | −411,12 кДж/моль |
| ΔfH 0 aq | −407 кДж/моль |
| S 0 g, 1 bar | 229,79 Дж/(моль·K) |
| S 0 l, 1 bar | 95,06 Дж/(моль·K) |
| S 0 s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
Структура
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
Физраствор – универсальное лекарство
Хлорид натрия является не просто поваренной солью, расщепленной в дистилированной жидкости, это еще и лекарство, которое называют просто физраствор.
Натрия хлорид – что это?
Лечебный солевой раствор считается отличным проводником электричества. Благодаря ему поддерживается водно-электролиный и щелочный баланс.
Получают физиологический раствор достаточно просто – пищевую соль понемногу добавляют в дистилированную воду, пока не получится необходимая концентрация. Главное вводить соль порциями, чтобы она полностью растворялась, нельзя чтобы образовывался осадок.
В некоторых случаях организму может недоставать хлорида натрия. Его дефицит может быть вызван:
большая утрата жидкости;
инфекция желудочно-кишечного тракта;
Когда используют
Раствор хлорида натрия успешно используют:
на момент операционного вмешательства и после проведения операции для поддержания объема плазмы;
при обезвоживании организма, что вызвано разными заболевания;
при сильном кровотечении, ожогах тяжелой степени и диспенсии для поддержания объема плазмы;
для уменьшения интоксикации при попадании в организм опасной инфекции;
для промывания глаз при воспалительных и инфекционных процессах, аллергиях и травмах;
для промывания носа при простудных заболеваниях;
для ингаляций при заболевании органов дыхания;
для растворения разных лекарственных препаратов при совместном использовании при инъекциях.
Способы применения
Подкожное и внутривенное введение
В медицине сейчас тяжело обойтись без использования физраствора. Он необходим при введении медикаментозных препаратов капельным способом и уколами, поскольку любое концентрированное и порошкообразное средство перед использованием нужно растворить в физиологическом растворе.
Также он позволяет сохранять объем плазмы, поддерживать водно-солевой баланс. Эффективен во время отравления, сильных отеках, для разбавления густой крови.
Раствор чаще всего вводят в организм через капельницу или подкожными инъекциями. Перед введением нужно разогреть раствор до 36-38 градусов.
При инъекциях стоит учитывать особенности организма пациента, его возраст, вес, количество утраченной жидкости и недостающего натрия и хлора.
В среднем человеку на день нужно 500 мл натрия. Именно этот объем и нужно вводить. Если утрачено очень много жидкости или отмечается сильная интоксикация, то можно увеличить до 3000 мл в сутки.
Для ребенка на 1 кг нужно 20-80 мл.
Для подкожного и внутривенного введения подходит только стерильный раствор.
Для промывания носоглотки
Физиологический раствор считается недорогим средством, которое является весьма эффективным. Хлорид натрия помогает промыть носоглотку по время простудных заболеваний. Уже после первого использования можно заметить существенное улучшение состояния, нос очищается от слизи и исчезает насморк. Промывание можно делать при аллергическом насморке, для профилактики воспалительных процессов.
Средство разрешается использовать беременным и кормящим грудью женщинам. Также его можно давать грудничкам, когда прием других медикаментов может нанести вред.
Достоинство раствора в том, что после использования слизистая поверхность носа не сушится и не травмируется. Промывать носоглотку можно несколько раз на день, нет ограничений относительно частоты использования.
Раствор можно легко приготовить самостоятельно в домашних условиях. Для этого понадобиться около 10 г поваренной соли и 1 л кипяченой воды. Раствор процедить через марлю и капать им нос. Он является нестерильным и его можно давать детям от 3х лет.
Для очищения желудка и кишечника
Раствор эффективен при сильных отравлениях. Его используют для ректальных клизм, чтобы стимулировать дефекацию. В таком случае понадобиться 3 л 9% раствора в день. перед использованием нужно разогреть раствор до 36-37 градусов, чтобы не вызывать раздражение кишечника. Подойдет нестерилизованный раствор.
Также его применяют при пищевом отравлении для промывания желудка. Раствор натрия хлорид пьют небольшими глотками, после чего нужно самостоятельно спровоцировать рвоту. Для этого необходим только стерильный раствор.
Противопоказания и побочные реакции
Хлорид натрия имеет противопоказания, с которыми стоит ознакомиться прежде чем начать лечения. Физиологический раствор нельзя принимать при:
отеках дыхательных органов;
серьезных заболеваниях сердца;
нехватке кальция в организме;
чрезмерном содержании жидкости вне клетки;
параллельном приеме кортикостероидов.
В большинстве случаев натрий хлорид хорошо переносится пациентами. Но если превышать допустимые дозы или очень долго использовать раствор, могут появиться побочные реакции:
ухудшение работы нервной системы, что проявляется тревожностью, беспокойством, слабостью, головокружением, головными болями, сильной потливостью;
сбой в работе органов пищеварения, что приводит к рвоте, тошноте, расстройству желудка;
гормональный сбой, нарушение менструального цикла;
резкое падение уровня калия в крови;
сбой в работе сердечно-сосудистой системы, учащается сердцебиение, скачет давление;
При появлении хоть одной нежелательной реакции стоит сразу же прекратить использование физиологического раствора и обратиться к врачу. Специалист оценит состояние больного, при необходимости окажет медицинскую помощь, чтобы устранить негативные эффекты.
Перед использованием также нужно проконсультироваться врачом, который сможет определить подходящую систему лечения, чтобы не допустить передозировки. По необходимости сдают анализ мочи и крови.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.