Хлористый аммоний что это
Хлористый аммоний
Хлористый аммоний
| Хлорид аммония | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Физические свойства | |
| Плотность вещества | 1,527 г/см³ |
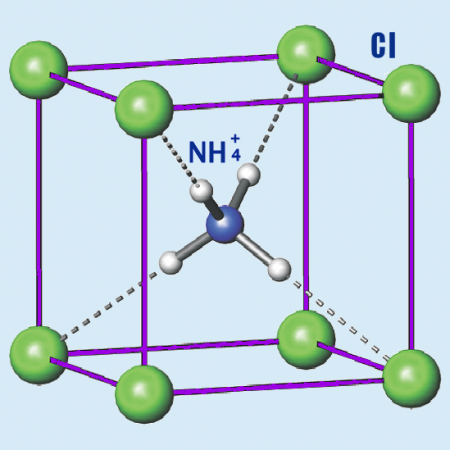
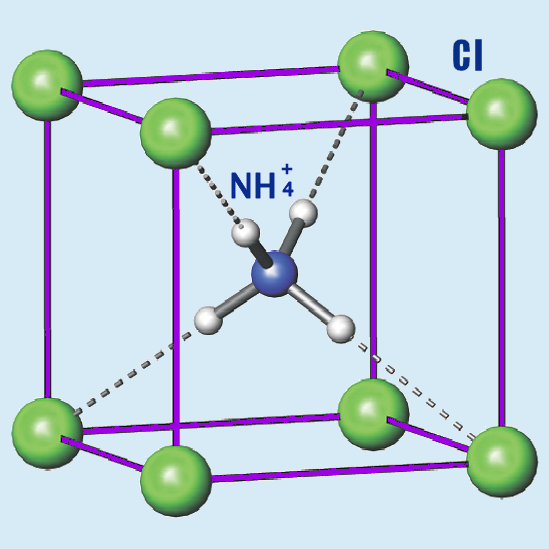
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °С) 37,2 г/100 мл |
| Классификация | |
| номер CAS | [12125-02-9] |
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают пропусканием оксида углерода (IV) через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают эффектной реакцией соляной кислоты с раствором аммиака. Эту реакцию проводят в приборе для получения растворимых веществ в твёрдом виде (ПРВ), так как хлорид аммония возгоняется при повышении температуры и не может быть отделён от раствора выпариванием.
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — гидроксидом аммония.
Полезное
Смотреть что такое «Хлористый аммоний» в других словарях:
Хлористый аммоний — или нашатырь см. Аммоний. Хлористый аммоний (сальмиак) минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2 … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХЛОРИСТЫЙ АММОНИЙ — нашатырь, азотное удобрение второстепенного значения. Получается как побочный продукт при производстве роды. Содержит 24 25% азота. Более применим на черноземных почвах. Содержащийся в X. а. хлор понижает крахмалистость картофеля, ухудшает… … Сельскохозяйственный словарь-справочник
хлористый аммоний — хлорид аммония … Cловарь химических синонимов I
Хлористый аммоний (нашатырь) — см. Аммоний … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлористый аммоний (сальмиак) — минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2. Удельный вес 1,5 1,6. Бесцветен или же окрашен в… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH 4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний, аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
аммоний хлористый — amonio chloridas statusas T sritis chemija formulė NH₄Cl atitikmenys: angl. ammoniac; ammonium chloride; salmiac rus. аммоний хлористый; аммония хлорид … Chemijos terminų aiškinamasis žodynas
Хлорид аммония
наименование
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Хлорид аммония
Характеристики и физические свойства хлорида аммония
Рис. 1. Хлорид аммония. Внешний вид.
Основные характеристики хлорида аммония приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида аммония
Получение хлорида аммония в промышленных масштабах заключается в упаривании маточного раствора, остающегося после отделения гидрокарбоната натрия, образующегося по следующей реакции:
В лабораторных условиях эту соль получают, используя такие реакции, как
Химические свойства хлорида аммония
Хлорид аммония – это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – соляной (хлороводородной) (HCl). В водном растворе гидролизуется. Гидролиз протекает по катиону. Наличие катионов Н + свидетельствует о кислом характере среды.
NH4 + + Cl — + HOH ↔ NH4OH + Cl — + H + ;
При нагревании хлорид аммония как бы возгоняется – разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
Хлорид аммония разлагается концентрированной серной кислотой и щелочами:
Он реагирует с хлором (1), типичными металлами (2), оксидами (3) и нитритами металлов (4):
NH4Cl + 3Cl2 = Cl3N↑ + 4HCl (t = 60 – 70 o C) (1);
2NH4Cl + 4CuO = N2 + 4H2O + CuCl2 + 3Cu (t = 300 o C) (3);
Применение хлорида аммония
Хлорид аммония, или нашатырь, применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
Примеры решения задач
| Задание | Какую массу хлорида аммония можно получить при взаимодействии 17,7 г хлороводорода и 12 л аммиака (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции: |
Найдем количество моль хлороводорода (молярная масса – 36,5 г/моль) и аммиака, вступивших в реакцию используя данные указанные в условии задачи:
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 17,7 / 36,5 = 0,5моль.
n (NH3) = 12 / 22,4 = 0,54 моль.
Согласно уравнению задачи n (HCl):n (NH3) = 1:1. Это означает, что аммиак находится в избытке и все дальнейшие расчеты следует вести по хлороводороду. Найдем количество вещества и массу образовавшегося хлорида аммония (молярная масса 53,5 г/моль):
n (NH4Cl) = n (HCl) = 0,5моль.
Рассчитаем объем 0,06М раствора, который можно получить из 26,75 г хлорида аммония:
| Задание | Вычислите массовую долю хлорида аммония в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
m (H2O)= 20 × 18 = 360 г.
Рассчитаем массу раствора хлорида аммония:
msolution(NH4Cl) = 40 + 360 = 400 г.
Вычислим массовую долю хлорида аммония в растворе:
ω (NH4Cl)=40 / 400 × 100% = 10%.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.






 Аммоний хлористый находит применение в ряде отраслей, в частности в следующих:
Аммоний хлористый находит применение в ряде отраслей, в частности в следующих: