Хлорметан с чем реагирует
Хлорметан
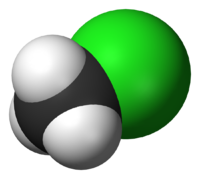
| Хлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Химическая формула | CH3Cl |
| Эмпирическая формула | CH3Cl |
| Физические свойства | |
| Состояние (ст. усл.) | газ |
| Отн. молек. масса | 50.49 а. е. м. |
| Плотность | 2.22 г/см³ |
| Термические свойства | |
| Температура плавления | −97.7 °C |
| Температура кипения | -24.2 °C |
| Температура вспышки | -46 °C |
| Температура самовоспламенения | 625 °C |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Химические свойства | |
| Растворимость в воде | 5.325 г/100 мл |
| Структура | |
| Гибридизация | тетраэдр |
| Классификация | |
| Рег. номер CAS | 74-87-3 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | ClC |
| RTECS | PA6300000 |
| Безопасность | |
| Токсичность | огнеопасен, канцероген |
Хлорметан (метилхлорид) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Благодаря слабому запаху, можно легко не заметить токсичной или взрывоопасной концентрации.
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако, этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количество используется в качестве растворителя при производстве бутилкаучука и очистке бензина. Хлорметан используется как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана приводит действию на центральную нервную систему, схожую на интоксикацию. Пострадавший может почувствовать сонливость, головокружение, рассеянность и тяжесть дыхания, удушье, неуверенную походку и спутанность речи. При больших концентрациях наступают судороги, паралич и кома. В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения. Хроническое воздействие хлорметана связывают с врождёнными дефектами на мышах. Для людей контакт с хлорметаном во время беременности может вызвать неправильное развития позвоночника, таза, ног, но это не доказано окончательно.
Метил хлористый (хлорметан)
Метил хлористый (Хлорметан) – это бесцветный сжиженный газ. Сильно огнеопасно. Нагревание приводит к повышению давления с риском взрыва. Вещество может всасываться в организм при вдыхании и через кожу.
Аварийная карточка (АХОВ)
В случае пожара: охлаждать баллоны, обливая их водой. Вести борьбу с огнем из укрытия. Перекройте поступление; если невозможно и нет риска для окрестностей, дайте огню прогореть, в других случаях – тушите разбрызгиванием воды.
Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция. НИКОГДА не направлять струю воды на жидкость.
При ликвидации аварий с проливом (выбросом) метила хлористого изолировать опасную зону в радиусе 400 м, удалить из нее людей, держаться наветренной стороны, избегать низких мест, соблюдать меры пожарной безопасности, не курить. В опасную зону входить в изолирующих противогазах типа или дыхательных аппаратах (ИП-4м АИР-98ми, ИВА-24м, КИП-8) и в средствах защиты кожи (костюмы Л-1, ОЗК, КИХ–4, КИХ-5, «ПРИЗ», «КАИС», «ВЕКТОР»). На удалении от источника химического заражения более 400 м средства защиты кожи можно не использовать, а для защиты органов дыхания используют фильтрующие промышленные противогазы с коробками марки А, БКФ, гражданские и детские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш с дополнительным патроном ДПГ-1.
Нейтрализуют метил хлористый 10%-ным водным раствором щелочи (например, 100 кг едкого натра и 900 литров воды) с нормой расхода 10 тонн раствора на 1 тонну метила хлористого. При пожаре тушить распыленной водой, воздушно-механической пеной.
Для распыления воды и растворов применяют поливомоечные и пожарные машины, авторазливочные станции (ПМ-130, АЦ, АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
При разливе сжиженного метила хлористого место разлива засыпают активным углем или углем катализатором, обрабатывают дегазирующим раствором № 2-ащ (2-бщ), мыльной водой.
Для утилизации загрязненного грунта на месте разлива срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают мыльной водой в контрольных целях.
В зараженной зоне: надеть противогаз, немедленно эвакуировать из зоны заражения.
После эвакуации из зараженной зоны: ингаляция кислорода, искусственная вентиляция легких, тепло, покой, обильное щелочное питье, срочная госпитализация. ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНЫЙ СЖИЖЕНЫЙ ГАЗ
ФИЗИЧЕСКАЯ ОПАСНОСТЬ:
Газ тяжелее воздуха. и может стелиться по земле; возможно возгорание на расстоянии. и может накапливаться в помещениях с низкими потолками, вызывая недостаток кислорода. См. Примечания.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Вещество разлагается при сжигании с образованием токсичных и едких паров, в том числе хлористого водорода и фосгена. Реагирует бурно с порошкообразным алюминием, порошкообразным цинком, трихлоридом алюминия и этиленом с опасностью пожара и взрыва. Агрессивно в отношении многих металлов в присутствии влаги.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании и через кожу.
РИСК ПРИ ВДЫХАНИИ:
При утечке содержимого очень быстро достигается опасная концентрация этого газа в воздухе.
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Жидкость может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему. Воздействие может вызвать потерю сознания. Воздействие на уровне, значительно превышающем OEL может вызвать поражение печени, сердечно-сосудистой системы и почек. Показано медицинское наблюдение.
ВЛИЯНИЕ ДОЛГОВРЕМЕННОГО ИЛИ МНОГОКРАТНОГО ВОЗДЕЙСТВИЯ:
Вещество может оказывать действие на центральную нервную систему приводя к эффектам, мерой которых служат поведенческие реакции. Исследования на животных показывают, что вещество, возможно, оказывает токсическое действие на репродуктивную функцию человека.
НАЛИЧИЕ
ХЛОРМЕТАНА
ОПРЕДЕЛЯЮТ:
В воздухе производственных помещений: пламенно-ионизационным сигнализатором до взрывных концентраций СДК-3, взрывоопасным искровым пневматическим сигнализатором СВИП-1, СВИП-2.
На открытом пространстве: приборами СИП «КОРСАР-Х».
В закрытом помещении: приборами СИП «ВЕГА-М»
Относительная плотность (вода = 1): 0.92
Растворимость в воде, г/100 мл при 25°C: 0.5
Давление паров, кПа при 21°C: 506
Относительная плотность пара (воздух = 1): 1.8
Температура вспышки: Горючий газ
Температура самовоспламенения: 632°C
Пределы взрываемости, объем% в воздухе: 8.1-17.4
Хлористый метилен
Хлористый метилен
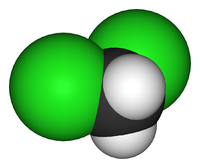
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Молярная масса | 84.9 г/моль |
| Физические свойства | |
| Плотность вещества | 1.3266 г/см³ |
| Примеси | хлорметаны |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота парообразования | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | 20 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| номер CAS | 75-09-2 |
| RTECS | PA8050000 |
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
Общая безопасность и методы устранения аварий [3]
Примечания
Полезное
Смотреть что такое «Хлористый метилен» в других словарях:
Хлористый метилен — (хим.), дихлорметан СН2Cl2, получен впервые Реньо при действии хлора на X. метил: СН3Cl + Cl2 = CH2Cl2 + HCl; впоследствии он получен Бутлеровым при пропускании струи хлора в йодистый метилен: СН2J2 + Cl2 = CH2Cl2 + J2 и Перкиным при действии… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлористый метилен — дихлорметан … Cловарь химических синонимов I
дихлорметан — хлористый метилен … Cловарь химических синонимов I
Болотный газ или метан — (также водородистый метил, формен) предельный углеводород состава СН4, первый член ряда СnН2n+n, одно из простейших соединений углерода, вокруг которого группируются все остальные и от которого могут быть произведены через замещение атомов… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химическое строение — Настоящая статья имеет задачей изложение истории возникновения теории X. строения органических соединений и ее связи с предыдущими теориями. В значительной мере это уже выяснено в статьях Замещение, Унитарная система, Химических типов теория и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Галоидопроизводные — Этим именем в органической химии обозначаются вообще продукты, происходящие из различных органических веществ (углеводородов, спиртов, кислот, альдегидов, кетонов, аминов и пр.) через замещение в них атомов водорода углеводородных групп галоидами … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Термохимия — отдел химии, занимающийся превращениями внутренней энергии тел в тепло при химических процессах. Почти каждая химическая реакция связана с тем или иным тепловым эффектом: химическое превращение сопровождается или выделением, или поглощением тепла … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Отравления — I Отравления (острые) Отравления заболевания, развивающиеся вследствие экзогенного воздействия на организм человека или животного химических соединений в количествах, вызывающих нарушения физиологических функций и создающих опасность для жизни. В … Медицинская энциклопедия
Дихлорметан — Дихлорметан … Википедия
Acetyl
История
Хлороформ был впервые получен в 1831 году независимо в качестве растворителя каучука Самуэлем Гутри (Samuel Guthrie), затем Либихом (Justus von Liebig) и Суберейном (Eugène Soubeiran).
Формулу хлороформа установил французский химик Дюма (Dumas). Он же и придумал в г. название «хлороформ», благодаря свойству этого соединения образовывать муравьиную кислоту при гидролизе (лат. formica переводится как «муравей»).
В клинической практике в качестве общего анестетика хлороформ первым применил Холмс Кут (Holmes Coote) в 1847 г., в широкую практику он был внедрён акушером Джеймсом Симпсоном, который использовал хлороформ для уменьшения боли при родах.
В России метод производства медицинского хлороформа предложил учёный Борис Збарский в 1916 году, когда проживал на Урале в селе Всеволодо-Вильва в Пермском крае.
Свойства
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.
Получение
В промышленности хлороформ производят хлорированием метана или хлорметана. Реакционную смесь нагревают до температуры 400—500 °C. При этом происходит серия химических реакций. Подобное происходит также при освещении смеси ультрафиолетом.
Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.
В лаборатории хлороформ можно получить при помощи галоформной реакции или по реакции между ацетоном или этанолом и хлорной известью.
Поступающий в продажу хлороформ содержит этиловый спирт (1—2 %) в качестве стабилизатора, который связывает образующийся при длительном хранении на свету и в присутствии кислорода фосген. Хлороформ применяют в пробе Бейльштейна, в этой реакции наблюдается окрашивание пламени в голубовато-зелёный цвет ионами меди.
Хлорметил
Метил ( хлорметил ) дихлорсилан применяют для получения кремнийорганических жидкостей, эластомеров и полимеров для лаков, а также для получения мономеров с различными карбо-функциональными группами у атома кремния.
Бис ( хлорметил ) оксациклобутан ( ОЦБ) является мономером для получения пентапласта. Определения примесей в ОЦБ проводят на хроматографе с детектором ионизации в пламени.
Бис ( хлорметил ) оксациклобутан ( БХМО) является циклической Р — ОКИСЬЮ.
Ди ( хлорметил ) бензол может реагировать с бензолом или хлористым бензилом до образования п-хлорметилдифенил-метана и я п — ди.
Три — ( хлорметил ) бензол был получен с превосходным выходом фотохимическим хлорированием раствора мезитилена в четыреххло-ристом углероде при 80 С.
Полученный метил ( хлорметил ) диэтоксисилан потоком азота передают в мерник 5, откуда он поступает на аминирование в. Сначала из мерника 5 в реактор загружают необходимое количество метил ( хлорме-тил) диэтоксисилана, затем дают воду в холодильник 9, включают мешалку и из мерника 8 начинают вводить анилин.
Получают-взаимодействием бис ( хлорметил ) диметиламинометана с солями ро-цанистоводородной кислоты с последующей гидратацией полученного дитиоциа-чата в присутствии хлористого водорода.
Взаимодействие бис ( хлорметил ) диорганилсиланов и бис ( хлорметил) тетраорганилдисилоксанов с полисульфидами натрия приводит к образованию полимерных кремнеорганических нодисульфидов.
| К расчету дипольного момента тетра ( хлор-метил метана. |
Молекула тетра ( хлорметил ) метана содержит четыре одинаковых полярных заместителя, групповой момент которых л 87 D. Учтем теперь, что когда два диполя в составе общей цепи направлены в противоположные стороны, если цепь вытянуть, как на рис. 17 6, то одному из них при составлении парных произведений, нужно приписывать знак минус.
Например, действием хлорметила на кремний в указанных условиях получают диметилдихлорсилан — исходный продукт для изготовления кремнийорганиче-ского каучука, смол и жидкостей.
Изучено взаимодействие бис ( хлорметил ) амидов с солями первичных алифатических нитраминов и осуществлен синтез линейных и циклических соединений, содержащих фрагмент 1, 3 — динитро — 1, 3, 5 — триазапентана.
Скорость окисления моно ( хлорметил ) — л — ксилола увеличивается также с ростом концентрации азотной кислоты ( см. рис. 30), но поскольку это сопровождается повышением содержания хлора в ядре, для окисления целесообразно применять 25 — 35 % — ную азотную кислоту.
| Схема производства метил ( фениламинометил диэтоксисилана. |
Применение
Дешевизна, высокая способность растворять многие органические вещества, лёгкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Также нашел применение для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Технологические и технико-экономические показатели
Пропускная способность установки:
Конверсия или степень превращения метана:
Теоретические расходные коэффициенты:
sт Cl2 = Mr (Cl2) / Mr (CH3Cl) = 70,9/50,45 = 1,405 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CHCl3) = 70,9/119,35 = 0,594 кг/кг.
sт Cl2 = Mr (Cl2) / Mr (CCl4) = 70,9/153,8 = 0,461 кг/кг.
Фактические расходные коэффициенты:
sфСН4 = m (CH4) / m (CHCl3) = 604,88/890,75 = 0,679 кг/кг;
Выход на поданное сырье:
Фактический выход CCl4:
Теоретический выход CCl4:
Применение
В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для наркоза хлороформ был применён при хирургических операциях шотландским врачом Симпсоном (1848 г.). В России хлороформ как средство для наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ используется для производства хлордифторметана — фреона (хладона-22) путём реакции обмена атомов хлора на фтор при обработке хлороформа безводным фтористым водородом в присутствии хлорида сурьмы(V) (по реакции Свартса):
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов.
Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).
Безопасность
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалитический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачнение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать интоксикацию данным веществом.
На крысах показано, что дихлорметан может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³ (по ГОСТ 12.1.005-76), в воде водоёмов не более 7.5 мг/л. Концентрационный предел воспламенения 12-22 %. Не горюч, но поддерживает горение, от огня дает вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 947 дней].
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.. Хлорметан используют как метилирующий или хлорирующий агент в органической химии
Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Обнаружение хлороформа
В пробирку вносят 1-2 мл исследуемого раствора и 1 мл 10%-го спиртового раствора гидроксида натрия
Пробирку осторожно нагревают на пламени газовой горелки в течение 3-5 мин. После охлаждения раствора его подкисляют 10%-раствором азотной кислоты до кислой реакции на лакмус и прибавляют 0,5 мл 1%-го раствора нитрата серебра
Появление белого растворимого в аммиаке осадка указывает на наличие хлороформа в исследуемом растворе. Это реакция не специфична. Её дают и другие хлорорганические соединения (хлоральгидрат, четырёххлористый углерод, дихлорэтан и др.)
CHCl3+4NaOH→3NaCl+HCOONa+2H2O<\displaystyle <\mathsf
Сферы применения
Применение дихлорметана обусловлено его способностью растворять различные органические вещества. Его также вводят в составы пинополиуретанов в качестве пенообразующего вещества. Дихлорметан в качестве растворителя используют в:
Метиленхлорид является незаменимым химическим веществом, которое помогает в процессе экстрагирования. Дихлорметан применяют в процессе изготовления чая и кофе, в пивоварении. Также это химическое соединение принимает участие в процессе производства различных ароматизаторов, которые используют для мороженого, напитков, конфет, различных фруктовых джемов и наполнителей. Дихлорметан применяют в качестве растворителя жировых соединений в процессе обработки экзотических фруктов.
Метиленхлорид или дихлорметан используют в процессе отбора проб воды. С его помощью проводят анализ воды на наличие токсических веществ, нитритов и нитратов, кислот, тяжелых металлов и т.д.
В строительной сфере дихлорметан помогает удалить жировую пленку с бетона, керамики, битума. Он растворяет смолы и обезжиривает металлические конструкции. Также свойства дихлорметана нашли свое применение в процессе производства поролоновых материалов. Это хиическое вещество применяют в процессе вспенивания низкоплотных поролонов.
Метилен хлористый не только растворяет жиросодержащие вещества, но и способен к склеиванию различных пластиков:
Дихлорметан начали применять в фармацевтической сфере. С его помощью производят синтез аскорбиновой кислоты.
Это вещество используют в процессе производства кинопленок. Дихлорметан способствует моментальному застыванию различных пластмассовых смесей. С недавнего времени это вещество стали использовать в процессе производства духов.
В сельском хозяйстве дихлорметан входит в составы некоторых пестицидов и фумигантов. Его добавляют в некоторые пленки.
Широкое применение дихлорметана обусловлено его доступной ценой и простотой производства. Его ценят в различных сферах производства за способность к растворению различных жиров и кислот, простое применение и удаление с обрабатываемых поверхностей.
Применение
Применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
Тетрахлорметан квалификации «эвс» используется для анализа водных сред на нефтепродукты методом инфракрасной спектроскопии.
Тетрахлорметан с 1930-х годов широко использовался в качестве наполнителя ручных и стационарных огнетушителей для военной, авиационной и другой техники («тетрахлорный огнетушитель», в том числе с ручным приводом насоса), особенно до широкого распространения углекислотных, фреоновых и порошковых систем. Пары́ и продукты разложения тетрахлоруглерода не поддерживают горения, как тушащий агент он имеет много достоинств: жидкий при нормальных условиях, легко испаряется, при этом значительно охлаждая зону горения, неэлектропроводен, не требует для хранения сосудов высокого давления, не корродирует медные и лужёные сосуды, относительно инертен к обрабатываемым поверхностям (для использования в холодное время требуется добавка низкозамерзающих растворителей). Однако из-за токсичности продуктов разложения в гражданских системах применения не получил. Ручное тушение пожара в машине требовалось выполнять в противогазах — при попадании тетрахлорида углерода на горячие поверхности происходила химическая реакция частичного замещения хлора атмосферным кислородом с образованием фосгена — сильнодействующего ядовитого вещества удушающего действия.
Воздействие на организм
Вдыхание хлороформа пагубно влияет на работу центральной нервной системы. Вдыхание воздуха с содержанием хлороформа порядка 0,09 % (900 ppm) за короткое время может вызвать головокружение, усталость и головную боль. Постоянное воздействие хлороформа может вызвать заболевания печени и почек. Приблизительно 10 % населения Земли имеют аллергическую реакцию на хлороформ, приводящую к повышению температуры тела (до 40 °C). Часто вызывает рвоту (частота послеоперационной рвоты достигала 75—80 %).
Исследования на животных показали, что у беременных крыс и мышей, которые дышали воздухом с содержанием хлороформа 0,003 % (30 ppm), происходили выкидыши. Также такое наблюдалось у крыс, которым давали хлороформ перорально. Следующие поколения крыс и мышей, которые вдыхали хлороформ, имели больший процент врождённых дефектов по сравнению с неподвергавшимися воздействию.
Влияние хлороформа на размножение у людей недостаточно хорошо изучено. При длительном воздействии на дыхательные пути и слизистые оболочки человека (2—10 минут) возможен летальный исход. Предположительно мутагенен и канцерогенен. Данные свойства проявляются только при превышении концентрации хлороформа в воздухе.
При попадании в организм хлороформ довольно быстро выводится с выдыхаемым воздухом: через 15—20 мин. — 30—50 % хлороформа, в течение часа — до 90 %. Остаток хлороформа в организме в результате биотрансформации превращается в диоксид углерода и хлороводород.
<\mathsf <2CHCl_<3>+2H_<2>O+O_<2>\longrightarrow \ 2CO_<2>\uparrow +6HCl\uparrow >>>
С кислородом воздуха при ненадлежащем хранении образует фосген:
<\mathsf <2CHCl_<3>+O_<2>\longrightarrow \ 2COCl_<2>\uparrow +2HCl\uparrow >>>
По данным среднесменная ПДК 0,5 мг/м3, максимально-разовая — 1 мг/м3. В то же время порог восприятия запаха хлороформа может составлять, например, 650 мг/м3; и даже 1350 мг/м3.
Физико-химические особенности
Дихлорметан производится в виде органического вещества, которое способно воспламенятся и взрываться. Это химическое соединение не вступает в реакции с водной средой, но способно растворять множество других органических веществ. Плотность дихлорметана составляет 1,33 г/см³.
Класс органических соединений дихлорметана – алифатические галогеносодержащие вещества. Из-за своей жидкой консистенции он считается весьма летучим и подвижным веществом, в котором полностью отсутствуют любые механические включения или примеси. Характерная черта– это едкий приторно-сладкий запах.
Хлористый метилен или дихлорметан впервые был открыт в 1840 году. В то время его получили в результате выдержки смеси из хлора и метила. Современные производственные химические компании изготовляют дихлорметан путем хлорирования метана хлором. В результате этой реакции химики получают большое количество различных хлорсодержащих веществ, среди которых в чистом виде присутствует и метиленхлорид.
Существует цепочка реакций, которая наглядно демонстрирует превращение метана в хлорметан и дихлорметан.
Хлорметан считается производной дихлорметана. Это вещество представляет едкий газ, который отличается сильным токсическим действием.
В процессе гидролиза дихлорметан может образовывать формалин и соляную кислоту.