Хондрогард или хондролон в чем разница
Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
Диагноз ревматоидного артрита ставится на основании:
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
Биологические (генно-инженерные) БПВП – биологические агенты
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Лучшие хондропротекторы для суставов
Хондропротекторы – эффективная защита для ваших суставов
Что такое хондропротекторы?
При каких болезнях применяются хондропротекторы
Хондропротекторы станут незаменимыми помощниками в борьбе с болезнями суставов
Препараты этой группы рекомендованы при врожденных и приобретенных патологиях костной ткани (например, деформация костей), грыжах и протрузиях. Хондроитин сульфат хорошо зарекомендовал себя в качестве вспомогательного вещества при лечении кератитов (воспаление глазной роговицы). Хондропротекторы при артрозе назначают на 1-2 стадии заболевания.
Действие хондропротекторов для суставов
Действие хондропротекторов при артрозе разделяют на:
Механизм действия хондропротективных препаратов основан на том, что они стимулируют рост хондроцитов, повышают их стойкость перед окислением, и подавляют активность ферментов, которые разрушают хрящевую ткань. Благодаря этому вместо дефектной хрящевой ткани начинает нарастать устойчивая, т.е., достаточно прочная, чтобы хрящ мог снова выполнять свои функции в суставе. Также протективные средства обладают слабым противовоспалительным эффектом, уменьшают отеки.
Показания и противопоказания к приему хондропротекторов
Кому нужны хондропротекторы для суставов?
Начинать курс глюкозамина и хондроитина нужно:
Кому нельзя принимать хондропротекторы?
Классификация хондропротекторов
В медицинских источниках хондропротекторы для суставов разделяют по поколениям:
Хондропротекторы нового поколения облегчают самочувствие больного гораздо быстрее, имеют меньше побочных эффектов.
Хондопротекторы выпускаются в различных формах Выберите то, что подходит именно вам.
Таблетки
Мази-хондропротекторы
Местные хондропротекторы (мази и гели) используются при артрозах межпозвоночных, мелких и средних суставов. Наружные препараты обладают минимальной биодоступностью (менее 5%) и практически не влияют на структуру хряща, в особенности, если он залегает глубоко под кожей. Зато мази-хондропротекторы благотворно воздействуют на околосуставные ткани, снимают боль и отек, уменьшают воспаление. При отсутствии аллергической реакции их можно использовать постоянно.
Порошки для лечения суставов
Хондропротекторы в уколах
Внутримышечный укол хондропротектора можно сделать самостоятельно или при помощи близких, а вот инъекция в сустав должна проводиться только опытным медицинским работником.
Натуральные хондропротекторы в еде
Людям с больными суставами полезны и растительные коллагеноподобные соединения, которые содержатся в ростках пшеницы, грибах, орехах, брокколи, морских водорослях. В рационе стоит увеличить содержание цитрусовых, листовой зелени.
Даже ежедневное употребление хондропротективных продуктов не гарантирует здоровье хряща при:
К числу лучших хондропротекторов относятся глюкозамин, хондроитин, метилсульфонилметан, гиалуроновая кислота, коллаген II типа, а также ряд вспомогательных средств. Лучше всех, по отзывам пациентов, себя зарекомендовали следующие препараты-хондропротекторы:
Артрадол. Хондроитина сульфат в виде порошка для приготовления внутримышечных инъекций.
Артракам.Глюкозамина гидрохлорид в форме саше (порошок для приема внутрь раствором). Стимулирует восстановление хряща.
Артра.Обладает обезболивающими свойствами, помогает восстановить сустав. Производится в США.
Дона. Глюкозамина сульфат. Выпускается в виде таблеток, саше и раствора для внутримышечного введения. Курс применения:
Румалон. Препарат 1-го поколения в виде раствора для внутримышечных инъекций. Содержит экстракт хрящей и костного мозга крупного рогатого скота.
Курс: 5-6 недель, 3 раза в неделю по 1 мл.
Хондрогард. Выпускается в виде раствора хондроитинсульфата для внутримышечных и внутрисуставных инъекций.
Курс хондропротектора в уколах:
Хондроксид. Хондроитина сульфат в виде таблеток, геля или мази 5%.
Перед применением хондропротекторов из списка желательно посоветоваться c врачом.
Надеемся, что смогли Вам помочь! Здоровья Вам и Вашим близким!
Хондропротекторы в комплексной терапии болей в спине
Опубликовано в журнале:
«Русский медицинский журнал», 2013, №5, с. 1-4 Д.м.н. А.Е. Барулин, д.м.н. О.В. Курушина
Волгоградский государственный медицинский университет
Справедливости ради надо заметить, что вертебро-неврологические заболевания – это мультидисциплинарная проблема, решение которой требует участия многих специалистов, таких как нейрофизиологи, неврологи, альгологи, кинезиологи, мануальные терапевты, травматологи-ортопеды. Связано это, в основном, с тем, что дорсопатии являются многофакторными и полиэтиологическими заболеваниями.
В клинической практике врачей-неврологов в настоящее время формируется парадоксальная тенденция: количество методов и способов диагностики болевых расстройств увеличивается ежегодно, но при этом также возрастает терапевтическая резистентность данных расстройств и их распространенность в популяции.
При этом парадоксальной становится ситуация: расходы на лекарственную терапию боли в спине растут быстрее, чем расходы на обращения в отделения экстренной медицинской помощи, ведение стационарных и амбулаторных больных [Altman R., 2009].
Считается, что дорсопатия по характеру вовлечения структур имеет практически всегда следующие компоненты: мышечный – 100%, фасциально-связочный – 75%, суставной – 50% и лишь дискогенный компонент – 2,5% [Иваничев Г.А., 2010].
Большой интерес в понимании причин развития дорсопатий вызывает теория многофакторности развития, согласно которой для данного заболевания необходима генетическая предрасположенность, а для его проявлений – воздействие различных средовых факторов. В настоящее время к наиболее изученным факторам риска возникновения дорсопатий и их неврологических проявлений относят: женский пол, средний возраст, травму позвоночника в анамнезе, наследственность, тяжелые и несбалансированные физические нагрузки, длительное нахождение в вынужденной и нефизиологической позе, монотонную работу, курение, ожирение, неудовлетворенность профессиональной деятельностью и т.д.
Несмотря на все разнообразие факторов, практически во всех теориях развития дорсопатий фигурируют два основных аспекта: декомпенсация в трофических системах и перегрузки позвоночно-двигательных сегментов (ПДС). Локальные перегрузки ПДС возникают под воздействием как экзогенных (перегрузки в быту, на производстве), так и эндогенных (врожденные особенности функционирования мышечно-связочного аппарата) факторов. Все это является еще и предопределяющим условием для разрушающего воздействия на хрящевую ткань, с вовлечением как межпозвонковых дисков, так и межпозвонковых суставов.
Хрящевая ткань представляет собой разновидность соединительной ткани и внешне напоминает гель. Толщина хряща составляет 1–7 мм и зависит от типа сустава и его функциональной нагрузки. Суставной хрящ представляет собой высокоспециализированную хрящевую ткань, покрытую надхрящницей, которая выполняет в организме две важнейшие функции – обеспечивает скольжение суставных поверхностей, а также равномерно распределяет нагрузку при воздействии механических факторов, снижая тем самым травмирующий эффект при движении.
В межпозвоночных дисках, подвижных сочленениях находится волокнистая, или фиброзная, хрящевая ткань. Ее межклеточное вещество содержит параллельно направленные коллагеновые пучки, которые составляют до 97%, постепенно разрыхляющиеся и переходящие в гиалиновый хрящ. Кроме коллагеновых волокон ее межклеточное вещество, или внеклеточный матрикс, состоит из основного вещества, включающего до 70% воды, гиалуроновой кислоты и протеогликанов – около 10–20%. Целостность этой матрицы, соответственно, определяет биомеханические свойства суставного хряща. Структура протеогликана обеспечивает очень высокую гидрофобность, что в сочетании с низкой вязкостью делает его идеальной молекулой для противодействия нагрузке на сустав.
Хрящ не имеет нервных окончаний и сосудов. Его питание осуществляется пассивно из синовиальной жидкости и сосудов подлежащей кости, которая носит название субхондральная кость. Поэтому, по мере старения организма, в хрящевой ткани уменьшаются концентрация протеогликанов и связанная с ними гидрофильность ткани. Ослабляются процессы размножения хондробластов и молодых хондроцитов.
Ряд авторов считают, что дегенеративная болезнь диска и артроз фасеточных суставов являются главными компонентами формирования остеоартроза позвоночника.
Тем не менее, по данным Kendall N., Linton S., Main C., 1997; Оssrau G., 2008; Zaproudina N., 2009, суть диагностики вертеброневрологической патологии в западноевропейской практике сводится в основном к «сортировке» пациентов со специфическими и неспецифическими болями путем выявления так называемых «красных флажков», при необходимости проводятся дополнительные методы исследования (рентгенологическое исследование позвоночника, рентгеновская компьютерная (КТ) или магнитно-резонансная (МРТ) томография позвоночника, общий и биохимический анализ крови и др.).
У пожилых пациентов (чаще, чем в популяции) боль в спине может быть обусловлена невертеброгенными причинами. Заболевания внутренних органов сопровождаются в ряде случаев отраженной болью в спине. Необходимо дифференцировать с заболеваниями почек и мочевыводящих путей, поджелудочной железы, ретроверсией и опущением матки, объемными и воспалительными процессами в малом тазу и т.д. И в случае возможных данных заболеваний требуется принципиально иное лечение.
Лечение неспецифических болей в спине
Учитывая, что врач часто сталкивается с затруднениями в оценке эффективности и объективизации результатов лечения, начнем с клинических критериев эффективности лечения:
Использование данных рекомендаций позволяет наглядно демонстрировать динамику состояния пациента в процессе лечения, что дает возможность и врачу, и, что немаловажно, пациенту (учитывая психологические аспекты) видеть результаты проведенного лечения. Прежде чем приступать к лечению, необходимо вспомнить нецелесообразные методы:
Пациенту необходимо дать адекватную информацию о заболевании и убедить его в доброкачественности состояния.
В рекомендациях Европейского симпозиума, посвященного проблеме боли в спине, важное место выделено советам по активизации больных в период острой боли (это положение имеет доказательную базу А). В случаях без компрессии корешка постельный режим не должен превышать 48 ч. С точки зрения доказательной медицины ранняя активизация больных в момент периода острой боли дает:
Постельный режим отрицательно сказывается на результатах терапии.
Двигательный рацион должен расширяться постепенно, в начальный период с ограничением физической активности (поднятие тяжестей, наклоны, длительное сидение и т.д.). Необходимо научить пациента правильно совершать движения. Раннее возвращение к привычному для больного уровню двигательной активности способствует более быстрому купированию боли и предупреждает ее хронизацию. Предикторами хронизации болевого синдрома являются [Valat J. et al., 2000]:
Учитывая мировой опыт, комбинированную анальгетическую терапию боли рекомендуют применять многие официальные медицинские организации, в частности ВОЗ, Американская ассоциация боли, дополняя при этом ее введением хондропротективных препаратов.
Хондропротекторы
Это препараты, обладающие симптом-модифицирующим действием (уменьшают боль и способствуют улучшению функции суставов и позвоночника) и структурно-модифицирующим эффектом (задерживают или приостанавливают прогрессирование дегенеративно-дистрофического процесса). Данная группа препаратов включена в рекомендации российских и зарубежных руководств по лечению остеоартроза и иных дегенеративно-дистрофических заболеваний.
Принимая во внимание родство патогенетических механизмов дегенеративных процессов позвоночника и крупных суставов, в настоящее время в базисную терапию стали все чаще включать препараты, обладающие хондропротективной активностью.
В комплексном лечении хронических неспецифических болей в области спины у пациентов с клиническими признаками спондилоартроза («фасеточный синдром») целесообразным является включение препаратов группы хондропротекторов, замедляющих процессы дегенерации хрящевой ткани.
На основании международных критериев выделено несколько химических соединений, используемых для лечения остеоартроза крупных и мелких суставов, в т.ч. позвоночника.
Препараты со структурно-модифицирующими свойствами:
Наиболее изученными на сегодняшней день являются хондроитина сульфат и глюкозамин.
Хондроитина сульфат – гетерогенная группа соединений, имеющих различную молекулярную массу и удельный вес. Особенностью хондроитина является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани.
Впервые применение хондропротекторов (хондроитина сульфата) при хронической болях в спине было предпринято в исследовании Christensen K.D., Bucci L.R. в 1989 г., в котором была продемонстрирована их эффективность. Эффективность применения хондроитина сульфата подтверждена в таких исследованиях, как STOPP, GUIDE. Данные, приведенные в рекомендациях Международного научно-исследовательского общества по проблемам остеоартрита (OARSI), показывают, что уровень доказательности данного препарата повышается. Однако практически не существует работ, направленных на изучение локального введения препаратов с включением в региональный кровоток. Ввиду вышеизложенного на базе кафедры неврологии, нейрохирургии с курсом медицинской генетики Волгоградского государственного медицинского университета было проведено исследование «Хондроитина сульфат (Хондрогард) в комплексном лечении болевых синдромов в области спины».
Все группы были стратифицированы по возрастному, гендерному признакам и соматотипам. При формировании групп был применен способ случайного распределения пациентов (рандомизация). Общими критериями включения для всех групп являлись: наличие мышечно-рефлекторных проявлений дорсопатий различных отделов позвоночника, подострый период заболевания.
Общие критерии исключения: наличие органических заболеваний нервной системы, психических заболеваний, травм головного мозга и позвоночника в анамнезе, соматические заболевания в стадии декомпенсации. Дополнительные критерия исключения для группы пациентов: секвестрированные грыжи и грыжи дисков более 8 мм; выраженная гипермобильность, спондилолистезы более 5 мм; наличие деструктивных изменений в телах позвонков.
В исследовании для группы пациентов были использованы диагностические критерии Международной классификации болезней 10-го пересмотра (МКБ-10) (ВОЗ, 1984).
Возрастной диапазон обследуемых варьировал от 35 до 55 лет включительно, что соответствовало второй группе зрелого возраста. По характеру трудовой деятельности больные распределились следующим образом: лица, занимающиеся физическим трудом, – 23,1%, служащие – 76,9%. Анализ занятости больных показал, что гиподинамия, статические нагрузки, позозависимые положения, работа за компьютером, профессиональные и психоэмоциональные перегрузки в последние годы выходят на ведущее место среди причин развития заболеваний позвоночника и мягких тканей.
Разделение пациентов на группы по способу введения хондроитина сульфата (Хондрогард):
Все пациенты неоднократно в течение предыдущих лет принимали лечение: амбулаторно, стационарно, а также проходили санаторно-курортное лечение.
Интенсивность болевого синдрома оценивалась по визуальной аналоговой шкале – ВАШ (Association for the Study of Pain, 1986). Количественная оценка миогенного болевого синдрома осуществлялась с помощью балльной оценки по Хабирову.
Оценивались обзорные рентгенограммы отделов позвоночника. Для уточнения патологических изменений костных структур позвоночника и изучения структурных изменений в межпозвонковых дисках, спинном мозге проводилась МРТ.
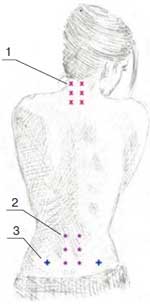
Методика введения препарата. В первый день для определения чувствительности и переносимости вводилось 100 мг (1 мл) Хондрогарда. Доза распределялась на 2 точки инъекций, расположенные в паравертебральных зонах. В последующие дни препарат вводился в дозе 200 мг (2,0 мл) в 4 точки. Выбор точек введения зависел от локализации болевого синдрома и определялся с помощью исследования вертеброневрологического статуса и пальпации триггерных точек. Пример введения в триггерные точки представлен на рисунке 1.
Рис. 1. Точки введения препарата:1 – шейный отдел; 2 – поясничный отдел; 3 – точки введения КПС
Необходимо отметить, что препарат вводился внутримышечно, что обеспечивало его быстрое распределение в регионарном кровотоке. Как известно, при внутримышечном введении он обнаруживается в крови в значительных концентрациях уже через 30 мин. после инъекции. Максимальная концентрация (Сmах) Хондрогарда в плазме достигается через 1 ч, затем постепенно снижается в течение 2 сут. Однако выбор точек, наиболее приближенных к патогенной зоне, обеспечивает максимальную концентрацию именно в синовиальной жидкости пораженных суставов.
Хондрогард накапливается, главным образом, в хрящевой ткани суставов. Синовиальная оболочка не является препятствием для проникновения препарата в полость сустава.
В экспериментах показано, что через 15 мин. после внутримышечной инъекции хондроитина сульфат обнаруживается в синовиальной жидкости, затем проникает в суставной хрящ, где его Сmах достигается через 48 ч.
При введении Хондрогард можно сочетать с анестетиками, например с раствором новокаина 0,25% – 10 мл, что обеспечивает дополнительный обезболивающий эффект. В таком случае дополнительно комплекс препаратов можно вводить в точки максимальной болезненности, которые выявляются у каждого пациента.
Курс терапии Хондрогардом зависит от степени выраженности изменений и может составлять от 10 до 20 паравертебральных внутримышечных инъекций, которые проводятся через день.
Следует отметить, что введение препарата Хондрогард не сопровождалось серьезными нежелательными явлениями. Препарат обладает высоким профилем безопасности, что подчеркивается рекомендациями EULAR, которая рассматривает хондроитина сульфат в качестве одного из самых безопасных лекарственных препаратов терапии остеоартроза. Местные побочные явления (небольшие гематомы в месте введения препарата, болезненные уплотнения в месте инъекции, чувство жара после инъекции) возникали редко и никогда не приводили к отказу пациента от продолжения лечения.
Результаты
Все пациенты хорошо переносили терапию. Из побочных явлений были выявлены только геморрагии в месте инъекций у 3 пациентов.
Выводы
Хондроитина сульфат (Хондрогард) целесообразно вводить паравертебрально и (или) локально возле крупного сустава (внутримышечно), что позволяет быстрее и эффективнее достигать его максимальных концентраций в региональном кровотоке пораженных участков опорно-двигательного аппарата, а это приводит к укорочению сроков нетрудоспособности и повышению эффективности лечения.