Хромоскопия с индигокармином что это
Хромоскопия
Хромоскопия с использованием красителей
Хромоскопия — это окрашивание слизистой оболочки эпителия пищеварительного тракта, которое проводится с целью ранней диагностики различных заболеваний. Метод помогает точно определить поражённые участки и взять биопсию из наиболее подозрительного.
Специалисты
Принцип действия
Пигмент красящего вещества в тканях связываются с гликогеном. Он содержится только в здоровых клетках. Поэтому пораженная слизистая не окрашивается, даже если заболевание находится на очень ранней стадии. Такие неокрашенные пятна отчетливо видны при эндоскопии и подлежат более подробному изучению. Вероятность диагностики рака нулевой и первой стадии приближается к 100%.
Показания к проведению хромоскопии
Хромоскопия пищевода помогает определить:
Хромоскопия желудка необходима для уточнения диагноза:
Хромоскопия толстого кишечника выявляет:
Подготовка к хромоскопии
Проведение хромоскопии
Для исследования используются разные красители. Их выбирают с учетом переносимости пациентом и предполагаемого поражения слизистой:
Краситель на слизистую может быть нанесен двумя способами:
Врач оценивает окрашивание слизистых. Если имеются непрокрашенные участки — проводит биопсию.
После хромоскопии пациент может ощущать легкий дискомфорт, который быстро проходит.
Хромоскопия в Москве
Клиника MAJOR CLINIC обладает всем необходимым для проведения качественной и точной хромскопии пищевода, желудка и кишечника в Москве. Исследование выполняют доктора высокой квалификации с большим опытом практической работы. Узнать цены на хромоскопию и ФГДС, а также записаться на диагностическую процедуру можно по телефону регистратуры и на сайте. Используйте все возможности для ранней диагностики опасных заболеваний, чтобы не пропустить время, когда их можно полностью вылечить.
Диагностические возможности виртуальной хромоскопии
Эндоскопические технологии на сегодняшний день преобладают в диагностике заболеваний органов желудочно-кишечного тракта: например, постановку диагноза «гастрит» сложно представить без проведения фиброгастродуоденоскопии. Новые технологии, дополняющие привычное эндоскопическое исследование, позволяют расширить диагностический спектр этой методики, в частности, более точно визуализировать опухолевые образования и предопухолевые состояния. Данный материал рассматривает одну из таких технологий — NBI.
NBI (narrow band imaging, узкоспектральная визуализация, виртуальная хромография/хромоскопия) — это сравнительно новый метод видеоэндоскопии, первоначально применявшийся для исследования желудка. Виртуальный характер этого исследования отличает его от традиционного хромоскопического метода с предварительным окрашиванием слизистой оболочки. В данном случае «окрашивание» происходит без воздействия химическими агентами на слизистую оболочку желудка и выполняется при помощи света.
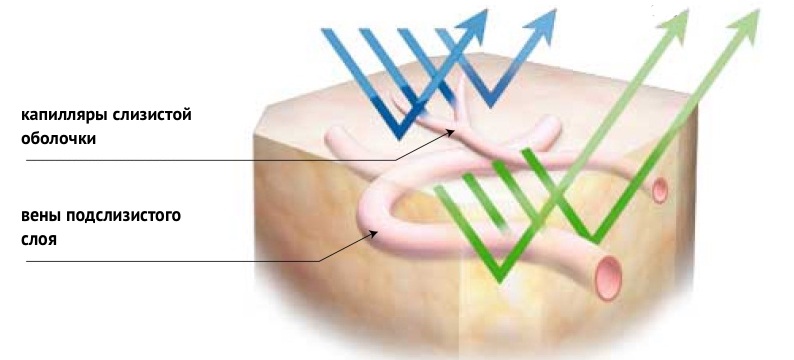
Для освещения поля зрения в случае NBI используется не стандартный белый свет, а сине-зеленый луч узкого спектра. Синий свет имеет длину волны 415 нм, зеленый — 540 нм. Принцип работы метода основан на поглощении гемоглобином волн света определенных длин. При освещении исследуемого участка слизистой оболочки узкоспектральным лучом сине-зеленого света большая часть энергии этого луча поглощается гемоглобином крови, и сосуды слизистой оболочки желудка становятся высококонтрастными. Синий свет в большей степени позволяет визуализировать капилляры собственной пластинки, зеленый — венулы подслизистого слоя. Слизистая оболочка при таком исследовании приобретает характерный вид: коричневая сосудистая сеть на фоне голубоватых бессосудистых участков [1].
Рисунок 1. Принцип работы метода NBI.
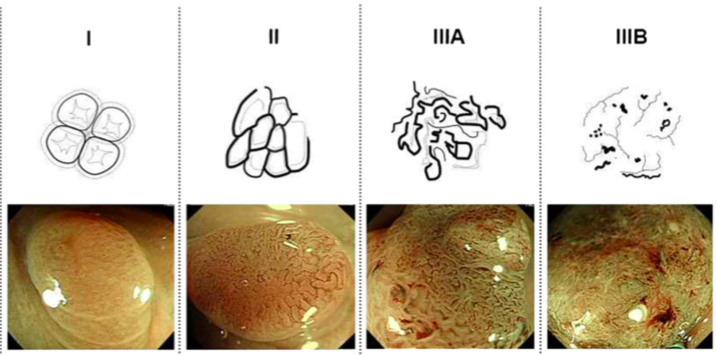
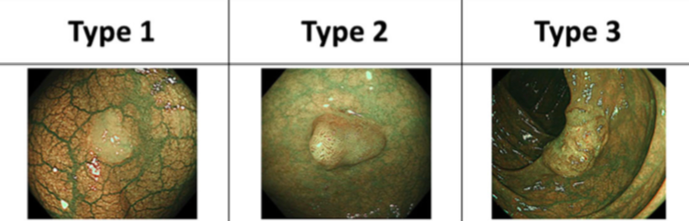
Важнейшим этапом проведения исследования является определение сосудистого паттерна в анализируемом участке (дополнительно используются методы увеличения). Упрощенно можно сказать, что в неизмененной ткани ход сосудов слизистой оболочки напоминает сетку-рабицу или медовые соты. В диспластически измененной ткани сосуды меняют ход: становятся извитыми, теряют повсеместные связи друг с другом, образуют скопления на фоне обширных бессосудистых участков. Каждый такой участок должен рассматриваться как измененный и подвергаться дополнительному исследованию, в том числе гистологическому. Более точно сосудистые паттерны, визуализируемые методом NBI, рассматриваются классификациями авторов Sano (2006 г.), Hiroshima (2008 г.), Showa, Jike (2009 г.). Приведенные в пример паттерны, основаны на классификации Sano и характерны для слизистой оболочки толстой кишки, но в общем смысле соответствует паттернам, обнаруживаемым в любом полом органе.
Интересна также классификация NICE, используемая для дифференцировки сосудистых паттернов в окружении опухолевых образований толстой кишки [2].
Интересная исследовательская находка позволяет в некоторой степени уточнять и гистологическую принадлежность обнаруженного образования слизистой — на этот раз желудка. Одно из проведенных исследований отмечает связь появления на изображении ярко-зеленых участков слизистой, покрывающей опухоль желудка, с наличием в ткани большого числа бокаловидных клеток или клеток, положительных в отношении муцина 2 типа, которые более интенсивно отражают зеленые лучи света [3].
Рисунок 4. Ярко-зеленые участки слизистой окружены интенсивными коричневыми сосудистыми участками, указывающими на имеющиеся диспластические изменения.
Классификация BING рассматривает изменения, обнаруживаемые при исследовании методом NBI слизистой оболочки пищевода. Согласно этой классификации, в случае обнаружения признаков пищевода Барретта, на наличие диспластических изменений в участках метаплазии могут указывать такие феномены, как наличие извитых сосудов, ход которых не соответствует ходу железистых образований [4].
Таким образом, метод NBI позволяет уточнить строение и взаиморасположение сосудов в исследуемой области, что крайне важно для диагностики опухолевых процессов, ведь, как известно, диспластические участки имеют особенное кровоснабжение, подчиняющееся законам их быстрого роста. Любой участок с гиперинтенсивными и/или ненормально расположенными сосудами должен рассматриваться как патологический и подвергаться дополнительному гистологическому исследования. Метод NBI является отличным подспорьем в ранней диагностике новообразований органов желудочно-кишечного тракта.
Источники:
Хромоскопия с индигокармином что это
A. В. Филин, Л. М. Мяукина, Ленинградская областная клиническая больница, главный врач – д. м. н.,
заслуженный врач РФ, профессор В. М. Тришин
г. Санкт-Петербург
«Диагностика рака на ранних стадиях является главной задачей современной эндоскопии, от решения которой зависят результаты лечения больных» (В. С. Савельев, В. М. Буянов, А. С. Балалыкин. «Эндоскопия органов брюшной полости» – М. – 1977).
«Как не велики потенциальные возможности современной эндоскопии, с ее помощью не удалось добиться кардинального решения проблемы своевременного распознавания рака желудка. Среди диагностируемых раков ранние формы составили не более 3-6,7 %, что свидетельствует об относительной ценности такого подхода». (Л. М. Портной. «Рак желудка. Лучевая диагностика». – М. – 1999).
Пути повышения эффективности диагностической эндоскопии:
I. Адекватная премедикация и седация:
Седативные
Мидазолам (Дормикум) до 5 мг внутривенно
Бензодиазепины (Реланиум) до 10 мг внутривенно
II. Соблюдение методики (техники) исследования
Рекомендуемые позиции эндоскопического осмотра в Японии:
Рекомендуемые позиции эндоскопического осмотра в Японии:







III. Подготовка слизистой оболочки
Используется 0,5 % раствор бикарбоната натрия (Савельев В. С. и соавт. 1985). Применение пеногасителя – антифомсилона, позволило повысить чистоту слизистой оболочки до 96,6 % (Л. К. Соколов, 1970).
Применяется 20-50 мл раствора протеинолитического фермента – хемопсина буферный раствор и пеногаситель — за 20 мин до исследования (Лукомский Г. И и соавт., 1975; K. Ida, 1973).
IV. Хромоскопия
Хромоскопия – метод окрашивания тканей, дополняющий эндоскопические исследования c целью расширения возможности выявления минимальных дефектов слизистой оболочки, детализации протяженности, границ, структурных особенностей повреждений и их численности.
Инструменты

1. Абсорбирующий (Vital Stains)
Метод основан на абсорбции красителя эпителиальными клетками или проникновение красителя в некротические ткани.
Раствор Люголя (Lugol’s Solution)
«Позволяет увеличить чувствительность, специфичность, и точность эндоскопического исследования пищевода Баррета на 89 %, 93 %, и 91 %, соответственно». (Woolf G. M., Riddell R. H., Irvme E. J., Hunt R. H. A study to examine agreement between endoscopy and histology for the diagnosis of columnar lined (Barren’s) esophagus. Gastromtest Endosc 1989)
Выполняется распыление 20-50 мл
1-4 % раствора (обычно 2-3 %).
Аллергологический анамнез
Esophageal Carcnoma
Толуидиновый синий (Toluidine Blue)
«…окрашивает клеточные ядра и используется для выявления злокачественных клеток. Применяется для ранней диагностики раковых образований у пациентов с высоким риском развития опухолей пищевода… Избирательно окрашивает патологические ткани в синий цвет и позволяет дифференцировать незлокачественную и злокачественную язву» (Giler S., Kadish U., Urea I. Use of tolomum chloride in the diagnosis of malignant gastnc ulcers. Arch Surg. 1978)
«…окрашивает участки метаплазии в пищеводе Барретта, не дифференцируя желудочную метаплазию от кишечной. Чувствительность метода составляет 98 %, а специфичность 80 %». (Chobaman S. J., Cattau E. L. Jr., Winters C. Jr, et al In vivo staining with toluidme blue as an adjunct to the endoscopic detection of Barren’s esophagus Gastromtest Endosc 1987, 33 99-101)
Толуидиновый синий (Toluidine Blue)
Выполняется предварительное распыление 30 мл 1 % уксусной кислоты, действующей муколитически, затем – 10 мл 1 % раствора толуидинового синего и после, для отмывания избытка красителя — 30 мл 1 % уксусной кислоты.
Метиленовый синий (Methylene Blue)
«…для выявления изменений в тонкой (глютеновая болезнь) и толстой кишке (аденомы и раки), для окраски метаплазии в желудке. При этом не окрашивается неабсорбирующий эпителий (типа эктопической желудочной метаплазии на фоне положительно окрашивающеся дуоденальной слизистой оболочки» (Nivelom S., Fionni A., Dezi R., et al Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease assessment of mterobserver agreement. Gastromtest Endosc 1998)
«Тяжелая дисплазия или эндоскопически бессимптомная аденокарцинома в пищеводе Барретта могут быть выявлены при помощи прицельной биопсии из более светлых участков окрашивания на синем фоне накопления красителя». (Canto M. I., Setrakian S., Petras R. E., et al Methylene blue selectively stains intestinal metaplasia in Barren’s oesophagus. Gastrointest Endosc. 1996)
Перед окрашиванием применяются протелитические ферменты (20 мл ацетилцистеина) и до 20 мл 0,5 % раствора метиленового синего. Избыток красителя отмывается водой.
Отмывание слизистой оболочки 4 % раствором бикарбоната натрия с пеногасителем (изопропиловый спирт) и протеинолитиком (проназа 20 000 ед).
Хромоскопия 0,5 % раствором метиленового синего. Отмывание красителя раствором бикарбоната натрия с последующей аспирацией содержимого из желудка.
Gastric Carcnoma
Генциан фиолетовый (Cresyi Violet)
«Хромоскопия с применением генциан фиолетового в сочетании с увеличивающей эндоскопией, высоко эффективный метод диагностики раннего рака желудка»
(Nivelom S., Fionni A., Dezi R., et al Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease assessment of mterobserver agreement. Gastromtest Endosc 1998)
Раствор 0,2 % генциан фиолетового может распыляться после индиго карминового, для выявления ранних форм рака
2. Реактивный (Reactive Stains)
Краситель наносится на поверхность слизистой оболочки и вступает в реакцию с эпителиальными клетками или компонентами секрета.
Конго Красный (Kongo Red)
«Конго красный — pH индикатор, переходящий от красного до черного в кислой среде. Использовался самостоятельно или в комбинации с метиленовым синим для выявления раннего рака желудка» (Tatsuta M., Iishi H., Okuda S., Tamguchi H. Diagnosis of early gastric cancers in the upper part of the stomach by the endoscopic Congo red – methylene blue test. Endoscopy. 1984)
«Конго красный применяется для оценки полноценности ваготомии, определении снижения или отсутствия кислотопродуцирующих зон». (Tatsuta M., Iishi H., Okuda S., Tamguchi H. Diagnosis of early gastric cancers in the upper part of the stomach by the endoscopic Congo red – methylene blue test. Endoscopy. 1984)
Раствор 0,3-0,5 % распыляется после предварительной обработки слизистой оболочки 0,5 % раствором бикарбоната натрия.
Отмывание слизистой оболочки 4 % раствором бикарбоната натрия с пеногасителем (изопропиловый спирт) и протеинолитиком (проназа 20 000 ед) Хромоскопия 0,3 % раствором конго красного. При необходимости – отмывание красителя.
Gastric Carcinoma

Chromoscopy 0,3 % solution Congo Red
Методика хромоскопии для выявления кислотопродуцирующих зон красителем Конго красный состоит из следующих этапов:
Фенол Красный (Phenol Red)
Индикатор pH. Он обнаруживает щелочную pH изменением цвета от желтого до красного. Клиническое применение — обнаружение инфекции H. pylori в желудке. Уреаза, произведенная инфекцией Н. Р. приводит увеличению pH. Следовательно, H. pylori может наблюдаться в красно-окрашенной слизистой оболочке. Чувствительность и специфичность 100 % и 85 %, соответственно».
Раствор 0,3-0,5 % распыляется после предварительной обработки слизистой оболочки 0,5 % раствором бикарбоната натрия.
Методика хромоскопии (выполняется на фоне противоязвенного лечения).
Положительный результат — изменение цвета от желтого до красного, который указывает присутствие H. pylori.
3. Контрастный (Сontrast Stains)
Метод используют для наблюдения за гастроинтестинальной морфологией и неподвижными изменениями. Синий цвет особенно контрастируется с красной слизистой оболочкой и выдвигает на первый план топографию ткани.
Индиго карминовый (Indigo Carmine)
«Краситель имеет глубокий синий цвет, не поглощается желудочно-кишечным эпителием, а скапливаясь в щелях между эпителиальными клетками, усиливает рельефность слизистой оболочки, выделяя самые малые нарушения ее целостности или другие изменения в эпителтальной архитектуре». (Fennerty M. B. Tissue staining Gastromtest Endosc Am. 1994)
Используется 0,1-0,5 % раствор
«…применяется в пищеводе для рельефности ворсинок при подозрении на пищевод Барретта. В желудке для выявления ранних форм рака, а в двенадцатиперстной кишке – для определения атрофии при синдроме малабсорбции» (Suzuki S., Murakami H., Suzuki H, et al An endoscopic staining method for detection and operation of early gastric cancer. Int Adv Surg Oncol. 1979)
Используется 0,1-0,5 % раствор.
Отмывание слизистой оболочки 4 % раствором бикарбоната натрия с пеногасителем (изопропиловый спирт) и протеинолитиком (проназа 20 000 ед).
Хромоскопия 0,2 % раствором индиго карминового.
При необходимости – отмывание красителя.
Early gastric cancer — Endoscopic Type I
Japanese endoscopic classification, 1962
Carcinoid — Endoscopic Type I
Japanese endoscopic classification, 1962
Early gastric cancer — Endoscopic Type IIc
Japanese endoscopic classification, 1962
«…индиго кармин широко используется для изучения поверхностного различия между гиперпластическими полипами, которые имеют типичную модель гладкую поверхность при высоком увеличении и аденоматозными полипами, с дольчатой, пересеченной поверхностью. Таким образом, возростает и возможность выявления раннего рака кишки» (Suzuki S., Murakami H., Suzuki H, et al An endoscopic staining method for detection and operation of early gastric cancer. Int Adv Surg Oncol. 1979)
Используется 0,1-0,5 % раствор
4. Средство для татуировка (Tattooing)
VII. Прицельная биопсия
«Обнаруживая очаг поражения, красители являются индикаторами прицельной биопсии». (А. С. Балалыкин. «Эндоскопическая абдоминальная хирургия». – М.,1996)
«Благодаря использованию методов морфологического анализа эндоскопическая диагностика злокачественных поражений желудка достигает 95-100 %» (Л. К. Соколов,1971; Р. А. Мельников, Г. Г. Павлов, 1973; Kabayachi at. al.,1970)
«…при малигнизированных полипах и ранних формах рака желудка ошибки щипцовой биопсии достигают 8-60 % (сводная статистика P. Hermanek, 1973)».
(А. С. Балалыкин. «Эндоскопическая абдоминальная хирургия». – М.,1996)
Причины ошибочных результатов при исследовании биопсийного материала:
При биопсии, выполненной из одной точки малигнизированной язвы желудка, вероятность постановки правильного диагноза – 70 %, при биопсии в 8 точках эта вероятность повышается до 95-99%.
При увеличении числа биоптатов вероятность постановки правильного диагноза не повышается.
VIII. Фиксация результатов исследований (контроль качества)
«Возможности проведения эндоскопических исследований и результативность должны определяться следующими условиями: прежде всего их целесообразностью и необходимостью, во-вторых, опытом исследователя, в-третьих, состоянием больного, в- четвертых, набором эндоскопических приборов». (В. С. Савельев, В. М. Буянов, А. С. Балалыкин. «Эндоскопия органов брюшной полости» – М. – 1977).
Комплекс мероприятий, составляющих современную диагностическую эндоскопию:
Факторы, обеспечивающие качественное исследование
Культура эндоскопического исследования
Стандартное эндоскопическое диагностическое исследование
Вопрос: Качество эндоскопического исследования
Хромоскопия
Применение прижизненных методов окраски слизистой оболочки становится неотъемлемой частью эндоскопического исследования и существенно расширяет ее возможности в диагностике функциональных и морфологических изменений органов пищеварительного тракта. Повышение интереса специалистов к хромоскопии отчасти связано с доступностью и простотой метода, его безопасностью. Применение витальных методов окраски позволяет эндоскописту выявлять мелкие поражения слизистой оболочки желудочно-кишечного тракта, их протяженность, определять границы, детализировать структурные особенности. Для этих целей используют растворы: генциана фиолетового (0,2%), индиго кармина (0,1-0,5%), конго красного (конгорот 0,3-0,5% водный раствор), Люголя (1-4% водный раствор), метиленового синего (0,25-0,5% водный раствор), нейтрального красного (1%), толуидинового синего (1% водный раствор), фенола красного (0,1%). Красители по механизму действия делятся на абсорбционные (раствор Люголя, метиленовый синий, толуидиновый синий), контрастирующие (индиго кармин, метиленовый синий) и реактивные (конго красный, раствор Люголя, фенол красный).
Эффективность витальных методов окраски основана на способности красителей контрастировать ткани, оказывать на них биологическое, химическое, флюоресцентное воздействие. Суть контрастирования ткани состоит в усилении рельефа слизистой оболочки желудочно-кишечного тракта при нанесении на нее красителя. Биологическое воздействие связано со способностью красителя проникать через мембрану клетки в цитоплазму и окрашивать ее (метиленовый синий). Химическое воздействие обусловлено способностью красителя вступать в химическую реакцию с веществами эпителиальных клеток и секретом (конго красный, нейтральный красный, раствор Люголя).
Применяются прямые методы хромоскопии: краситель наносится на обследуемую поверхность непосредственно во время эндоскопии, этот метод прост и не требует специальной подготовки. Непрямые методы более информативны, но требуют специальной подготовки органа перед нанесением красителя: механической очистки поверхности, применения муколитиков для растворения и удаления слизи, стимуляторов секреции, нейтрализации среды и т.п.
Хромоскопия может выполняться введением красителя непосредственно через биопсийный канал эндоскопа или (это предпочтительнее) распылением по катетеру, введенному через канал эндоскопа. Распыление красителя осуществляется в пищеводе и толстой кишке при направлении эндоскопа и кончика катетера к слизистой оболочке с использованием вращательных движений (по часовой стрелке и против) и одновременной подачей красителя. Для снижения перистальтической активности обследуемого органа перед исследованием целесообразно применение накануне спазмолитиков (например, при
При эзофагоскопии применяют растворы Люголя, метиленового синего, толуидинового синего и уксусной кислоты. Рекомендуется промыть пищевод раствором муколитика и наносить краситель через 2 минуты. Краситель действует на гликогенсодержащие клетки, абсорбируется и взаимодействует с гликогеном. Клиническими показаниями для применения раствора Люголя являются плоскоклеточный рак пищевода, рефлюкс-эзофагит, пищевод Барретта, в том числе для уточнения границ регенерации эпителия у больных, перенесших резекцию слизистой оболочки, фотодинамическую терапию, биполярную электрокоагуляцию.
Применяется от 20 до 50 мл 1-4% или 2-3% (что предпочтительнее) раствора Люголя. Нормальный, неизмененный неороговевающий эпителий пищевода через 2-3 секунды после нанесения красителя окрашивается в черный, темно-коричневый цвет или зеленовато-коричневый цвет, поверхность его становится морщинистой. Участки воспаления, злокачественного поражения слизистой оболочки пищевода, кишечной метаплазии, железистый эпителий, тяжелая дисплазия или метаплазия эпителия при пищеводе Барретта и желудок не окрашиваются.
Толуидиновый синий (Toluidine blue) окрашивает клеточные ядра, используется для диагностики очагов злокачественного перерождения слизистой оболочки желудочно-кишечного тракта. Окрашивание периульцерозной зоны в синий цвет может быть дифференциально-диагностическим признаком между доброкачественным и злокачественным изъязвлением. Применение хромоскопии с толуидиновым синим при пищеводе Барретта позволяет окрашивать участки кишечной метаплазии, но метод не позволяет дифференцировать кишечную и желудочную метаплазию. Поверхность орошается 30 мл 1% раствора уксусной кислоты, через 20 с наносится 10 мл 1% раствора толуидинового синего и через 30 с опять промывается раствором уксусной кислоты.
него в желудке описал Tsuda (1967).
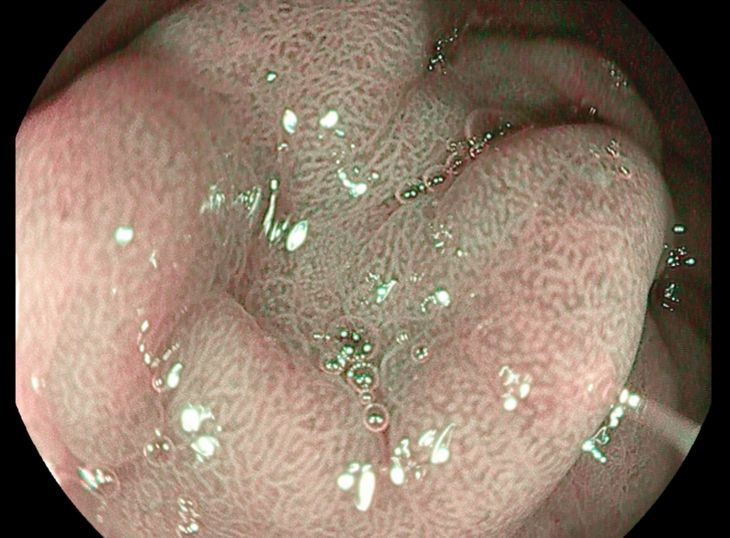
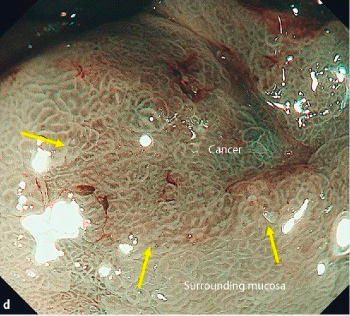
Индиго кармин (Indigo carmine) не окрашивает слизистую оболочку, его применяют для контрастирования ее рельефа, а метиленовый синий, кроме того, окрашивает злокачественные новообразования и кишечную метаплазию. Индиго кармин, скапливаясь в щелях между эпителиальными клетками, усиливает рельефность слизистой оболочки, выделяя повреждения ее целостности, неровности рельефа, нарушения архитектоники.
Диагностическая значимость применения хромоскопии с индиго кармином особенно возрастает при использовании увеличительной эндоскопии (осмотр с применением эндоскопических видеосистем, видеоэндоскопов), в этих случаях высокая разрешающая способность приборов позволяет оценивать рельефность ворсинок при подозрении на пищевод Барретта. В желудке индиго кармин может использоваться для выявления ранних форм рака. Для диагностики глютеновой энтеропатии (целиакии) индиго кармин
может вводиться внутриартериально для получения более точного эндоскопического изображения поражения, его размера и протяженности. Для комбинированной хромогастроскопии применяют 0,1-1,7% (чаше 0,1-0,5%) раствор индиго кармина и 0,25-0,5% раствор метиленового синего. При прямом нанесении краски на слизистую оболочку с помощью фиброскопа мельчайшие структуры выявляются лучше, чем при непрямом. При применении последнего способа краситель, выпитый больным, может смешаться в желудке со слизью и желудочным соком, поэтому требуется тщательная подготовка больных к исследованию. Для устранения пенистой слюны и слизи, которые окрашиваются в синий цвет и мешают оценке результатов, за 20 мин до исследования больной выпивает 20-50 мл раствора, включающего протеолитический фермент, муколитик, буферный раствор и пеногаситель. Эффективным, поддерживающим рН среды на нейтральном уровне является буферный раствор, включающий 500 мг NaHC03, 200 мг КН2Р04, 800 мг Na2HP04. Состав и количество раствора могут варьировать в зависимости от секреторной функции желудка. Премедикация и анестезия — как для проведения обычной гастроскопии. При прямом способе хромогастроскопии после эндоскопического исследования пищевода, желудка и двенадцатиперстной кишки и оценки их видимых изменений на слизистую оболочку желудка в выбранном месте через распылительный катетер наносят 0,25% раствор метиленового синего или индиго кармина. Окрашивание может быть прицельным и тотальным. При прицельном окрашивании предварительно смывают слизь со слизистой оболочки 0,5% раствором бикарбоната натрия. Краситель покрывает поверхность слизистой оболочки желудка, делает ее рельефной или избирательно окрашивает отдельные участки. При непрямом способе хромогастроскопии желудок промывают через зонд раствором бикарбоната натрия, а затем вводят 10-20 мл 0,5% раствора метиленового синего (больной может выпить этот раствор). Срок аппликации красителя и время последующей гастроскопии устанавливают индивидуально в зависимости от моторной функции желудка — 30-120 мин. Если красителя много и он мешает проведению исследования, то можно аспирировать его через биопсийный канал эндоскопа. Результаты хромогастроскопии могут быть различными: краситель либо равномерно покрывает поверхность слизистой оболочки, скапливаясь в ямках и бороздках (он — индиго кармин — легко смывается с непораженной слизистой оболочки струей воды), либо стойко окрашивает в синий цвет язвенные и канцероматозные поражения (метиленовый синий). Слизь, слюна и фибрин окрашиваются в голубой цвет. Синее окрашивание может быть и при кишечной метаплазии. Окрашивание канцероматозной ткани равномерное и стойкое. Для исключения ложных результатов необходимо прибегать к прицельному удалению краски струей воды из катетера, снимать пласты окрашенной слизи щипцами и щеткой. Синее окрашивание при использовании метиленового синего объясняется тем, что при раке происходит диффузия краски через мембрану пораженной клетки, а при кишечной метаплазии — абсорбция ее эпителиальными клетками. Хромогастроскопия дает положительные результаты в том случае, если краска контактирует с тканью опухоли. При внутрислизистом и подслизистом росте методика неэффективна и синего окрашивания не происходит. Однако и в этих случаях можно выявить некоторые косвенные признаки, свидетельствующие о глубоком расположении опухоли: изменения структуры слизистой оболочки, эрозии, различные по размерам, форме и расположению гранулы, грубая поверхность слизистой оболочки с неравномерной гиперемией, образование складок и слияние концентрических складок слизистой оболочки, мелкие выемки с неправильными краями. Эти признаки характеризуют злокачественный процесс и становятся более отчетливыми при рассеивании красителя. При раке хромогастроскопия не дает ложноположительных результатов, ее эффективность достигает 77,8%.
Хромогастроскопия с метиленовым синим позволяет:
1) лучше оценивать изменения макроскопической картины слизистой оболочки, контролировать процесс заживления хронических язв на разных его этапах (границы, количество и качество грануляций);
2) выявлять мельчайшие доброкачественные повреждения (эрозии, рубцы, деформации складок слизистой оболочки);
3) определять распространенность злокачественной инфильтрации;
4) дифференцировать небольшие доброкачественные и злокачественные (ранние
формы рака) поражения;
5) обозначать множественные очаги злокачественного поражения ранним раком и определять возможность их удаления через эндоскоп диатермической петлей.
Главная цель применения метода — обнаружение участков, подозрительных на злокачественное поражение (ранний рак), и определение места проведения прицельной биопсии. Морфологическая верификация диагноза/заключения при хромоскопии является обязательной.
Хромодуоденоскопия с метиленовым синим: натощак за 2 ч 30 мин до исследования с 50 мл теплой воды обследуемому дают 1,5-2 г питьевой соды, чтобы «очистить» желудок от слизи, которая при ее наличии в желудке хорошо окрашивается метиленовым синим и затрудняет точное выявление окрашенной метиленовым синим собственно слизистой оболочки желудка («нормальная», т.е. без кишечной метаплазии или без ракового изменения, слизистая оболочка желудка метиленовым синим не окрашивается). Через 30 мин после приема соды исследуемый выпивает (ничем не запивая) 40 мл 0,25% раствора метиленового синего, а затем лежит в течение часа. Через 2 ч после приема раствора метиленового синего проводят эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки по общепринятой методике.
Необходимо отметить, что эндоскопическое исследование верхних отделов желудочно-кишечного тракта с использованием метиленового синего не затрудняет тщательного осмотра пищевода, желудка и двенадцатиперстной кишки. При исследовании пищевода практически у всех больных отмечается неинтенсивное (светло-голубое) окрашивание слизи в виде полос на стенках пищевода. В желудке (в «озерке») обычно остается небольшое количество окрашенной в синий цвет жидкости. При желании эту жидкость можно удалить электроотсосом. Поверхностный слизеобразующий эпителий желудка не окрашивается и выглядит, как при обычном эндоскопическом исследовании без применения метиленового синего. При наличии в желудке язвенных дефектов и «свежих» послеязвенных рубцов вокруг язвы или «свежего» рубца при близком рассматривании определяется синий «крап», чаще всего кольцевидно или звездчато окружающий язву или рубец. Гастродуоденоскопия с применением метиленового синего позволяет определять границу между слизистой оболочкой желудка и слизистой оболочкой двенадцатиперстной кишки. Эндоскопически это выглядит в виде четкого перехода розовой окраски, присущей слизистой оболочке желудка, в темно- или светло-синюю. Необходимо отметить, что эта граница не во всех случаях совпадает с анатомической линией перехода желудка в двенадцатиперстную кишку. Диффузность окраски слизистой оболочки двенадцатиперстной кишки метиленовым синим четко коррелирует с наличием в ней визуальных изменений: если луковичный и постбульбарный отделы двенадцатиперстной кишки практически у всех обычно окрашиваются диффузно, то у больных язвенной болезнью двенадцатиперстной кишки (с локализацией язвы в ее луковичной части) окраска слизистой оболочки луковицы двенадцатиперстной кишки во всех случаях носит
очаговый характер — не окрашивался «ореол» вокруг язвы (сама язва, вернее, ее фиброзный налет иногда может окраситься в синий цвет). Подобная картина определяется и при «свежих», и при «старых» рубцах. При наличии визуальных данных, характерных для дуоденита, обычно не окрашиваются различные по протяженности «очаги». Прослеживается существенная разница в гистологическом строении слизистой оболочки двенадцатиперстной кишки, взятой из участков, окрашенных и не окрашенных метиленовым синим. Особенно четкие корреляции между выявлением и не выявлением желудочной метаплазии, соответственно в окрашенных и не окрашенных участках слизистой оболочки двенадцатиперстной кишки метиленовым синим, установлены у больных язвенной болезнью двенадцатиперстной кишки. У них в кусочках слизистой оболочки луковицы, взятых из окрашенных метиленовым синим участков, желудочная метаплазия практически не выявляется. В то же время желудочная метаплазия обнаруживается в большинстве случаев, когда кусочки биопсируют из участков слизистой оболочки двенадцатиперстной кишки, не окрашенных метиленовым синим.
Индиго кармин (Indigo carmine) не окрашивает дуоденальные клетки и скапливается между ворсинами слизистой оболочки. Осмотр луковицы производят сразу после нанесения красителя через катетер. Нормальные и гипертрофированные ворсины в луковице двенадцатиперстной кишки четко контурируются, и нетрудно обнаружить их отсутствие вокруг эрозий, язв и рубцов. Метиленовый синий густо покрывает поверхность слизистой оболочки, окрашивая кишечную метаплазию и абсорбируется дуоденальными клетками. Чтобы оценить состояние слизистой оболочки, краситель смывают водой с помощью катетера. Если слизистая оболочка не окрашивается метиленовым синим, это значит, что ворсины отсутствуют и имеется поражение эпителия. Цвет слизистой оболочки вокруг язвы не изменяется, но кратер ее окрашивается в голубой цвет в связи с наличием экссудата и фибрина. В процессе эпителизации язвы абсорбционная способность восстанавливается и слизистая оболочка вновь начинает окрашиваться. В связи с разной способностью индиго кармина и метиленового синего к окрашиванию первый используют для оценки морфологических, а второй — функциональных нарушений слизистой оболочки двенадцатиперстной кишки. Оба красителя эффективны при выявлении небольших выступающих и углубленных поражений слизистой оболочки: гиперплазии ворсин, бруннеровых желез (желез двенадцатиперстной кишки) и лимфатических желез. Метиленовый синий позволяет определить восстановление эпителия при заживлении хронических язв.
Генциан фиолетовый (Cresyl violet) используется для выявления ранних злокачественных поражений желудочно-кишечного тракта, особенно эффективен при использовании увеличивающей аппаратуры. 0,2% раствор генциана фиолетового может распыляться после индиго кармина для уменьшения числа ошибок при выявлении ранних раков толстой кишки.
Методика хромогастроскопии с конго красным (Congo red, Biphenylene napIhdene sulfonic acid) претерпела со временем значительные изменения.
Конго красный — это рН-индикатор, суть метода состоит в реакции между красителем и хлористоводородной кислотой желудочного сока. Конго красный относится к реактивным
красителям, окрашивающим кислотопродуцирующие (обкладочные) клетки желудка.
Клиническое применение красителя — рак желудка, выявление кислотопродуцирующих клеток желудка.
Ю. М. Панцырев и соавт. (1978) при изучении секреторной топографии желудка с использованием конго красного придают особое значение предварительной нейтрализации кислого содержимого желудка и его эвакуации. После анестезии вводят желудочный зонд и желудок промывают водой. Затем по зонду вливают и через 5 мин удаляют 100-150 мл 4% раствора бикарбоната натрия, для окраски слизистой оболочки в желудок вводят 50 мл 0,5% раствора конго красного и через 8-10 мин краситель эвакуируют, после чего зонд извлекают. Затем производят гастроскопию и маркировку границ антрального отдела желудка. Обычно обнаруживают четкую границу между телом
желудка, имеющим черный цвет, и антральным отделом красного цвета. Необходимость в стимуляции выработки соляной кислоты гистамином или пентагастрином возникает редко, ее производят лишь у больных с гипоацидным состоянием. Краситель может использоваться самостоятельно или в комбинации с метиленовым синим: после предварительной обработки 0,5% раствором бикарбоната натрия распыляют вначале 0,3-0,5% раствор конго красного для выявления зон атрофии с участками разного рельефа, затем метиленовый синий — для определения кишечной метаплазии. Ранний рак при таком окрашивании выделяется как «отбеливаемая» область слизистой оболочки, не красящаяся ни одним из красителей. Конго красный может применяться для выявления кислотопродуцирующих зон, оценки полноценности ваготомии. После предварительной стимуляции секреции желудка гистамином или пентагастрином по время эндоскопии производится орошение слизистой оболочки 0,5% раствором бикарбоната с последующим распылением 0,3-0,5% раствора конго красного. При положительной реакции происходит изменение красного цвета красителя в черный в течение 1-2 минут. В результате происходит выделение кислотопродуцирующих зон, зон с пониженной секрецией кислоты или с отсутствием таковой.
Фенол красный (Phenosulfon phthalein, Phenol red) является индикатором рН, он обнаруживает щелочную рН изменением цвета от желтого до красного. Используют 0,1% раствор, который можно наносить непосредственно на слизистую оболочку без предварительной подготовки. Используют для диагностики Н. pylori. При инфицировании Н. pylori уреаза, синтезируемая инфекционным агентом, приводит к увеличению рН, что проявляется изменением цвета красителя. Рекомендуется также распыление 0,1% раствора фенола красного и 5% раствора мочевины после предварительного применения муколитика (АЦЦ), пеногасителя и М-холинолитика. Положительный результат проявляется изменением цвета от желтого до красного.
Хромогастроскопия с нейтральным красным. Этот метод применяют для изучения секреторной функции желудка. После тщательного эндоскопического исследования слизистой оболочки желудка и двенадцатиперстной кишки и визуальной оценки изменений слизистой оболочки в локтевую вену вводят 5-6 мл 1% раствора нейтрального красного. Наблюдение за выделением красителя слизистой оболочкой желудка и оценку его секреторной функции производят по следующим показателям: времени и месту появления нейтрального красного, интенсивности (слабое, умеренное) и характеру (очаговое, сетчатое, сплошное) окрашивания, времени максимального выделения красителя и границам окрашивания. Начало выделения нейтрального красного слизистой оболочкой желудка определяют по появлению малинового окрашивания, зафиксировать которое не составляет особого труда. Лишь в местах гиперемии и инфильтрации это сделать сложнее, поскольку нарушена экскреторная способность этих отделов и трудно произвести дифференцировку цвета. Нужно внимательно наблюдать за накоплением красителя в углублениях слизистой оболочки на этих участках. Для того чтобы определить первичный очаг выделения красителя, необходимо постоянно наблюдать за всей поверхностью слизистой оболочки, перемещая дистальный конец прибора по оси желудка и осматривая различные поля. Краситель может выделяться одновременно на всей поверхности слизистой оболочки желудка в области расположения обкладочных клеток или на отдельных ее участках. Это зависит от функциональных нарушений процесса образования соляной кислоты и морфологических изменений слизистой оболочки. При осмотре с близкого расстояния можно четко определить, как краситель появляется в желудочных ямках (точечные малиновые пятнышки на желудочных полях), окрашивает желудочные поля и скапливается в разделяющих их бороздках. Визуально можно определить количество желудочных ямок на желудочных полях, из которых выделяется краситель, что имеет большое значение для оценки функциональных и морфологических нарушений кислотообразующей функции желудка. По мере накопления выделившегося красителя он заполняет углубления между желудочными складками. Окрашенные в малиновый цвет участки слизистой оболочки четко дифференцируются от неокрашенных. Время от начала выделения до максимальной экскреции нейтрального красного в норме не превышает 4-5 мин. При повышенной экскреторной и кислотопродуцирующей функции желудка наблюдаются ускоренное выделение красителя, уменьшение интервала между началом выделения и интенсивным окрашиванием. При снижении секреторной способности желудка выделение красителя замедляется, указанный интервал увеличивается, а окрашивание остается очаговым. Определение границ кислотопродуцирующей зоны и антрального отдела желудка производят в процессе наблюдения за экскрецией нейтрального красного и заканчивают при достижении максимального выделения краски. На результаты исследования влияют такие факторы, как положение больного во время исследования, характер моторной функции желудка, скорость выделения красителя и интенсивность окрашивания. В положении больного на левом боку краситель стекает в тело желудка, в положении на спине — в антральный отдел, т.е. определяемые границы кислотопродуцирующей зоны могут быть уже или шире истинных. При выраженной перистальтике антрального отдела и резком повышении выделительной функции желудка ошибка более вероятна. При поверхностных гастритах в результате отека желудочные поля уплощаются, желудочные ямки сдавливаются, а бороздки между полями суживаются, становятся мелкими и в большинстве случаев совсем исчезают вследствие заполнения фибрином. Наблюдается характерная для поверхностного гастрита картина микрорельефа: ярко-розовые желудочные поля окружены нежными белыми полосками фибрина. Краситель не задерживается в желудочных ямках, полях и бороздках, стекает с них и скапливается между складками. Таким образом, при поверхностных гастритах не получается характерный сетчатый рисунок слизистой оболочки в момент выделения краски. В зависимости от степени атрофии слизистой оболочки снижается или полностью отсутствует кислотообразование в желудке. Оставшиеся участки слизистой оболочки сохраняют свою функцию, но она резко снижена: краситель выделяется поздно (к 10-15-й минуте), а окрашивание слабое, очаговое. Анализ результатов хромогастроскопии у больных язвенной болезнью показал, что характер расположения обкладочных клеток, величина и границы кислотообразующей зоны зависят от локализации язвы. При дуоденальных язвах отмечается равномерное сплошное распределение обкладочных клеток в дне и теле желудка. У 60% обследованных больных кислотообразующая зона занимала значительную часть слизистой оболочки желудка и спускалась в антральный отдел. При язвах желудка отмечены смещение нижней границы кислотопродуцирующей зоны вверх, особенно по малой кривизне, неравномерность распределения обкладочных клеток в этой зоне и наличие атрофических процессов. При этом чем выше в желудке располагалась язва, тем выше была и нижняя граница окрашивания. При локализации язвы в теле желудка малая кривизна, как правило, не окрашивалась, а по большой кривизне нижняя граница кислотопродуцирующей зоны проходила выше проекции угла желудка. Эти наблюдения позволили сделать вывод, что хронические язвы желудка локализуются вне зоны расположения обкладочных клеток или в переходной зоне.
Таким образом, хромогастроскопия позволяет дифференцировать специфичные изменения секреторной топографии желудка при различных заболеваниях и визуально разграничивать его функциональные зоны (кислотопродуцирующую и антральную).
Маркировку границ кислотопродуцирующей зоны производят тушью. Раствор китайской туши вводят в подслизистый слой желудка с помощью инъекционной иглы до образования темной точки. Количество точек зависит от целей исследования. Для маркировки резецируемого антрального отдела желудка необходимо обозначить его границы по малой и большой кривизне и передней стенке в 5-6 точках, а для проведения селективной проксимальной ваготомии — лишь по малой кривизне.
Хромодуоденоскопия с закисленным конго. Для изучения ощелачивающей функции антрального отдела желудка и определения рН двенадцатиперстной кишки можно использовать простую методику хромоскопии с закисленным конго. Закисление конго красного производят путем добавления к нему соляной кислоты из расчета 1 мл 1% раствора кислоты на 100 мл красителя (рН раствора 2,0). При этом раствор конго приобретает черный цвет. Его распыляют через катетер в луковице и нижележащих отделах двенадцатиперстной кишки, а затем фиксируют время восстановления окраски красителя, что имеет прогностическое значение. В двенадцатиперстной кишке, имеющей в норме щелочную среду, краситель быстро изменяет черную окраску на красную, а при кислом содержимом в двенадцатиперстной кишке сохраняет черный цвет.
Хромоколоноскопия. Индиго кармин и метиленовый синий можно применять при колоноскопии для контрастирования рельефа слизистой оболочки, что позволяет выявить незначительные изменения ее и наблюдать за динамикой патологического процесса. Красители наносят на слизистую оболочку прямым распылением через катетер под визуальным эндоскопическим контролем или вводят в виде клизмы. Неизмененная слизистая оболочка приобретает голубоватый цвет и зернистый вид. Такую эндоскопическую картину не удается увидеть без окрашивания. Атрофически измененные участки слизистой оболочки, доброкачественные полипы и язвы не окрашиваются метиленовым синим, четко определяются на голубом фоне окрашенной слизистой оболочки. При язвенном колите интенсивность окрашивания уменьшается или слизистая оболочка вовсе не окрашивается. На основании этих данных можно судить о фазе (активная, ремиссия) колита, его локализации и распространенности. Злокачественные поражения (малигнизированные полипы, язвенные и полиповидные формы рака) окрашиваются в интенсивный синий цвет, который не исчезает при отмывании водой. Индиго кармин, особенно при использовании аппаратуры высокого разрешения, в толстой кишке может использоваться для изучения поверхностных различий между гиперпластическими (имеющими типичную форму, гладкую поверхность) и аденоматозными полипами (имеющими дольчатую, пересеченную поверхность), повышает вероятность выявления раннего рака. Частота ложноотрицательных результатов хромоколоноскопии при атрофических изменениях слизистой оболочки составила 2,5%, а при злокачественных поражениях ложноотрицательных результатов не отмечено. В 46,6% случаев границы злокачественной инфильтрации при обычной колоноскопии казались уже, чем при хромоскопии.