Хронический вирусный гепатит в без дельта агента что означает
Хронический вирусный гепатит B без дельта-агента
Рубрика МКБ-10: B18.1
Содержание
Определение и общие сведения [ править ]
Хронический HBe-позитивный гепатит В
Хронический HBeAg-негативный гепатит В
Этиология и патогенез [ править ]
Клинические проявления [ править ]
У больного на ранних этапах ХГВ может обнаруживаться как дикий тип HBV, так и HBeAg-негативный мутантный штамм. По мере увеличения длительности инфицирования под действием иммунной системы организма происходит эволюция дикого штамма вируса, и процентное содержание мутантных форм постепенно начинает преобладать, а впоследствии мутантный вариант может вытеснить дикий тип вируса.
В течении ХГВ возможно как спонтанное, так и обусловленное лечением прекращение продукции НВеAg и вслед за этим появление в крови антител к нему (анти-HBе), что принято называть сероконверсией по HBеAg.
Фаза иммунной толерантности регистрируется, как правило, у молодых, инфицированных в детстве пациентов, она продолжается в среднем до 20-30-летнего возраста, характеризуется отсутствием иммунного реагирования на инфекцию HBV; как следствие, у таких лиц не регистрируется гистологическая активность гепатита, уровни АЛТ и
Иммуноактивная фаза, или стадия иммунного клиренса, характеризуется клинико-лабораторной картиной гепатита различной степени гистологической активности, повышением уровня активности АЛТ и АСТ, высоким уровнем виремии (106-108 МЕ/мл) на фоне сохраняющейся НВеAg-емии и отсутствием анти-HBe в крови. В основе патогенеза этой стадии болезни лежит иммуноопосредованный лизис гепатоцитов, инфицированных HBV. Длительность фазы иммунного клиренса различна (от нескольких лет до десятилетий), что, в свою очередь, определяет риск развития цирроза печени: он тем выше, чем дольше длится данная фаза болезни.
Фаза иммунного контроля, или фаза неактивного носительства HBV, регистрируется у 25-50% пациентов в возрасте до 40 лет при спонтанной сероконверсии по НВеАg. У 10-30% инфицированных HBV после сероконверсии НВеAg сохраняются уровень виремии в диапазоне 103-106 МЕ/мл и повышенная активность АЛТ, т.е. развивается хронический НВеAg-негативный гепатит. В условиях иммуносупрессии пациент из статуса неактивного носительства может перейти в фазу реактивации HBV-инфекции, и в этом случае вновь будут выявляться признаки хронического НВеAg-негативного ХГВ с высоким уровнем виремии, повышенной активностью АЛТ и гистологически подтвержденным активным гепатитом. В отдельных случаях возможна реверсия анти-HBe/НВеAg, и диагноз больного будет вновь формулироваться как HBеAg-позитивный ВГВ.
Хронический вирусный гепатит B без дельта-агента: Диагностика [ править ]
Молекулярно-биологические методы, используемые при уточнении диагноза и значимые для выработки лечебной тактики больных хроническим гепатитом В
Определение ДНК HBV (качественное исследование) позволяет выявлять хроническую форму HBV-инфекции, скрытые (латентные) формы ВГВ и мутантные по HBsAg штаммы вируса. Кроме того, качественное и количественное исследование на ДНК HBV проводят для оценки вирусологического ответа при лечении аналогами нуклеозидов/нуклеотидов. Для мониторинга противовирусной терапии необходимо использовать высокочувствительные (ультрачувствительные) тесты, аналитическая чувствительность которых составляет не менее 20 МЕ/мл.
Качественное исследование на ДНК HBV проводят:
• контактным лицам в очаге ВГВ;
• донорам крови, органов и тканей;
• больным с признаками хронического гепатита неуточненной этиологии;
• больным с подозрением на латентную форму ХГВ;
• лицам, у которых выявляются анти-HBc при отсутствии HBsAg, перед проведением и в процессе иммуносупрессивной терапии (каждые 1-3 мес);
• больным ХГВ во время лечения аналогами нуклеозидов/нуклеотидов.
Определение генотипа HBV. Не только клиническое течение и исход ХГВ могут зависеть от генотипа HBV, генотип HBV является также фактором, от которого может зависеть эффективность противовирусного лечения. При лечении Пег-ИФН HBеAg-позитивного ХГВ наблюдается более высокая частота сероконверсии по HBеAg у пациентов с генотипом А, чем у пациентов с генотипами C и D. У HBеAgнегативных пациентов с генотипом D снижение концентрации ДНК HBV менее чем в 100 раз при отсутствии какого-либо снижения концентрации HBsAg на 12-й неделе лечения Пег-ИФН свидетельствует о низкой вероятности ответа на лечение. Выявлено, что генотип HBV не влияет на вирусологический ответ при лечении аналогами нуклеозидов и нуклеотидов.
Определение генотипа HBV пока не вошло в рутинную практику, однако становится все более доступным. В настоящее время в РФ уже имеются зарегистрированные диагностические тест-системы для генотипирования HBV на основе ПЦР в реальном времени. Учитывая имеющиеся данные, определение генотипа HBV может быть рекомендовано при планировании противовирусного лечения препаратами Пег-ИФН.
Инструментальные методы, используемые при уточнении диагноза и значимые для выработки лечебной тактики у больных хроническим гепатитом В
Морфологическая диагностика поражения печени при хроническом гепатите В
Морфологическая оценка степени активности и стадии ХГВ проводится по результатам пункционной биопсии печени (ПБП). Являясь широкодоступным и в целом безопасным методом оценки морфологических изменений печени, ПБП позволяет оценить локализацию и распространенность фибротического процесса и некровоспалительных изменений органа. Результаты ПБП легко интерпретируются и поддаются полуколичественной оценке. ПБП может выполняться в динамике болезни в целях определения прогрессирования поражения печени, кроме того, позволяет оценить вклад сопутствующих заболеваний (стеатогепатита, гемохроматоза, аутоиммунного гепатита и т.д.) в патологический процесс и их влияние на течение болезни и эффективность лечения.
Необходимо помнить, что ПБП имеет ряд ограничений, в частности имеет значение опыт врача, проводящего пункцию, и морфолога, оценивающего морфологические изменения; малый объем полученных образцов ткани печени снижает качество диагностики. Необходимо учитывать инвазивность процедуры и дискомфорт для пациентов, риск развития определенных осложнений.
Для интерпретации результатов ПБП используют полуколичественные шкалы определения активности патологического процесса в печени и фиброза (Knodell, Ishak, METAVIR) (см. приложения 5 и 6).
Показания к ПБП при хроническом вирусном гепатите: необходимость определения стадии заболевания и прогноза при отсутствии противовирусной терапии, решение вопроса о наличии строгих показаний к назначению противовирусной терапии.
ПБП как «золотой стандарт» диагностики хронических гепатитов требует строгого выполнения ее правил в условиях специализированных отделений и наличия квалифицированных морфологов.
В последние годы внедрены в клиническую практику неинвазивные методы оценки фиброза, прежде всего, эластометрия.
Дифференциальный диагноз [ править ]
Хронический вирусный гепатит B без дельта-агента: Лечение [ править ]
Показания к противовирусному лечению для НВеAg-позитивных и НВеAg-негативных больных ХГВ одинаковы и основываются на анализе результатов определения уровня вирусной нагрузки, активности АЛТ и тяжести поражения печени, оцениваемой при морфологическом исследовании.
Лечение рекомендуется при повышении активности АЛТ, уровне виремии более 2000 МЕ/мл и индексе гистологической активности или фиброза печени более 1 балла по шкале METAVIR. Если пациент соответствует критериям необходимости назначения лечения по уровню вирусной нагрузки и гистологической активности гепатита, противовирусная терапия может быть начата и при нормальном уровне активности АЛТ. На принятие решения о назначении противовирусной терапии также могут влиять такие факторы, как возраст пациента и его общее состояние, наследственность по ГЦК, внепеченочные проявления ХГВ.
У больных циррозом печени противовирусная терапия необходима при любом определяемом уровне виремии независимо от активности АЛТ. У больных с уровнем виремии менее 2000 МЕ/мл и активностью печеночного процесса необходимо исключать другую возможную причину поражения печени. Пациенты с декомпенсированным циррозом и определяемым уровнем ДНК HBV требуют незамедлительного начала лечения аналогами нуклеозидов/нуклеотидов. Стойкое подавление репликации ДНК HBV у этой категории больных, как правило, ассоциируется со значительным улучшением клинического течения заболевания.
Для лечения ХГВ применяют препараты ИФН и аналоги нуклеозидов/нуклеотидов.
Стандартный интерферон-а применяют в дозе 5 млн ЕД ежедневно или 10 млн ЕД 3 раза в неделю.
Аналоги нуклеозидов/нуклеотидов. Механизм действия этих препаратов основан главным образом на их структурном сходстве с естественными нуклеозидами/нуклеотидами (ложные медиаторы), что позволяет им встраиваться в синтезируемую вирусом при своем размножении цепь РНК или ДНК и блокировать дальнейшее построение молекулы вируса. Препараты применяют внутрь по 1 таблетке 1 раз в сутки.
Ламивудин (аналог цитидина) применяют в дозе 100 мг/сут. Для реализации противовирусного эффекта требуется внутриклеточное фосфорилирование неактивной формы ламивудина в трифосфат. Препарат быстро всасывается из желудочно-кишечного тракта (максимальная сывороточная концентрация достигается через 0,5-1,5 ч) и обладает хорошей биодоступностью (более 80%). Более 70% препарата выводится в неизмененном виде с мочой в течение суток после приема внутрь, поэтому больным с нарушением функций почек необходима коррекция с учетом показателей клиренса креатинина согласно инструкции производителя лекарственного препарата.
Энтекавир (нуклеозидный аналог гуанозина) применяют в дозах 0,5 мг/сут (для первичных больных) и 1 мг/сут (для больных с резистетностью к ламивудину и пациентов с декомпенсированным циррозом печени). Рекомендуют принимать препарат натощак, особенно больным с исходной резистентностью к ламивудину. Препарат выводится из организма преимущественно почками, поэтому у больных с почечной недостаточностью необходима коррекция дозы в зависимости от скорости клубочковой фильтрации, оцениваемой по клиренсу креатинина.
Телбивудин (нуклеозидный аналог тимидина) применяют дозе 600 мг/сут. У больных с нарушением функций почек необходима коррекция дозы согласно инструкции производителя лекарственного препарата.
Тенофовир (нуклеотидный аналог аденина) применяют в дозе 300 мг/сут. У больных с нарушением функций почек необходима коррекция дозы. У всех больных до начала терапии и, если имеются клинические показания, во время лечения тенофовиром рекомендуется рассчитывать клиренс креатинина. У больных с риском развития нарушений функций почек следует проводить регулярный мониторинг расчетного клиренса креатинина и концентрации фосфора в сыворотке крови. Тенофовир не следует использовать одновременно с нефротоксическими лекарственными средствами или в случае недавнего использования таких препаратов. Безопасность и эффективность применения тенофовира у больных с клиренсом креатинина от 30 до 49 мл/мин не определены, поэтому следует оценивать соотношение потенциальной пользы от терапии тенофовиром и возможного риска токсического воздействия на почки. Если все же есть необходимость использования тенофовира, требуется коррекция интервалов между приемами препарата. У таких больных следует вести тщательное наблюдение за функциями почек.
Профилактика [ править ]
Прочее [ править ]
Гепатит В у беременных
Обследование на ВГВ и ВГС беременных в I и во II триместре регламентировано санитарными правилами. Частота выявления ВГВ у беременных в 2-3 раза меньше частоты обнаружения антител к HCV. Тем не менее в РФ у 0,01-3% беременных (в зависимости от региона) выявляется HBsAg при обследовании во время беременности.
Существуют три возможных пути передачи HBV от инфицированной матери к ребенку: перинатально (внутриутробно или трансплацентарно), интранатально (во время родов) или постнатально (во время ухода за детьми или через грудное молоко). Общепризнанно, что наиболее часто передача вируса от матери к ребенку происходит во время или непосредственно перед родами, именно поэтому своевременно проведенная вакцинация новорожденных предотвращает заражение приблизительно в 80-95% случаев. Риск передачи HBV во время родов зависит от наличия НВеAg и уровня ДНК HBV в крови беременной перед родами.
Целесообразность и безопасность применения противовирусных препаратов во время беременности и обоснование применения пассивной и активной иммунизации для снижения риска перинатальной передачи инфекции, вызванной вирусом гепатита В
Безопасность применения энтекавира при беременности изучена недостаточно.
В существующих в настоящий момент рекомендациях по лечению ХГВ и тактике ведения беременных с ХГВ (EASL, 2012) указано, что для предотвращения внутриутробной и перинатальной передачи HBV ребенку при наличии высокого уровня виремии у беременной применение ламивудина, телбивудина и тенофовира в III триместре беременности в сочетании с пассивно-активной иммунизацией новорожденного безопасно и оправдано. Однако, по мнению экспертов ВОЗ (2015), несмотря на то что доказана безопасность применения нуклеозидных/ нуклеотидных аналогов во время беременности при лечении ХГВ у матери, применение этих препаратов для предотвращения инфицирования новорожденного даже в сочетании с Ig не имеет доказательств достаточной силы и требует дополнительного изучения.
Противовирусная терапия хронического гепатита В и грудное вскармливание
Несмотря на то что HBsAg был обнаружен в грудном молоке, грудное вскармливание не увеличивает риск передачи HBV-инфекции по сравнению с искусственным. Результаты исследований не продемонстрировали связи между естественным вскармливанием младенцев ВГВ-позитивными матерями и развитием у них ХГВ. Таким образом, новорожденные, которым введен Ig и проведен первый этап вакцинации против ВГВ, могут находится на естественном вскармливании. В случае необходимости продолжения противовирусной терапии в послеродовом периоде грудное вскармливание не рекомендовано изза отсутствия сведений о безопасности принимаемых препаратов на развитие новорожденного. Женщинам, которым назначена терапия аналогами нуклеозидов/нуклеотидов, следует отказаться от кормления грудью.
Источники (ссылки) [ править ]
5. Инструкция по применению вакцины гепатита В рекомбинантной дрож жевой суспензии для внутримышечного введения вакцине «Комбиотех». Утверждено Главным государственным врачом Г.Г. Онищенко от 19.11.2009 № 01-11/175-09.
13. Постановление от 11.03.2013 № 9 «О мероприятиях, направленных на стабилизацию заболеваемости парентеральным и вирусными гепатитами в Российской Федерации» Главного Государственного санитарного врача Российской Федерации.
16. Российская Федерация. Министерство здравоохранения. О национальном календаре профилактических прививок и календаре профилактических прививок по эпидемическим показаниям. Приказ Министерства здравоохранения Российской Федерации № 229, 27.06.2001.
Хронический гепатит дельта: современное состояние проблемы и перспективы лечения
Вирус гепатита дельта (HDV) представляет собой вирус-сателлит, которым инфицированы около 5% больных хроническим гепатитом В.Считается, что в мире имеется около 15-20 млн больных хроническим гепатитом D, который представляет собой одно из самых тяжелых заболеваний печени с высоким риском развития цирроза и рака печени. Пегилированный интерферон-a остается единственным препаратом, одобренным для лечения хронического гепатита D, хотя он характеризуется низкой эффективностью и высокой частотой нежелательных явлений. Изучение основных механизмов репликации HDV привело к созданию новых классов препаратов, блокирующих вход вируса в клетку и сборку его вириона. В настоящее время эти препараты изучаются в исследованиях II и III фазы.
В 1977 г. М. Rizzetto и соавт. описали новый антиген, случайно обнаруженный методом прямой иммунофлюоресценции в ядрах гепатоцитов HBsAg (+) больных. Антитела к названному впоследствии «дельта-антигеном» белку определялись в ткани печени больных активным хроническим гепатитом/циррозом печени и отсутствовали при остром гепатите В и неактивном носительстве HBsAg [1]. В дальнейшем было установлено, что этот белок является структурным компонентом нового вируса, получившего название вируса гепатита D (HDV).
Хроническая HDV-инфекция представляет собой одно из самых тяжелых и быстропрогрессирующих заболеваний печени с высоким риском развития цирроза печени и гепатоцеллюлярной карциномы. Несмотря на большое количество исследований, посвященных этой инфекции, ряд вопросов, в первую очередь патогенез, особенности естественного течения и эффективные методы лечения HDV-инфекции, остаются от крытыми.
Строение и свойство вируса
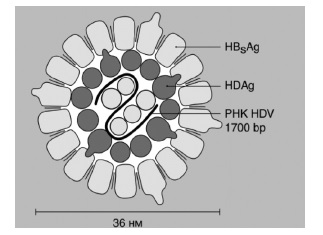
HDV представляет собой сферическую частицу диаметром от 28 до 39 мм, покрытую поверхностным антигеном HBV (рис. 1), внутри которой находится нуклеокапсид диаметром 19 нм, содержащий РНК вируса [2]. Нуклеокапсид состоит из 60 молекул дельта-антигена, который представлен двумя формами: длинной [L] (214 аминокислот), размером 27 кДа, и короткой [S] (195 аминокислот), размером 24 кДа. Длинный антиген образуется путем присоединения дополнительных 19-20 аминокислот на уровне нуклеотида 1012 малого антигена [3]. Ген, кодирующий HDAg, был успешно клонирован с помощью обратной транскриптазы и полимеразной цепной реакции [4]. HDV-S антиген необходим для репликации вируса, в то время как HDV-L антиген, наоборот, обладает способностью подавлять репликацию, но играет ключевую роль в механизмах сборки и секреции вирусной частицы.
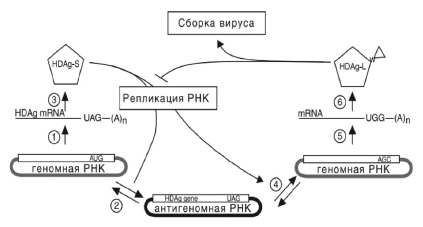
Геном РНК вируса представлен комплементарной одноцепочечной циркулярной нитью длиной в 1679 нуклеотидных оснований и является наименьшим из РНК-вирусов, поражающих человека. В геноме HDV имеется 6 открытых рамок считывания, из которых только одна рамка, участвующая в транскрипции, находится на позитивной стороне нити генома HDV RNA [5]. Ме ха низм репликации РНК вируса в своем роде уникальный и происходит путем так называемого симметричного двойного повторяющегося цикла (рис. 2). В процессе репликации в клетке присутствуют три формы вирусной РНК: геномная РНК (отрицательной полярности), антигеномная РНК (положительной полярности) и информационная РНК, наименьшая по размеру (примерно 900 нуклеотидов), которая содержит открытую рамку считывания для синтеза антигенов вируса. Репликация HDV автономна от HBV, но, будучи вирусом-сателлитом, HDV использует HBsAg для сборки вириона, секреции из гепатоцита и инфицирования других гепатоцитов.
Одним из важных направлений исследований генома HDV является изучение его стабильности. Эти исследования позволили выявить изменения состава РНК вируса в течение болезни у одного и того же пациента, которые могут быть одной из причин спонтанной реактивации хронического гепатита дельта. В исследовании китайских ученых было установлено, что более выраженные мутации обнаруживались при тяжелых обострениях [6]. Подобные исследования, возможно, помогут в будущем пролить свет на закономерности спонтанной реактивации HDV и своевременно реагировать на них, предотвращая реактивацию инфекции.
Эпидемиология
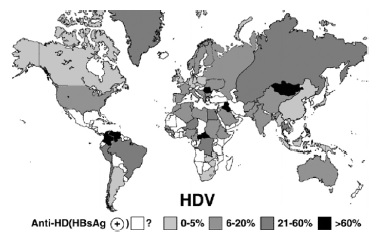
HDV распространен повсеместно. Считается, что около 5% больных хроническим гепатитом В инфицированы HDV (15-20 млн) [7]. Несмотря на одинаковые механизмы инфицирования и статус HDV как сателлитного вируса, реализующего свой потенциал только в присутствии HBsAg, зоны наибольшего распространения дельта-инфекции не повторяют в точности таковые HBV-инфекции. HDV высоко эндемичен в странах Средиземноморья, на Ближнем Востоке, в Центральной Африке, Центральной Азии и в северных частях Южной Америки. В США, Канаде и в странах Северной Европы (Дании, Швеции, Норвегии) значительное распространение HDV-инфекции отмечено в группах повышенного риска, в первую очередь у наркоманов. В настоящее время в мире выделяют регионы с низкой (0-5%), умеренной (6-20%), высокой (21-59%) и очень высокой (более 60%) частотой обнаружения маркеров HDV у лиц, инфицированных HBV (рис. 3).
Больные с гемофилией и другими состояниями, нуждающиеся в регулярных трансфузиях, составляли основную группу инфицированных в 80-х годах, однако со временем их доля постепенно уменьшается, что, по-видимому, связано с введением массовой вакцинации населения против HBV и рутинного скрининга продуктов крови на HBsAg.
За последние два десятилетия прошлого века отмечено значительное снижение распространенности HDV-инфекции, в первую очередь в странах Западной Европы, Юго-Восточной Азии и Турции. По данным итальянского многоцентрового исследования, распространенность HDV среди носителей HBsAg в 1997 г. равнялась 8,3% (69 из 834), что значительно ниже показателей 1992 и 1987 гг. (14% и 23%, соответственно). В период с 1987 г. по 1997 г. распространенность гепатита дельта в Италии снижалась на 1,5% ежегодно, в связи с чем авторы пришли к выводу, что в течение ближайших нескольких лет удастся установить полный контроль над распространением вируса гепатита дельта в итальянской популяции [9]. Аналогичную картину демонстрировали наблюдения и из других европейских стран, что позволило в конце 90-х годов рассматривать гепатит дельта как исчезающее заболевание, но в новых эпидемиологических исследованиях отмечено изменение ситуации в течение последнего десятилетия. В Италии частота обнаружения маркеров HDV среди носителей HBsAg после длительного периода снижения (с 24,6% в 1978–1981 гг. до 8,3% в 1997 г.) в настоящее время остается достаточно высокой – 8,1% в 2007 г. [10]. В Германии, где в 90-е годы наблюдалось снижение распространенности гепатита дельта с 18,6% до 6,8%, с 1999 г. она сохраняется на стабильно высоком уровне (8-14%) [11].
Причиной вновь возросшей распространенности HDV-инфекции, скорее всего, является миграция населения из неблагополучных и эндемичных по гепатиту дельта регионов, что подтверждается высоким уровнем носительства HDV среди некоренного населения. К примеру, распространенность HDV-инфекции в Швей царии составляет 5,9%, а среди мигрантов достигает 38,0% [12].
Одной из причин сохраняющейся распространенности HDV-инфекции наряду с миграцией населения можно назвать снижение настороженности врачей. При проверке лабораторий муниципальных клиник Лондона выяснилось, что в течение последних нескольких лет рутинное тестирование носителей HBsAg на маркеры HDV проводилось не во всех случаях [13]. Аналогичные данные были получены в Чехии, Италии, Франции и Германии [14,15]. В исследовании, проведенном в клинике им. Е.М.Тареева, у 16 (31%) из 64 больных диагноз «хронический гепатит D» был впервые установлен спустя длительное время (до 10 лет), хотя эти больные наблюдались в других лечебных учреждениях с диагнозом хронического гепатита В; при этом им ни разу не проводили исследование сыворотки на маркеры дельтаинфекции [16]. Это еще раз подчеркивает необходимость обязательного тестирования всех больных с HBsAg на HDV, особенно при высокой активности воспаления и наличии цирроза печени.
В России оценка частоты выявления маркеров HDV среди носителей HBsAg проводилась в нескольких регионах. В европейской части России антитела к HDV определялись у 1,3-5,5% HBsAg (+) лиц [17]. Энде мич ным по HDV-инфекции регионом признана Рес пуб лика Саха (Якутия), где доля хронического гепатита дельта в этиологической структуре хронических вирусных гепатитов составила 24,5%, в отдельных районах доля больных с антителами к HDV среди HBsAg (+) лиц достигала 31% [18,19]. Существенный уровень носительства HDV-инфекции был отмечен также в Рес пуб лике Тыва [20]. Необычно высокий уровень распространенности HDV-инфекции регистрировался в Астраханской области, где среди 151 больного с хроническим заболеванием печени у 66,9% был обнаружен HBsAg, а у 74,5% из них определялись маркеры HDV. В то же время среди пациентов с острым гепатитом В частота выявления антител к HDV составила только около 10% [21]. В исследовании, проведенном в клинике им. Е.М. Таре ева в Москве, за период с 2002 г. по 2014 г. маркеры активной дельта-инфекции (антиHDV-IgM и/или HDV RNA) были выявлены у 118 (21,7%) из 543 больных с HBsAg [22]. Обращает на себя внимание вспышка HDV-инфекции в конце 90-х годов в Самар ской области, где частота обнаружения HDV у HBsAg (+) лиц достигала 39%, что, вероятно, объясняется большим числом наркоманов в эпидемиологической выборке [23].
Очень высокий уровень инфицированности HDV отмечен во Вьетнаме, Гренландии, Индии, Иране, Мавритании, Монголии, Нигерии, Пакистане, Таджи ки стане, Тунисе 26.
Пути передачи HDV аналогичны таковым HBV: преимущественно парентеральный, реже половой и перинатальный. У обследованных нами 118 пациентов с хроническим гепатитом D, факторы риска инфицирования HDV распределились следующим образом: оперативные вмешательства (включая стоматологические) – 51%, гемотрансфузии – 20%, наркомания – 18%, возможный внутрисемейный путь передачи – 17%. У 10% больных путь передачи инфекции установить не удалось [22]. Контагиозная активность HDV значительно ниже по сравнению с HBV, поэтому половой, перинатальный и бытовой пути передачи не столь очевидны, хотя в эндемичных по HDV регионах они могут играть более важную роль [34]. По данным итальянского исследования, члены семьи больного с HDV-инфекцией имели 12,9-кратный риск инфицирования вирусом по сравнению с таковым в общей популяции [35].
В настоящее время выделяют 8 различных генотипов HDV в зависимости от нуклеотидной последовательности и географической распространенности, хотя последний фактор частично утратил свое значение в силу миграции населения. Различные генотипы HDV отличаются друг от друга не более чем на 30 нуклеотидов по длине генома, но различия в нуклеотидной последовательности могут доходить до 30% [36].
Первый генотип наиболее распространен и встречается повсеместно, особенно в странах Средиземно мор ского региона, Африке, Европе и Северной Америке. Хронический гепатит, вызванный вирусом 1-го генотипа, характеризуется вариабельным течением (от мягких до быстропрогрессирующих форм). В исследовании, проведенном в клинике им. Е.М.Таре ева, у всех обследованных больных с HDV-инфекцией был выявлен 1-й генотип, преимущественно подтип 1b (в 85% случаев) [16]. Данный подтип наиболее близок к последовательностям молдавских и болгарских изолятов HDV [37]. Второй и 4-й генотипы встречаются преимущественно на Дальнем Востоке, в том числе в России [38], характеризуются, как правило, мягким, медленно прогрессирующим (по сравнению с 1-м генотипом), редко – тяжелым (прежде всего 4-й генотип) течением заболевания. Третий генотип встречается в северной части Южной Америки (Колумбия, Вене су эла, Перу, Эквадор), а гепатит, вызванный вирусом этого генотипа, имеет наиболее тяжелое, часто фульминантное течение заболевания с быстрым исходом в цирроз печени. Другие генотипы были идентифицированы относительно недавно в Африке и недостаточно изу чены.
Патогенез
В настоящее время не существует единой точки зрения на патогенез HDV-инфекции, обсуждается как иммуноопосредованное 40, так и прямое цитопатическое действие вируса на печень [42].
Показано, что периферические мононуклеарные клетки пациентов с неактивным хроническим гепатитом D (стабильно нормальный уровень АЛТ и отсутствие анти-HDV IgM) демонстрировали специфичную в отношении HDAg пролиферацию in vitro [43]. Отсут ствие аналогичных проявлений у сопоставимых пациентов с активным печеночным процессом, видимо, отражает то, что в данном случае именно клеточный иммунный ответ позволял контролировать течение HDV-инфекции.
HDV ингибирует не только систему эндогенных ИФН-a, активирующихся в ответ на вирус [47], но и блокирует сигнальные пути JAK-STAT, необходимые для индукции противовирусного ответа [48]. Данное свойство HDV может быть одной из причин низкой эффективности противовирусной терапии ИФН-α.
Первые данные о возможном цитопатическом эф фекте HDV были получены в ходе наблюдения за вспышками тяжелых случаев вирусного гепатита дельта в бассейне реки Амазонка, которые были обусловлены третьим генотипом HDV [49]. При этом в ткани печени определялись выраженный мелкокапельный стеатоз и эозинофильный некроз на фоне умеренных лобулярных изменений. Подобные гистологические проявления наблюдались также при фульминантном гепатите дельта у жителей регионов Экваториальной Африки [50].
Открытым остается вопрос о защитной роли антител к HDV, которые выявляют у всех больных, имевших контакт с вирусом, но не ассоциируются с развитием иммунитета. Повторное инфицирование шимпанзе, перенесших острый гепатит дельта, тем же вирусом, сопровождалась менее выраженной виремией, чем при первом инфицировании [51]. Это позволяет предполагать, по крайней мере, частичную защитную функцию вирус-специфичных антител, ограничивающую репликацию вируса.
Диагностика
Для диагностики HDV-инфекции определяют антитела к вирусу и RNA HDV в сыворотке крови. Антитела к HDV (анти-HDV) суммарные выявляют более чем в 90% случаев в течение 3–8 нед после инфицирования. При острой цикличной HDV-инфекции титр антиHDV IgM, как правило, невысокий, и они исчезают из крови в течение нескольких месяцев. При хронической HDV-инфекции (как правило, при суперинфекции) титр очень высокий и сохраняется на протяжении длительного времени. Анти-HDV IgG выявляют как при острой (в сочетании с преходящими анти-HDV IgM), так и при хронической (в сочетании со стойко персистирующими анти-HDV IgM) HDV-инфекции.
В настоящее время основным маркером репликативной активности HDV считают обнаружение RNA HDV в сыворотке крови методом ПЦР. С началом применения ПЦР для определения RNA HDV в крови роль анти-HDV IgM значительно снизилась. Однако, с учетом вариабельности генома HDV и отсутствия стандартизации тест-систем тестирование анти-HDV IgM может быть оправдано при подозрении на ложно-отрицательный результат ПЦР.
Рутинное количественное определение RNA HDV в настоящее время нецелесообразно, так как отсутствуют данные о корреляции уровня виремии и выраженности печеночного процесса [52]. Таким образом, единственной целью количественного определения RNA HDV представляется контроль эффективности противовирусной терапии [53].
Естественное течение и прогноз гепатита дельта
Острый гепатит дельта. Выделяют два варианта острого гепатита дельта, существенно отличающихся по течению и исходам: коинфекция и суперинфекция. При коинфекции оба вируса (HDV и HBV) попадают в организм одновременно, при этом наблюдаются, как правило, две волны активности гепатита (возможно, с желтушным компонентом): первая обусловлена HBV, вторая (через 2–4 нед) – HDV. Инкубационный период при коинфекции составляет в среднем от 3 до 7 нед [7].
При коинфекции в подавляющем большинстве случаев (более 95%) заболевание имеет циклическое течение и заканчивается спонтанным выздоровлением и элиминацией как маркеров HBV (HBsAg, DNA HBV), так и HDV (анти-HDV IgM, RNA HDV). При этом течение острого гепатита D обычно клинически и гистологически неотличимо от острого гепатита В (в ряде случаев описаны две волны обострения заболевания или желтухи). Менее чем в 5% случаев возможно развитие хронического гепатита D, а также фульминантной печеночной недостаточности [23,29,54,55].
При суперинфекции HDV попадает в организм человека с хронической HBV-инфекцией. Более чем в 90% случаев отмечается развитие хронического гепатита D [57]. У шимпанзе гистологические изменения в печени при суперинфекции HDV были значительно более выраженными, чем при коинфекции HDV или суперинфекции носителей HBV вирусом гепатита С [58]. Менее чем в 10% случаев суперинфекция HDV может разрешиться самостоя тельно с сохранением или даже элиминацией HBV (клиренсом HBsAg) [59]. При суперинфекции HDV значительно чаще развивается фульминантная печеночная недостаточность [57,60]. При отсутствии данных о существующем гепатите В суперинфекция HDV может быть ошибочно диагностирована как острый гепатит В [61].
Хронический гепатит дельта. В настоящее время выделяют 3 фазы течения HDV-инфекции в зависимости от вирусологического профиля: острая фаза с выраженной репликацией HDV, высокой активностью АЛТ и супрессией HBV; хроническая фаза, характеризующаяся уменьшением активности HDV, реактивацией HBV и умеренным повышением активности АЛТ; третья фаза с развитием цирроза печени и гепатоцеллюлярной карциномы в результате репликации одного из вирусов или ремиссии в исходе значительного уменьшения активности обоих вирусов [62]. Стадийность течения может быть прослежена у большинства больных хроническим гепатитом D. Однако, как показали клинические исследования, течение заболевания может отличаться в зависимости от популяции и генотипа HDV [63].
Имеющиеся данные о естественном течении хронического гепатита D, прогнозе и риске развития цирроза печени и его осложнений противоречивы. На наш взгляд, подобные значительные расхождения могут быть объяснены следующими причинами:
1. В большей части опубликованных наблюдений отсутствует четкое разделение пациентов на группы с отдельным анализом каждой из них. Это приводит к тому, что статистическая обработка и анализ проводятся в выборках больных, находящихся на разных стадиях заболевания, – от хронического гепатита до декомпенсированного цирроза печени.
2. Наблюдения последнего десятилетия позволили отметить изменение «характера» заболевания, в том числе за счет уменьшения числа новых случаев острого гепатита. Все чаще наблюдается преобладание вялотекущих стабильных форм заболевания и реже встречаются агрессивные формы хронического гепатита, которые в течение короткого времени приводят к развитию цирроза печени и его осложнений. Именно они определяли грозный облик болезни в конце прошлого века.
В итальянском многоцентровом исследовании авторы сравнили две группы больных, наблюдавшихся в 1977-1986 гг. (n=122) и 1987-1996 гг. (n=162) [64]. Агрессивное течение хронического гепатита D в первой декаде отмечалось значительно чаще (65%), чем во второй (17%). Аналогичные результаты были получены в ряде других итальянских работ [65,66]. По данным испанского исследования, доля больных с острым гепатитом D агрессивного течения в 1983-1995 гг. значительно превышала таковую в 1996-2008 гг. [67]. Двадцатилетняя выживаемость больных хроническим гепатитом D в одном исследовании составляла 86% [65].
Риск развития цирроза печени в итальянском исследовании у больных, инфицированных HDV 1-го генотипа (77% мужчин, средний возраст 30 лет, цирроз печени у 35%), составлял около 4% в год, что значительно выше, чем при моноинфекции вирусами гепатита В или С [65]. В этом же исследовании частота спонтанной сероконверсии HBsAg равнялась 0,25% в год и была выше у больных с длительной ремиссией заболевания и стабильно нормальной активностью АЛТ. Сероконверсия HBsAg, тем не менее, не гарантировала отсутствие осложнений. У 2 из 22 пациентов с сероконверсией отмечено развитие гепатоцеллюлярной карциномы. Последнее, вероятно, отражает длительность печеночного процесса и сопряженных с этим нарушений в геноме гепатоцитов.
У значительной части больных хроническим гепатитом D в момент установления диагноза выявляют стадию цирроза печени. Это, по-видимому, отражает более тяжелое течение заболевания по сравнению с таковым при моноинфекции вирусами гепатита В и С. Так, доля больных с циррозом печени среди пациентов с хронической HDV-инфекцией в крупных исследованиях составляла от 27% до 82% [13,16,42,65,67].
Декомпенсация и развитие печеночной недостаточности остаются главными причинами смертности при хронической HDV-инфекции. В многоцентровом ретроспективном исследовании у 200 больных с компенсированным (класс А по шкале Чайлд-Пью) циррозом печени в исходе HBV- и HDV-инфекции из нескольких клиник Западной Европы развитие печеночной недостаточности и гепатоцеллюлярной карциномы в течение 80 мес было отмечено у 31% и 13% больных гепатитом D, соответственно [68]. Риск декомпенсации, развития гепатоцеллюлярной карциномы и печеночной смерти при HDV-инфекции превышал таковой в сопоставимой группе больных с HBV-инфекцией в 2,2, 3,2 и 2,0 раза, соответственно. Риск декомпенсации был выше у больных пожилого возраста, а также пациентов с гипоальбуминемией и гипергаммаглобулинемией.
В другом крупном исследовании именно развитие печеночной недостаточности, а не гепатоцеллюлярной карциномы определяло выживаемость HDV-инфицированных больных с компенсированным циррозом печени (n=166) [69]. 1, 2 и 5-летняя выживаемость составила 94,3%, 82,5% и 51,5%, соответственно.
В нашем исследовании в течение в среднем 4,1 года (от 1 до 9 лет) умерли 24 из 118 больных хроническим гепатитом D (у 66% имелся цирроз печени). Причины смерти включали печеночную кому (у 12), гепатоцеллюлярную карциному (у 9), кровотечения из варикознорасширенных вен пищевода (у 2) [22].
Данные об онкогенном потенциале HDV противоречивы. В некоторых ранних работах [70,71] не было выявлено достоверного увеличения риска развития гепатоцеллюлярной карциномы при HDV-инфекции по сравнению с таковым при HBV-инфекции. Однако многие авторы склонны объяснять этот факт тем, что больные с HDV-инфекцией часто умирают от прогрессирующей печеночной недостаточности и других осложнений цирроза печени, не доживая до гепатоцеллюлярной карциномы [7]. В исследовании, проведенном в Греции, было показано, что у больных хроническим гепатитом D, которые не погибли от печеночной недостаточности, риск развития гепатоцеллюлярной карциномы в течение 12 лет составил почти 42% [72]. При длительном наблюдении (в среднем 7 лет) больных вызванным HDV циррозом печени в итальянской популяции развитие гепатоцеллюлярной карциномы было отмечено в 25% случаев, риск опухолевой трансформации составлял 2,8% в год [65]. Аналогичные данные приводятся в исследовании из Германии (n=67, длительность наблюдения 7 лет), по данным которого ежегодный риск развития гепатоцеллюлярной карциномы у больных с циррозом печени, вызванным HDV, составил 2,7% [73].
Клинические проявления
Печеночные и внепеченочные проявления хронического гепатита D существенно не отличаются от таковых при заболевании печени, обусловленном вирусом гепатита В [16,42,74,75]. При хроническом гепатите D, как правило, отмечается более высокая активность печеночного процесса по сравнению с таковой при хроническом гепатите В. Обращают на себя внимание значительно более высокая гипергаммаглобулинемия, преимущественно за счет IgG, наличие ревматоидного фактора и криоглобулинов в сыворотке крови при хроническом гепатите D, которые отражают, по-видимому, выраженность аутоиммунных нарушений. HDV, как правило, подавляет активность HBV (лишь у 10-20% больных определяется DNA HBV в сыворотке крови). При этом не было выявлено более высокой активности хронического гепатита D у больных с сохранением виремии HBV [7].
Лечение
Уникальный механизм репликации HDV, отсутствие собственных полимераз и высокий патогенный потенциал делают вирус трудной мишенью для противовирусной терапии. В течение последних трех десятилетий были предприняты неоднократные попытки использования различных препаратов для лечения хронического гепатита D, однако только некоторые из них сохраняют актуальность в настоящее время.
Рекомбинантный интерферонa. Первые попытки противовирусной терапии хронического гепатита дельта относятся к середине 80-х годов [76]. В 10 рандомизированных клинических исследованиях, в которых изучался рекомбинантный ИФН-a, устойчивый вирусологический ответ (УВО) был отмечен всего у 17,4% больных [77]. Гистологическое улучшение и нормализация активности АЛТ в результате лечения ИФНa были достигнуты у 27,2% и 34,8% пациентов, соответственно, однако через 6 месяцев после завершения терапии активность АЛТ оставалась в пределах нормы только у 11,9% больных. В двух клинических исследованиях, в которых сравнивали эффективность высоких и низких доз ИФН-a (9 или 3 млн МЕ 3 раза в нед), был показан отчетливый дозозависимый эффект препарата – УВО был достигнут в 23,3% и 10,0% случаев, соответственно.
В итальянском исследовании 90 больных (72% из них с циррозом печени) получали рекомбинантный ИФН-a в дозе 6-9 млн МЕ [65]. У 72% больных проведен один курс лечения (продолжительностью в среднем 17 месяцев, у 24% – два курса, у 4% – три курса. УВО был достигнут и сохранялся в течение 36 месяцев наблюдения у 25 (27,8%) больных, в том числе у 15 (60%) – на стадии хронического гепатита.
В долгосрочном исследовании американских ученых у пациентов, получавших рекомбинантный ИФН-a в дозе 9 млн МЕ в течение 48 недель, биохимический ответ, достигнутый к концу терапии у половины больных, сохранялся в течение всех 14 лет наблюдения. Особого внимания заслуживает тот факт, что у пациентов со стабильно нормальным уровнем АЛТ и клиренсом анти-HDV IgM и повторно гистологически верифицированным активным циррозом печени (после завершения лечения и через год) в ходе долгосрочного наблюдения было обнаружено полное разрешение фиброза печени [78]. В другом длительном исследовании клиренса HDV и HBV и полного разрешения гистологически верифицированного цирроза печени удалось добиться у пациента, получавшего рекомбинантный ИФН-a в дозе 5 млн МЕ ежедневно в течение 12 лет [79]. Еще в одном наблюдении отмечена элиминация вирусов гепатита В и D при длительном лечении в течение 12 лет малыми дозами интерферона a-2b [80].
Нуклеоз(т)идные аналоги. Важное значение HBsAg для процесса сборки HDV, риск ускоренного прогрессирования фиброза при активной репликации HBV у больных хроническим гепатитом D, а также недостаточная эффективность рекомбинантного ИФН-a оправдывали попытки применения нуклеоз(т)идных аналогов. Однако использование фамцикловира [81], ламивудина [79], рибавирина [82], клевудина [63] и адефовира [83] не позволяло подавить репликацию HDV. На основании этих наблюдений сформировалось мнение, что нуклеоз(т)идные аналоги не эффективны против HDV, а их применение оправдано лишь при наличии активной репликации HBV у больных хроническим гепатитом дельта. Однако следует отметить, что все вышеперечисленные исследования ограничивались наблюдением в течение двух лет, хотя доказано, что нуклеоз(т)идные аналоги при длительном применении способны снижать уровень cccDNA и HBsAg, что лишает HDV субстрата для экспрессии и таким образом может опосредованно ингибировать репликацию вируса. Наглядно продемонстрировать этот механизм позволило наблюдение 16 больных с хроническим гепатитом D и коинфекцией ВИЧ, которым проводилась высокоактивная антиретровирусная терапия (ламивудин в сочетании с тенофовиром и/или эмтрицитабином) в течение 6 лет [84]. У 3 (18,8%) больных были достигнуты авиремия RNA HDV и нормализация уровня АЛТ, у остальных 13 (81,2%) – снижение виремии и активности АЛТ. Успех длительного применения тенофовира в лечении хронического гепатита D вызвал закономерный интерес, и в июне 2009 г. был начато многоцентровое европейское исследование HIDIT II, предполагавшее применение пегилированного ИФН a-2а в комбинации с плацебо или тенофовиром в течение 96 недель у больных хроническим гепатитом D и последующее наблюдение в течение 6 лет. Таким образом, в настоящее время точкой приложения современных мощных нуклеотидных аналогов в лечении хронического гепатита D можно считать случаи c активной репликацией HBV, а эффективность длительного лечения с целью ингибирования cccDNA HBV требует дальнейших исследований с большим количеством больных.
Пегилированный интерферонa-α. В настоящее время пегилированный ИФН-a является препаратом выбора в лечении хронического гепатита D, что обосновывается результатами трех клинических исследований, проведенных во Франции, Германии и Италии [82,85,86]. УВО (авиремия HDV RNA через 24 недели после завершения терапии) был достигнут в среднем у четверти из 64 больных хроническим гепатитом D, получавших пегилированный ИНФ a-2b в дозе 1,5 мкг/кг в течение 48-72 недель. Во французской выборке (14 больных) только авиремия HDV на 24-й неделе терапии была признана достоверным предиктором УВО (р=0,021) [85].
Альтернативные методы лечения. Среди наиболее перспективных альтернативных методов лечения можно выделить ингибитор пренилирования (фарнесилтрансферазы и геранилгеранилтрансферазы) лонафарниб, preS-производный ингибитор входа HBV мирклюдекс-B и полимеры нуклеиновых кислот REP-2139, которые блокируют синтез и секрецию HBsAg. Механизм действия ингибиторов пренилирования заключается в ингибировании присоединения белков фарнесила или геранилгеранила к цистеиновому остатку на С-конце молекулы HDV-L-антигена, что препятствует связи нуклеокапсида HDV с HBsAg, тем самым блокируя сборку полноценного вируса гепатита дельта [87]. Эффективные модели ингибирования пренилирования были продемонстрированы как in vitro [88], так и in vivo на мышах. В этих исследованиях авиремии HDV удавалось достичь уже через 7 дней терапии ингибитором фарнесилтрансферазы [89]. В исследованиях II фазы была установлена эффективность лонафарниба в сочетании с ритонавиром и пегилированным интерфероном-a [90, 91]. В исследовании LOWR-HDV-4 15 больных хроническим гепатитом D получали лонафарниб в дозе 50-75-100 мг в сочетании с ритонавиром 100 мг/сут. К концу лечения уровень RNA HDV снизился в среднем на 1,52 log10 МЕ/мл, а нормализация АЛТ отмечена в 53% случаев [90].
Пилотные исследования показали более выраженное подавление репликативной активности HDV при лечении мирклюдексом-B в сочетании с пегилированным ИФН a-2а [92] или тенофовиром [93].
Наиболее впечатляющие результаты получены при лечении полимером нуклеиновых кислот REP-2139 (внутривенно в дозе 500 и 250 мг 1 раз в нед в течение 30 нед) в сочетании с пегилированным ИФН a-2а. У 7 (58%) и 9 (75%) из 12 больных (без цирроза печени) через год после окончания лечения сохранялись авиремия (RNA HDV
Трансплантация печени
В первых наблюдениях трансплантации печени при гепатите дельта, опубликованных с 1987 г., отмечали высокий риск реактивации HDV, несмотря на комбинированную профилактику с применением иммуноглобулина человека и вакцины против HBV [96]. В последующем стало очевидно, что риск реинфекции после трансплантации печени при HDV-инфекции ниже, чем при моноинфекции вирусами гепатита В и С [97]. Немаловажно также, что в отличие от моноинфекции HBV, частота реинфекции HDV после трансплантации печени оставалась стабильно низкой на протяжении длительного времени – 15,3% в течение 14 лет наблюдения [98].
Длительное время обсуждалась возможность «латентного» течения HDV-инфекции у больных после трансплантации печени при отсутствии маркеров HBV-инфекции. Следует отметить, что большинство исследований, выявивших данный феномен, относились к 1990-м годам, когда тест-системы не позволяли определять минимальные титры вируса. К тому же, по данным Smedile и соавт., вирион HDV, выделенный у больных с виремией после трансплантации печени, был покрыт поверхностным антигеном HBV и содержал в себе полноценный геном HDV, являясь идентичным дотрансплантационному образцу, тем самым исключая возможность репликации вируса при отсутствии HBV [99]. Наличие HDAg в гепатоцитах больных после трансплантации печени при отсутствии признаков репликации HBV, скорее всего, следует объяснять отсроченной элиминацией вирусов, даже на фоне лечения иммуноглобулином человека против HBV [100].
Комбинированная профилактика реинфекции с применением человеческого иммуноглобулина против вируса гепатита В и нуклеоз(т)идного аналога в настоящее время считается оптимальным и общепринятым методом. Монопрофилактика как ламивудином, так и иммуноглобулином человека ассоциировалась с высоким риском реинфекции HBV [101,102]. Таким образом, комбинированная профилактика реинфекции HBV после трансплантации печени позволила достичь сразу несколько целей: