Хвостатое ядро мозга за что отвечает
Хвостатое ядро
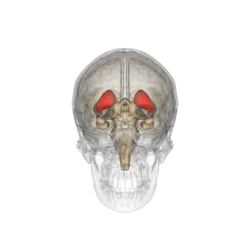
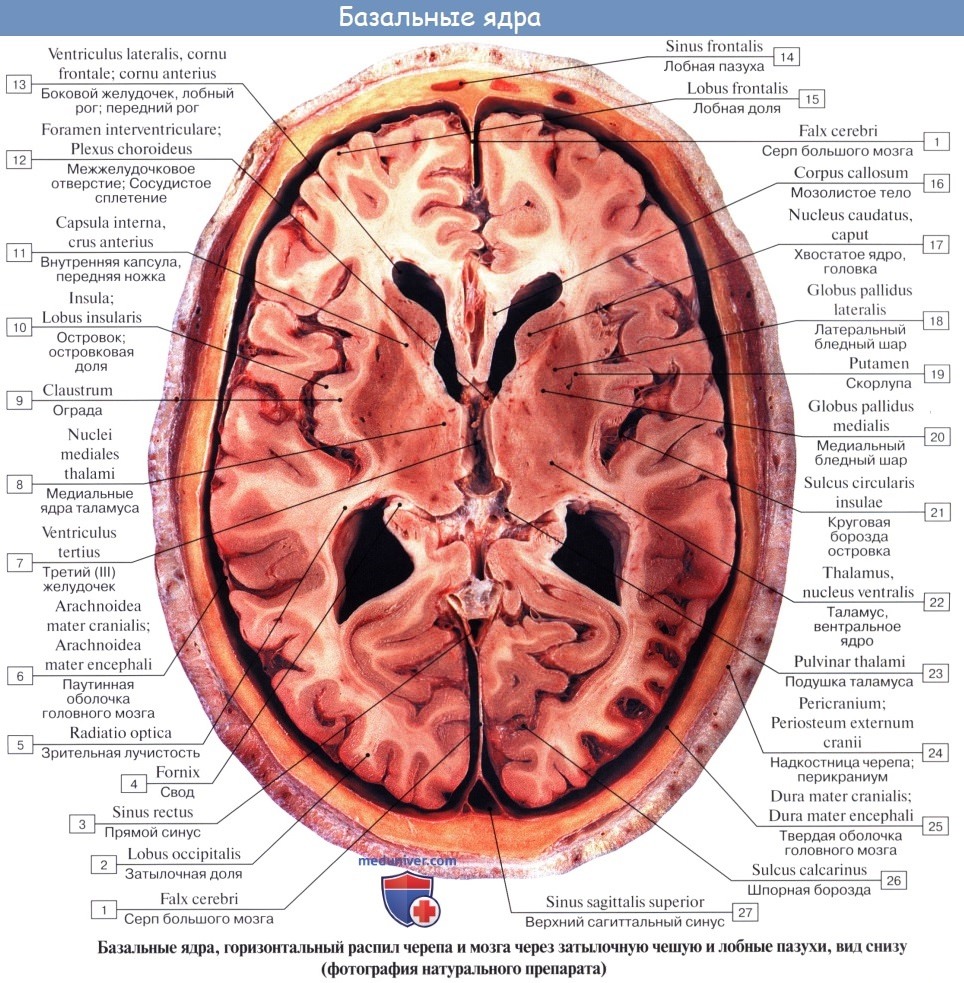
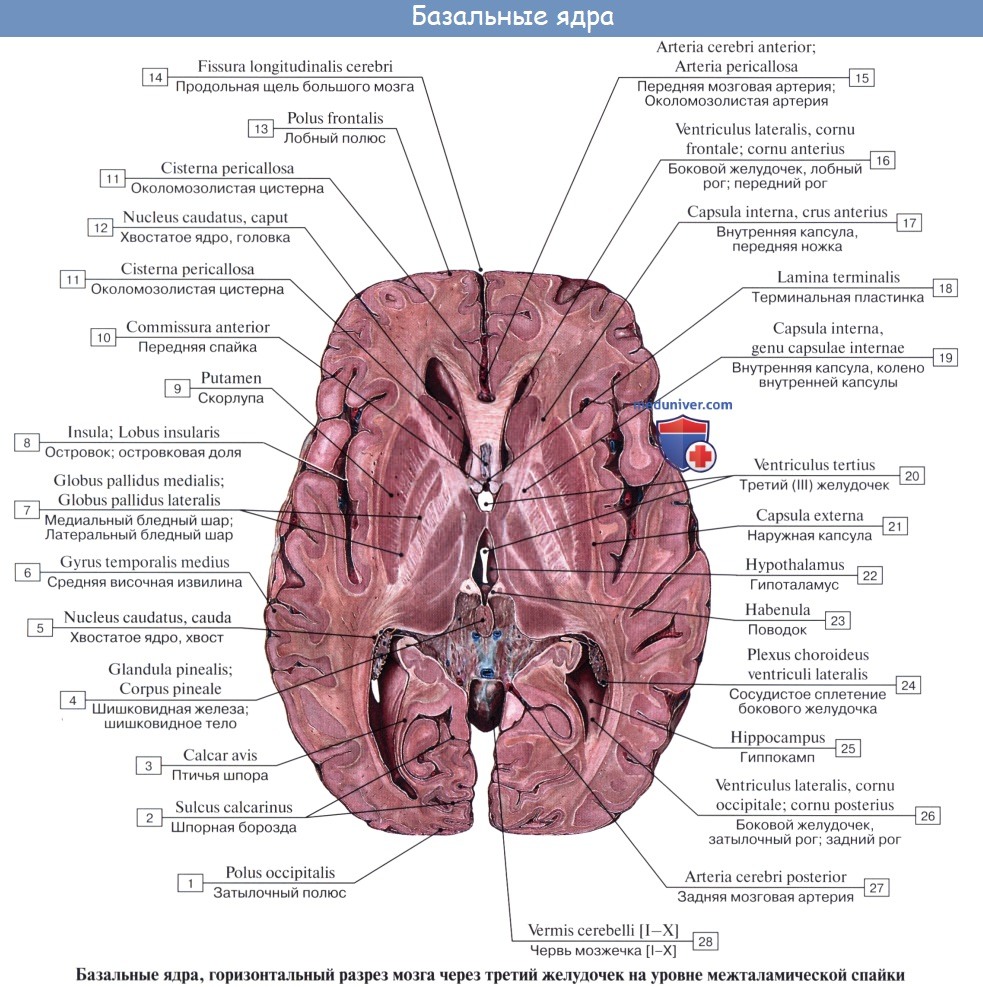
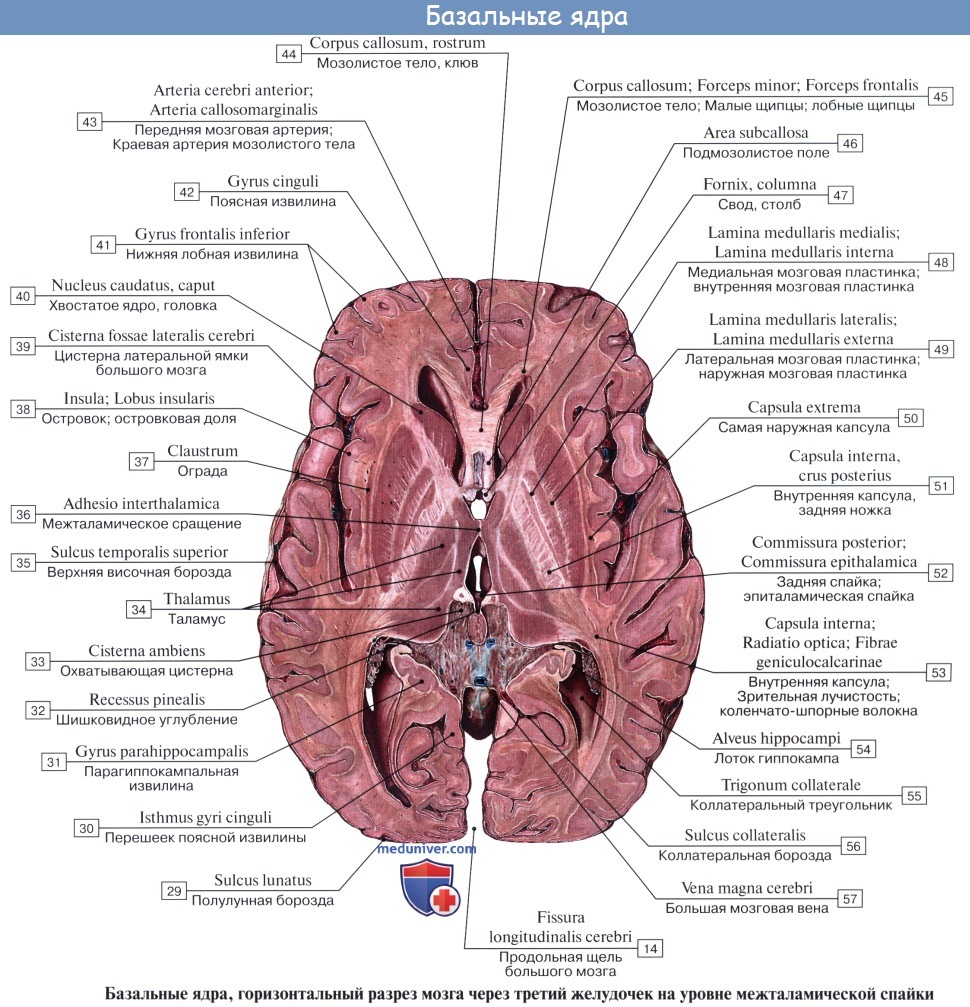
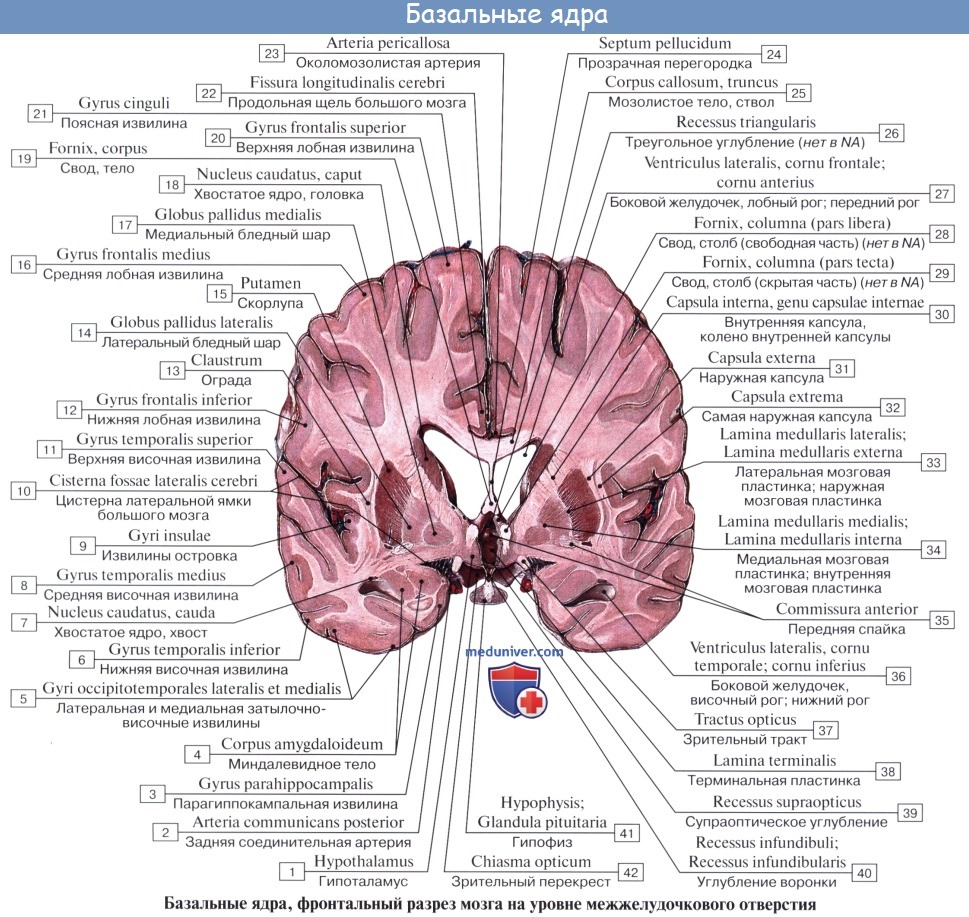
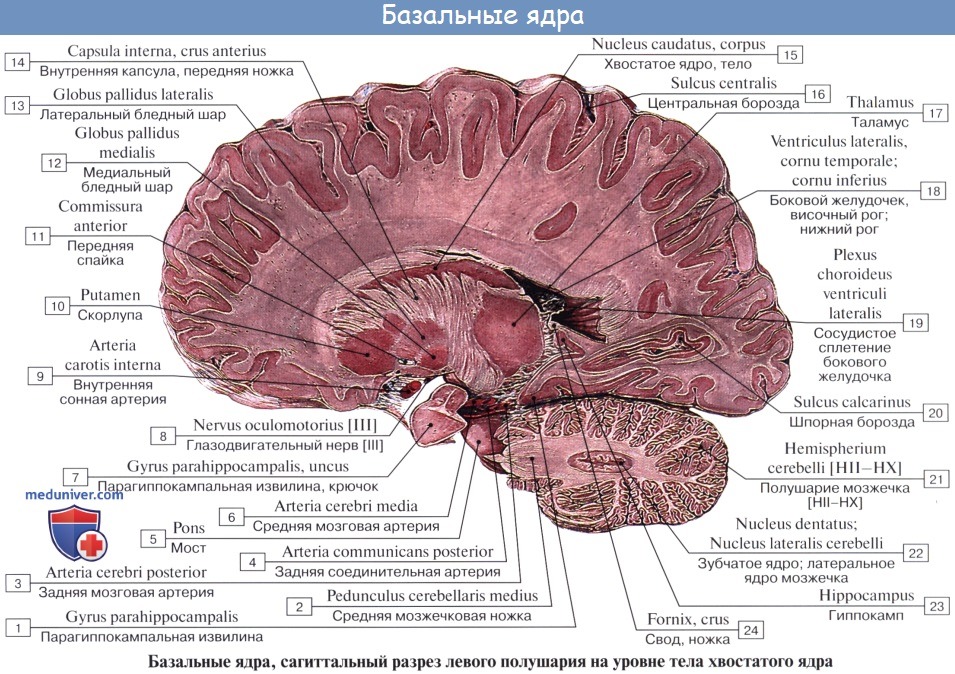
Хвостатое ядро (лат. nucleus caudatus ) — парная структура головного мозга, относящаяся к стриатуму. Расположена спереди от таламуса, от которого (на горизонтальном срезе) его отделяет белая полоска вещества — внутренняя капсула. Передний отдел хвостатого ядра утолщён и образует головку, caput nuclei caudati, которая составляет латеральную стенку переднего рога бокового желудочка. Головка хвостатого ядра примыкает внизу к переднему продырявленному веществу, в этом месте головка соединяется с чечевицеобразным ядром. Суживаясь сзади, головка переходит в тело, corpus nuclei caudati, которое лежит в области дна центральной части бокового желудочка и отделяется от таламуса терминальной полоской белого вещества. Сзади продолжается в хвост — cauda.
Литература
Ссылки
Полезное
Смотреть что такое «Хвостатое ядро» в других словарях:
ХВОСТАТОЕ ЯДРО — (nucleus caudatus), составная часть базальных ядер (полосатого тела) головного мозга. Состоит из малых (15 20 мкм) и крупных (до 50 мкм) клеток, с длинными аксонами. Получает значит, число волокон из коры больших полушарий и направляет свои… … Биологический энциклопедический словарь
ХВОСТАТОЕ ЯДРО — Имеющее вид хвоста, скопление подкоркового серого вещества. Один из компонентов базального ганглия, участвует в контроле подавляющих аспектов регуляции произвольных движений … Толковый словарь по психологии
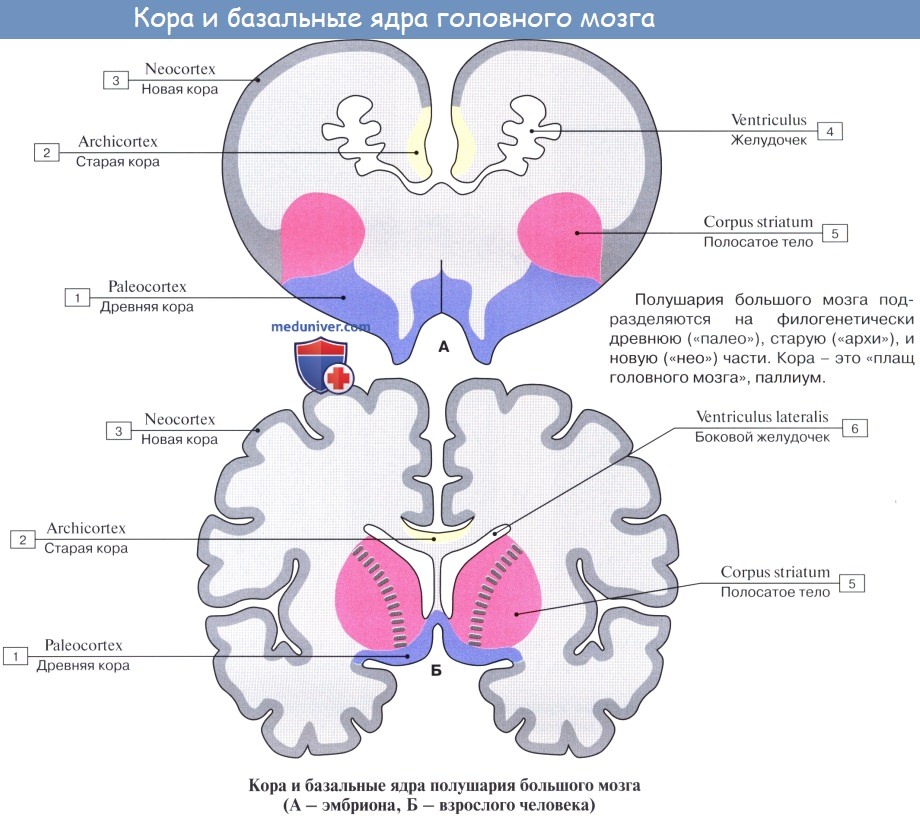
Ядро — I Ядро ( а) ц.н.с. (nucleus, PNA) скопление серого вещества в определенном участке ц.н.с., обеспечивающее выполнение определенных функций. Ядра базальные (n. basales, PNA; син.: ганглии базальные устар., Я. подкорковые) Я., расположенные в… … Медицинская энциклопедия
ядро базальные — (n. basales, PNA; син.: ганглии базальные устар., Я. подкорковые) Я., расположенные в основании полушарий большого мозга; к Я. б. относят хвостатое и чечевицеобразное Я., ограду и миндалевидное тело … Большой медицинский словарь
ядро хвостатое — (n. caudatus, PNA, BNA, JNA) одно из базальных Я., примыкающее к боковому желудочку, отделенное внутренней капсулой от чечевицеобразного Я. и таламуса; вместе со скорлупой чечевицеобразного Я. составляет неостриатум … Большой медицинский словарь
Головной мозг — (encephalon) (рис. 258) располагается в полости мозгового черепа. Средний вес мозга взрослого человека составляет примерно 1350 г. Он имеет овоидную форму из за выступающих лобных и затылочных полюсов. На наружной выпуклой верхнелатеральной… … Атлас анатомии человека
Конечный мозг — (telencephalon), который также называется большим мозгом, состоит из двух полушарий и является наиболее крупным отделом головного мозга. Полушария соединяются друг с другом при помощи мозолистого тела (corpus callosum) (рис. 253, 256). Каждое… … Атлас анатомии человека
У пациентов с ОКР были проведены исследования с множеством структурных методов визуализации, включая компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ) с целью идентификации регионов, участвующих в патогенезе ОКР. КТ-сканирования показало значительное уменьшение объема хвостатого ядра у пациентов с ОКР по сравнению с нормальным здоровым контролем. Однако другие структуры, такие как чечевицеобразные ядра и желудочки мозга, были одинаковыми по размеру в обеих группах, предполагая возможное вовлечение хвостатого ядра в патогенез ОКР. Аналогично, раннее исследование МРТ продемонстрировало значительно меньший объем каудатного ядра у пациентов с ОКР по сравнению с нормальным контролем, но другие области, включая префронтальную кору здесь не имели различий. Другие исследования структурной визуализации при ОКР также предположили наличие аномалий, в основном связанных со схемами ( петлями ) лобно-стриатноо-таламическими. Обзор структурных исследований нейровизуализации при тревожных расстройствах, включая ОКР, показал наличие изменений в хвостатотом ядре, скорлупе (putamen), бледном шаре ( globus pallidus) и полосатом теле.
Методы функциональной визуализации косвенно измеряют уровни активности в определенных областях мозга и используются для определения того, являются ли те или иные структуры вовлеченными в патогенез ОКР аномально активными. Отметим, что функциональные исследования нейровизуализации при ОКР являются более последовательными по сравнению с результатами подобных исследований других психических расстройств. В ранних исследованиях ОКР использовались однофотонные эмиссионные КТ (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ). Эти исследования, а также недавние исследования с использованием функциональной МРТ показали усиленную активацию в областях базальных ганглиев (преимущественно головки хвостатых тел ), переднем цингулуме и орбитофронтальной коре у пациентов с ОКР по сравнению с нормальным здоровым контролем. Итак, пациенты с ОКР могут иметь аномальную метаболическую активность в базальных ганглиях и других связанных с ними областях.
Исследования гексаметилпропиламина оксим- при ОФЭКТ продемонстрировали его повышенное поглощение в префронтальной области медиальной лобной коры, снижение поглощения в левых базальных ганглиях и снижение поглощения в правом хвостовом ядре. В исследовании SPECT с использованием флувоксамина в течение 12 недель было обнаружено, что уровни регионального церебрального кровотока значительно снижаются в левом хвостатом ядре и левой и правой скорлупе как у респондентов, так и у тех, кто не отвечал на терапию. Другое исследование показало, что те, кто отвечал на фармакотерапию показали диффузное снижение регионального церебрального кровотока в префронтальной области по сравнению с исходно высоким уровнем активности этих структур до начала лечения. Хвостатые ядра и префронтальный цингулум показали значительное региональное снижение церебрального кровотока после лечения пароксетином в течение 12 недель. Аналогичные изменения наблюдались также в хвостатом ядре и префронтальной коре после психотерапии. Эти результаты показывают потенциальную обратимость нарушений мозга после лечения пациентов с ОКР. В некоторых исследованиях также основное внимание уделялось плотности рецепторов транспортера и доступности рецепторов для связывания лекарственных средств при ОКР. Исследование SPECT показало снижение связывания переносчиков дофамина у пациентов с ОКР после лечения селективными ингибиторами обратного захвата серотонина (СИОЗС) в базальных ганглиях по сравнению с исходным уровнем, причем изменения в отношении связывания коррелировали с изменениями тяжести симптомов по шкале Y-BOCS. Эти данные свидетельствуют о потенциальной роли дофаминергической системы базальных ганглиях в динамике симптомов ОКР.
Магнитная резонансная спектроскопия ( MRS) позволяет проводить in vivo и неинвазивную оценку биохимии мозга. Основные принципы, лежащие в основе MRS, такие же, как и МРТ, но здесь добавляется дополнительный объем информации путем обнаружения резонансных частот различных метаболитов. Чаще всего 1H-MRS выполняется как один воксель, в котором спектр определяется из конкретной области мозга, тогда как MRS-визуализация обеспечивает метаболические карты. Этот метод предоставляет данные об уровнях N-ацетил-аспартата (NAA, маркер плотности нейронов и их целостности), холина (Cho, маркер клеточной плотности и предшественнике нейротрансмиттера ацетил холина ), креатина (Cr, маркер клеточной энергии ), мио-инозитола (mI, маркер мембранного оборота и миелинизация) и комплекса Glx, образованного Glu и глутамином; оба они участвуют в синтезе ГАМК.
Хвостатое ядро как структура базальных ядер

К ним также относятся скорлупа, бледный шар, ограда, миндалевидное тело. Эти образования выполняют огромное количество функций.
Анатомическое строение, функции хвостатого ядра
В хвостатом ядре выделяют головку, тело и хвост. Оно настолько длинное, что располагается под всеми отделами коры головного мозга и «свёрнуто» в запятую. Такое строение обеспечивает его связь почти со всеми отделами коры.
Ядро и скорлупа находятся в тесных исторических взаимоотношениях с бледным шаром. Эти три образования объединяют в стриопаллидарную систему, хвостатое ядро и скорлупу называют «стриатум», а бледный шар – «паллидум».
Стриатум – это более молодое образование, оно появилось у рептилий, у рыб есть только паллидум. Стриатум тормозит активность нейронов бледного шара, а с бледного шара импульсы идут уже в таламус или субталамическое ядро.
В первые месяцы жизни у ребёнка в регуляции движений ведущую роль играет бледный шар, поэтому новорождённые совершают много лишних хаотичных движений. Позже контроль переходит к стриатуму, моторика становится более чёткой.
Основные входные (афферентные) сигналы хвостатое ядро и скорлупа получают от коры головного мозга, таламуса, чёрной субстанции и других структур, а их выходные (эфферентные) импульсы идут по связям с бледным шаром или чёрной субстанцией.
Далее сигналы проходят в таламус и снова в кору, а также в другие образования. В большинстве этих связей преобладает торможение, а не возбуждение. Именно благодаря торможению обеспечивается надёжность регуляции работы отделов мозга.
В ядро поступает много импульсов от тех областей коры, где объединяются различные виды информации о внешнем мире и положении самого тела. Совместно с корой оно составляет план движения и контролирует его выполнение. Также активность ядра (activity of nucleus caudatus) регистрируется перед началом движения глаз.
Поначалу считалось, что базальные ганглии отвечают только за двигательную активность. Но эти ядра связаны также лобной корой и лимбической системой. А значит, они участвуют в самоконтроле, обучении, принятии решений, возникновении эмоций. И во всех этих процессах свою роль играет ядро.
Нарушения при поражении структуры
Поражение базальных ганглиев может быть вызвано травмой, опухолью, инсультом. Также существует ряд заболеваний мозга, затрагивающих подкорковые образования. В основе некоторых из них лежит установленный генетический дефект или прослеживается наследственная предрасположенность.
Некоторые заболевания мозга, при которых повреждается структура:
| Заболевание и его причины | Что происходит | Основные симптомы |
|---|---|---|
| Болезнь Паркинсона (причины не изучены, существует наследственная предрасположенность) | Гибель нейронов чёрной субстанции, дефицит дофамина в стриатуме | ригидность (повышение тонуса) мышц туловища; замедление движений; постоянный тремор (дрожание); нарушения позы, походки; часто снижение когнитивных функций (умственных способностей), депрессия |
| Болезнь (хорея) Гентингтона (причина — генетический дефект) | Нарушение метаболизма меди с её отложением во внутренних органах Поражаются базальные ганглии и печень, а также роговица, радужка, хрусталик, почки, селезёнка и другие органы | ригидность мышц – нарушения глотания, походки, речи; тремор (дрожание); атетоз (извивающиеся движения); торсионная дистония (неестественные движения и позы) |
| Малая (ревматическая) хорея (причина — стрептококк, наследственная предрасположенность) | Стрептококк вызывает образование антител, которые атакуют нейроны хвостатого ядра и других структур мозга | возникает в детском и юношеском возрасте; быстрые беспорядочные движения рук ног, мышц лица |
Изучаются расстройства психики, связанные с нарушением работы базальных ганглиев. Иногда они становятся первыми симптомами болезни Паркинсона или хореи Гентингтона, когда ещё нет двигательных нарушений.
Психические расстройства при дефектах функции хвостатого ядра:
| Когнитивные | Эмоционально-личностные | Психотические |
|---|---|---|
| Нарушение памяти, внимания, ориентации, речи, мышления | Депрессия, мания, а также их чередование (биполярное расстройство) Обсессивно-компульсивное расстройство (невроз навязчивых состояний) Эмоциональная неустойчивость, вспышки агрессии | Галлюцинации Бред |
Мозг так устроен, что в выполнении даже простого действия участвует сразу несколько его отделов. Поэтому при повреждении одной структуры возникают несколько симптомов. Например, органическое поражение структуры хвостатого ядра в первые дни инсульта приводят к разным последствиям.