Как сделать диоксид кремния
Диоксид кремния, свойства, получение, химические реакции
Диоксид кремния, свойства, получение, химические реакции.
Диоксид кремния – неорганическое бесцветное полупрозрачное вещество, имеющее химическую формулу SiO2.
Краткая характеристика диоксида кремния:
Диоксид кремния (оксид кремния (IV)) или кремнезем представляет собой кристаллы, которые не имеют цвета и характеризуются высокой прочностью, твердостью и тугоплавкостью.
Химическая формула диоксида кремния SiO2
Диоксид кремния содержит два атома кислорода и один атом кремния.
Имеет устойчивость к воздействию кислот и не взаимодействует с водой.
При повышении внешней температуры может взаимодействовать c основными оксидами и щелочами.
Является хорошим диэлектриком (если отсутствуют примеси), так как препятствует прохождению электрического тока.
В природе диоксид кремния в основном встречается в виде минерала кварца. Находится почти во всех горных пародах. Является составной частью литосферы, а так же встречается в живых организмах в небольших количествах.
Модификации диоксида кремния:
Известны следующие кристаллические модификации диоксида кремния с соответствующей известной плотностью (в зависимости от температуры):
Физические свойства диоксида кремния:
| Наименование параметра: | Значение: |
| Химическая формула | SiO2 |
| Синонимы и названия на иностранном языке | кварц |
silicon dioxide (англ.)
silicon (IV) oxide (англ.)
quartz (англ.)
Получение диоксида кремния:
Химические реакции диоксида кремния (оксид кремния (IV)):
SiO2 + C → SiO + CO (t = 1300 °C).
В результате реакции образуется оксид кремния (II) и оксид углерода (II).
В результате реакции образуется оксид хрома (IV) и фторид кремния (IV).
В результате реакции образуется фторид кремния (IV), оксид азота (II) и оксид азота (IV).
В результате реакции образуется оксид серы (IV) и фторид кремния (IV).
В результате реакции образуется хлорид кремния (IV) и оксид углерода (IV).
В результате реакции образуется гидрид кремния (IV), оксид лития и оксид алюминия.
Применение диоксида кремния navichem:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Диоксид кремния
| Диоксид кремния | |
|---|---|
 | |
| Систематическое наименование | оксид кремния (IV) |
| Традиционные названия | кремнезём |
| Хим. формула | SiO2 |
| Рац. формула | SiO2 |
| Температура | |
| • плавления | 1600 °C |
| • кипения | 2950 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 9428-73 |
| Рег. номер CAS | 7631-86-9 |
| PubChem | 24261 |
| Рег. номер EINECS | 231-545-4 |
| SMILES | |
| Кодекс Алиментариус | E551 |
| RTECS | VV7565000 |
| ChEBI | 30563 |
| ChemSpider | 22683 |
| Токсичность | Пыль SiO2 чрезвычайно токсична и канцерогенна при вдыхании, поражает лёгкие, приводит к силикозу |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диоксид кремния (кремнезём, SiO2; лат. silica ) — оксид кремния (IV). Бесцветные кристаллы с температурой плавления +1713…+1728 °C, обладающие высокой твёрдостью и прочностью.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы. В крови и плазме человека концентрация кремнезёма составляет 0,001 % по массе.
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространённая из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии. При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше +573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях.
В природе также встречаются формы — опал, халцедон, кварцин, лютецит, аутигенный кварц, которые относятся к группе кремнезёма. Опал (SiO2·nH2O) в шлифе бесцветен, изотропен, имеет отрицательный рельеф, отлагается в морских водоёмах, входит в состав многих кремнистых пород. Халцедон, кварцин, лютецит — SiO2 — представляют собой скрытокристаллические разновидности кварца. Образуют волокнистые агрегаты, розетки, сферолиты, бесцветные, голубоватые, желтоватые. Отличаются между собой некоторыми свойствами — у халцедона и кварцина — прямое погасание, у лютецита — косое, у халцедона — отрицательное удлинение.
При высоких температуре и давлении диоксид кремния сначала превращается в коэсит (который в 1953 году был синтезирован американским химиком Лорингом Коэсом), а затем — в стишовит (который в 1961 году был синтезирован С. М. Стишовым, а в 1962 году был обнаружен в кратере Бэрринджера (кратере Аризонского метеорита). Согласно некоторым исследованиям, стишовит слагает значительную часть мантии, так что вопрос о том, какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
и плавиковой кислотой:
Эти две реакции широко используют для плавления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идёт об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
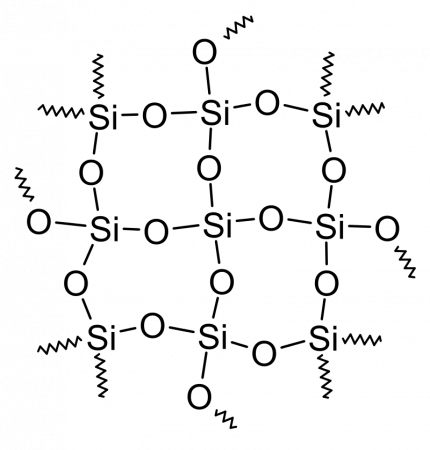
Главным структурным элементом как твёрдого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединён с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры +400…+500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:
кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, в парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), для стабилизации суспензий и линиментов, в качестве загустителя мазевых основ, наполнителя таблеток и суппозиториев. Он входит в состав композиции пломбировочных материалов, снижает гигроскопичность сухих экстрактов, замедляет выход БАВ из различных лекарственных форм; в качестве пищевых добавок и сорбента, а также матриц для создания лекарственных форм с заданными свойствами – так как нет кристаллической структуры (аморфен) – безопасен, а также в качестве пищевой добавки или лекарственного препарата в качестве энтеросорбента Полисорб МП с широким спектром применения с учётом высокой удельной поверхности сорбции (в интервале 300-400 м² ) на 1 г основного вещества.
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и другом.
Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Также диоксид кремния нашёл наиболее широкое применение в шинной промышленности, производстве РТИ и пластмасс, химической промышленности, машиностроении, а в ряде конкретных операций:
Крупные прозрачные кристаллы кварца используются в качестве полудрагоценных камней; бесцветные кристаллы называют горным хрусталём, фиолетовые — аметистами, жёлтые — цитрином.
В микроэлектронике диоксид кремния является одним из основных материалов. Его применяют в качестве изолирующего слоя, а также в качестве защитного покрытия. Получают в виде тонких плёнок термическим окислением кремния, химическим осаждением из газовой фазы, магнетронным распылением.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха и может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Токсичность
Об аморфном диоксиде кремния
Среди твёрдых тел аморфный диоксид кремния отличается самыми низкими теплопроводностью (0,02 Вт/(м • К)), скоростью распространения звука (100 м/с) и диэлектрической проницаемостью. Аморфный кремнезем нагреванием (при температуре свыше 1000 градусов по С) переходит в кристаллическую форму.
Синтетический кремнезем (аморфный диоксид кремния) является незаменимым во многих отраслях современной мировой экономики благодаря тому, что
Таким образом, химическая нейтральность и огромная площадь удельной поверхности (высокоразвитая поверхность) аморфного (некристаллического) диоксида кремния способны придавать новые характеристики различным составам, материалам, продуктам, не меняя их химических свойств. В частности, высокочистый тонкодисперсный синтетический кремнезем с развитой поверхностью может:
использоваться в качестве добавки в масла и смазки для любых узлов и механизмов, где есть металлические пары трения. В этом случае из аморфного диоксида кремния в процессе работы механизмов на поверхности трущихся пар образуются силикатные пленки, которые восстановливают геометрические размеры узлов и механизмов до их первоначального состояния, что в несколько раз снижает степень износа.
быть носителем активных веществ в фармацевтических и косметических средствах;
применяться в роли щадящего абразива в парфюмерии и косметике (пиллинг кожи, сорбирование грязи на коже), при производстве кремниевых полупроводниковых пластин и пр. (как полировальная суспензия);
для выращивания кристаллов больших размеров, которые не могут быть выращены в воде. В этом случае для выращивания используется среда геля кремнезема. Структура геля диоксида кремния предотвращает конвекцию и позволяет равномерно протекать процессу диффузии компонентов;
для приготовления синтетических глинистых материалов. Так, каолин в присутствии аморфного диоксида кремния образуется в гидротермальных условиях при 200–300 °С.
связывать и выводить из организма животных и человека различные токсины, соли тяжелых металлов, радионуклеиды;
использоваться в качестве сырья для производства специальных кварцевых стекол с прозрачностью более 99,5% для оптического излучения с длиной волны 248 нм и более 98% для оптического излучения с длиной волны 193 нм, для производства волоконных световодов;
Так же использование аморфного диоксида кремния ускоряет производственный процесс (за счет упрощения технологических циклов, сокращения времени производственного цикла) и требует меньших энергозатрат. Например, для загущения жидких составов синтетическим кремнеземом достаточно комнатной температуры.
Сфера применения высокочистого аморфного диоксида кремния в мировой экономике с каждым годом расширяется, растет его роль в развитии современных отраслей, в создании новых материалов.













