Как сделать диоксид свинца
Оксид свинца: формула, свойства, метод получения
В этой статье мы разберемся с тем, что собой представляет оксид свинца, покажем его формулу, рассмотрим химические и физические характеристики, а также не забудем рассказать о способах его получения. В общем, эта статья понравится тем, кто хочет или уже разбирается в химии. Ведь свинец встречается повсеместно. Если вы до сих пор не знаете область его применения, то прочитайте статью, чтобы понять весь потенциал этого химического элемента таблицы Менделеева.
Способы его получения
Физические характеристики
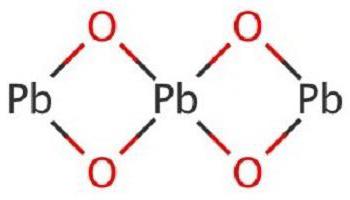
Оксид свинца, формула которого PbO, может находиться в двухвидовых модификациях: высоко- и низкотемпературных. Переходы от высокотемпературной формы к низкотемпературной происходят медленнее, чем в обратном порядке. Вследствие этого элемент может пребывать в метастабильности при комнатной температуре, а в процессе растирания изменять модификационную форму.
Испарение протекает конгруэнтно, чаще всего в формах Pb2O2 и Pb4O4. Также данная группа оксидов является полупроводником. По типу проводимости, в зависимости от состава, но не превышая пределы гомогенности, оксиды бывают дырочными и электронными. По цвету они обычно бывают желтыми, красными и черными.
Химические особенности и свойства
Оксид свинца II
PbO является неорганическим соединением, которое в воде растворяется плохо. Это бинарное вещество в виде кристаллов красного или желтого цвета. В данном соединении свинец проявляет вторую валентность, соответствуя постоянной валентности кислорода. Встречается в природе с примесями, например, в массикоте или свинцовом глёте.
Как получить оксид свинца в промышленности? Его получают путем пропускания кислорода через свинец, нагретый до температуры 600 градусов (2Pb+O2—2PbO), путем нагревания гидроксида свинца при температурах около 100-145 градусов (Pb(OH)2—PbO+CO2), разложением нитратов (2Pb(NO3)2—2Pb+4NO2+O2), прогреванием карбоната свинца (PbCO3—PbO+CO2), разложением диоксидов свинца (2PbO2—PbO+O2) и окислением сульфидов свинца (2PbS+3O2—2PbO+2SO2).
По своим свойствам PbO (II) способен образовать кристаллы в двух модификационных вариантах, которые устойчивы при 489 градусах и выше.
Оксид свинца может проявлять свойства амфотеров при взаимодействии с кислотами (PbO+2HCl—PbCl2+H2O), щелочами (PbO+2NaOH—(400градусов)Na2PbO2+H2O). Способен окисляться, взаимодействуя с кислородом до Pb3O4, а в водной суспензии бромом окисляется до диоксида свинца PbO2. Восстановление до металла происходит при участии оксида углерода, водорода и алюминия. В состоянии влажности поглощает диоксид углерода, образуя при этом основные соли.
Оксид свинца IV
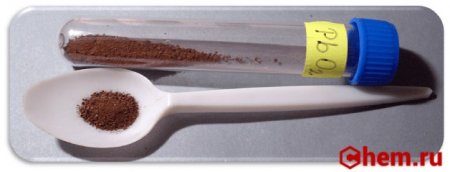
Оксид свинца 4, он же диоксид свинца, имеет формулу PbO2. Является оксидом высших степеней. Как и другие соединения свинца с кислородом является бинарным веществом. Это порошок тёмно-коричневого цвета, довольно тяжелый, которому присущ запах озона. Раньше его можно было встретить под названием пероксид, или перекись свинца.
Добывают PbO2 в промышленности при помощи обработки азотной кислотой сурика свинца, после чего проводится промывка, помещение в вакуум и сушка: Pb3O4+4HNO3—PbO2+2Pb(NO3)2+2H2O.
Применение
Области применения диоксидов свинца самые разнообразные. Оксид свинца 4 находит свое применение, выполняя функцию сиккативов (маслянистых веществ, необходимых для ускорения процесса засыхания красок), катализатора (вещества, необходимого для ускорения протекания химических реакций между соединениями, которые при этом не входят в конечный состав продуктов любых протекающих реакций) и окислителя (вещества, в состав которого входят атомы, способные присоединять к себе свободные электроны в процессе химической реакции, окислитель также можно назвать акцептором).
PbO2 широко используется в свинцово-сернокислотных аккумуляторах, в роли положительных электронных масс в гальванических элементах. Часто, но в малых количествах может применяться как покрытие для электродов, чтобы улучшить электролизный процесс. Диоксид свинца 2 используют при изготовлении суриков, PbO2 можно встретить в аккумуляторах. Оксид свинца широко используется в области изготовления свинцовых стёкол и глазурей. Pb3O4 можно встретить в свинцовых аккумуляторах в качестве замазки и как пигмент для красок против коррозии. Большинство оксидов свинца используют при изготовлении радиотехники, резинотехнической продукции. Также незаменимы они в процессе добычи свинцовых солей при химическом синтезе.
Оксид свинца IV
| Оксид свинца IV | |
|---|---|
| Систематическое наименование | Оксид свинца IV |
| Традиционные названия | Диоксид свинца, двуокись свинца, платтнерит |
| Хим. формула | PbO2 |
| Рац. формула | PbO2 |
| Состояние | твёрдое |
| Молярная масса | 239,1988 г/моль |
| Плотность | 9,38 г/см³ |
| Температура | |
| • плавления | 290 °C |
| Рег. номер CAS | 1309-60-0 |
| PubChem | 14793 |
| Рег. номер EINECS | 215-174-5 |
| SMILES | |
| RTECS | OGO700000 |
| ChemSpider | 14109 |
| Предельная концентрация | 0,01 мг/м³ (в пересчёте на Pb) |
| Токсичность | Высокотоксичен, канцерогенен, мутагенен, сильный окислитель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Встречающееся в старой литературе название «перекись свинца», «пероксид свинца» фундаментально неверно, поскольку в структуре соединения отсутствуют пероксидные группы [-O-O-].
Содержание
Химические свойства
Диоксид свинца существует в двух формах — α-PbO2 (коричневый порошок, тетрагональная сингония) и β-PbO2 (чёрный порошок, ромбическая сингония).
Диоксид свинца обладает сильными окислительными свойствами. Окисляет хлорид-анион до хлора из концентрированной соляной кислоты при нагревании:
Также окисляет соли марганца II в кислой среде до перманганата:
Сера и фосфор при растирании с диоксидом свинца воспламеняются.
Как и многие другие соединения свинца, его диоксид в больших количествах очень токсичен.
Получение
Промышленный способ производства диоксида свинца заключается в обработке свинцового сурикa азотной кислотой и последующей промывке и сушке в вакууме.
Применение
Диоксид свинца находит применение в качестве важного сиккатива, катализатора и окислителя в некоторых химических процессах. Также широко применяется в свинцово-сернокислотных аккумуляторах и гальванических элементах в качестве положительной электродной массы. Небольшое количество диоксида свинца используется в качестве покрытия электродов для электролизных процессов.
Физиологическое действие и токсичность
Нахождение в природе
Диоксид свинца встречается в природе в виде минерала платтнерита.
Пиротехника
Меню навигации
Пользовательские ссылки
Информация о пользователе
Вы здесь » Пиротехника » Хим.Реактивы » как сделать оксиды свинца
как сделать оксиды свинца
Сообщений 1 страница 30 из 33
Поделиться12007-05-31 12:41:49
как максимально просто изготовить оксиды свинца
Поделиться22007-05-31 21:27:54
Зачем готовить, лучше купить
Поделиться32007-05-31 21:36:02
Какие имено оксиды? Напиши формулу.
Поделиться42007-06-02 09:39:29
и не знаю какая фомула просо везде разное говорят я запутался
мне желательно получить сурик (короче окислитель нужен)
Поделиться52007-06-02 16:42:03
Получение PbO:
Pb(OH)2 = PbO + H2O условия реакции: (100-150C)
PbCO3 = PbO + CO2 условия реакции: (выше 315C)
2Pb(NO3)2 = 2PbO + 4NO2 + O2 условия реакции: (200-470C)
2Pb(NO3)2 + 4FeO = 2PbO + 2Fe2O3 + 4NO2 условия реакции: (500-600C)
Получение PbO2:
2PbO + Ca(ClO2) = 2PbO2 + CaCl2 условия реакции: (в разб. NaOH)
PbCl4 + 2H2O = PbO2 + 4HCl
PbCl4 + 4NaOH(разб.) = PbO2 +4NaCl + 2H2O
Поделиться62007-06-02 19:20:39
Сурик на рынке продаётся.
Поделиться72008-03-13 13:48:05
А как PbCl4 получить. 


Поделиться82008-04-07 20:36:35
тот самый сурик который нужен для пирки, можно достать из аккамуляторов.он там в свинцовых пластинах. Нужно красный искать
Поделиться92008-04-07 22:18:51
Хочу сделать трещащие звёзды, а вот свинцовый сурик хрен найдёшь, охота получить хоть грамм 200. С аккамуляторами не охота возится, так как их тоже достать тяжело, так как их сдают на цветмет.
Поделиться102008-04-08 00:30:37
Поделиться112008-04-08 10:30:24
Dimon: Так ты и поищи там куда их здают на цвет мет. У них выберишь один потходящий аккамулятор от мотоцикла. ко мне вот недавно попал аккамулятор в котором свинца почти не осталось, один сурик.
Поделиться122008-04-08 13:48:30
Dimon: Так ты и поищи там куда их здают на цвет мет. У них выберишь один потходящий аккамулятор от мотоцикла. ко мне вот недавно попал аккамулятор в котором свинца почти не осталось, один сурик.
Поделиться132008-04-20 00:11:09
Поделиться142008-04-20 10:59:08
Гранулы залить уксусной эссенцией (можно и столовым уксусом, но тогда концентрация продукта будет меньше). Причем раствор кислоты должен покрывать гранулы только частично, оставляя их часть для контакта с воздухом.
Почему в качестве электродов свинцово-кислотного аккумулятора используется губчатый свинец и двуокись свинца?
Почему в качестве электродов свинцово-кислотного аккумулятора используется губчатый свинец и двуокись свинца?
В свинцовом аккумуляторе в токообразующихпроцессах участвуют двуокись свинца (диоксид свинца) PbO2 (окислитель) положительного электрода, губчатый свинец Pb (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты H2SO4). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу.
При разряде происходит химическая реакция, в результате которой активная масса обоих электродов начнет изменять свой химический состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца – PbSO4), а плотность электролита начнет падать. В результате внутри батареи образуется направленное движение ионов и в цепи потечет электрический ток.
3) Поясните физические процессы заряда и разряда аккумулятора.
При разряде аккумулятора генерируется ток за счет осаждения SO4 на пластинах и активная масса как положительного, так и отрицательного электродов превращается в сульфат свинца, в связи с чем снижается концентрация электролита и постепенно повышается внутреннее сопротивление.
При полном разряде плотность электролита снижается 1,10-1,14 г/см и практически вся активная масса превращается в сернокислый свинец (сульфат свинца), который имеет свойство постепенно кристаллизоваться и терять способность к электрохимическим преобразованиям, после чего батарею практически невозможно восстановить. Этот процесс называется «сульфатацией». Поэтому долгое пребывание в состоянии разрядки губительно для аккумулятора. Чтобы избежать «сульфатации» необходимо как можно быстрее произвести зарядку разряженной батареи.
Физические процессы, происходящие при пуске двигателя, отличаются от процессов при медленном разряде батареи потребителями. При пуске участвует не весь объем активной массы и электролита, а лишь та ее часть, которая находится на поверхности пластин и соприкасающийся с поверхностью пластин электролит. Поэтому, после неудачной попытки запустить двигатель, следует подождать некоторое время для того, чтобы электролит перемешался, плотность его выровнялась, он проник в поры активной массы.
Процесс зарядки батареи состоит в электрохимическом разложении PbSO4 на электродах под воздействием постоянного тока внешнего источника. Процесс заряда полностью разряженной батареи похож на процесс разряда, как бы развивающийся в обратном направлении. Первоначально ток заряда достаточно велик и ограничен лишь способностью внешнего источника генерировать необходимый ток и сопротивлением токонесущих элементов. Теоретически он ограничен только скоростью с которой продукты реакции выводятся из активной зоны. Затем, по мере «растворения» молекул серной кислоты, ток снижается.
4) Почему плотность электролита определяет степень заряженности аккумулятора?
Во время разряда расходуется серная кислота из электролита и одновременно в электролит выделяется вода. Поэтому по мере разряда свинцового аккумулятора уменьшается концентрация серной кислоты, из-за чего плотность электролита понижается. При заряде происходят обратные химические реакции – в электролит выделяется серная кислота и расходуется вода. При этом плотность электролита по мере заряда возрастает. Поскольку при разрядах и зарядах изменяется плотность электролита, то по ее величине можно судить о степени заряженности аккумулятора, чем и пользуются на практике.
Повышенный саморазряд
Саморазряд батарей в эксплуатации считается повышенным, если он превышает 1 % емкости в сутки. Возникает в случаях:
· попадания посторонних примесей в электролит
· утечки тока по смоченной электролитом или загрязненной поверхности аккумуляторов
· замыкания пластин осыпавшейся активной массой
Вредные примеси, особенно металлы, в электролите увеличивают саморазряд, разрушают активную массу и решетки пластин. Крупицы постороннего металла, попадая на отрицательные пластины, образуют с губчатым свинцом и электролитом много местных первичных короткозамкнутых элементов, «паразитные» токи которых разряжают пластины. При этом выделяются пузырьки газа, служащие признаком повышенного саморазряда.
Загрязненный электролит выливают из аккумуляторов, предварительно разрядив током 0,1С20 для перехода металлических примесей с отрицательных пластин в электролит. Затем тщательно промывают несколько раз аккумуляторы дистиллированной водой и заливают свежий электролит, плотность которого соответствует плотности слитого или незначительно превышает ее. Батарею ставят на зарядку, а в конце ее корректируют плотность электролита. Поверхностный саморазряд определяют по отклонению стрелки вольтметра. Один зажим вольтметра соединяют с выводом аккумулятора, второй — с поверхностью крышки или мастики аккумулятора. Для устранения и предупреждения поверхностного саморазряда необходимо регулярно протирать батарею чистой ветошью, смоченной в 10 %-ном водном растворе кальцинированной соды или нашатырного спирта, а затем насухо вытирать чистой тряпкой.
Короткое замыкание пластин
Короткое замыкание пластин в аккумуляторе происходит в результате:
· накопления осадка на дне банки
· образования «наростов» свинца на кромках отрицательных пластин
Признаки короткого замыкания:
· уменьшение плотности электролита и резкое снижение напряжения до нуля при испытании нагрузочной вилкой
· слабое повышение плотности электролита и напряжения при зарядке с одновременным повышением температуры относительно исправных аккумуляторов
Аккумулятор с короткозамкнутыми пластинами подлежит ремонту.
Неисправности моноблоков
Неисправности моноблоков встречаются в виде трещин, отколов, пробоин, которые появляются в результате ударов, тряски и небрежного обращения. Больше всего подвержены механическим повреждениям пластмассовые моноблоки, особенно при отрицательных температурах. Трещины в перегородках бака вызывают короткое замыкание через электролит разноименных пластин соседних аккумуляторов, соединенных между собой межэлементной перемычкой. Пластины разряжаются, при этом плотность электролита в баках с трещиной в перегородке будет меньше, чем в остальных, а суммарная ЭДС двух замкнутых электролитом аккумуляторов будет такой же, как ЭДС одного исправного аккумулятора.
Наличие трещины в стенке моноблока или в перегородке легко обнаружить, если с обеих сторон проверяемой перегородки залить, слабый раствор электролита на 10…15 мм ниже верхних кромок ее и поместить разноименные аккумуляторные пластины, соединенные между собой через вольтметр. Отклонение стрелки прибора свидетельствует о наличии трещины в перегородке.
Стартерный электродвигатель
Классический электростартер автомобиля — это устройство, состоящее из электродвигателя (ЭДВ) постоянного тока с последовательной обмоткой возбуждения, который на время пуска двигателя внутреннего сгорания (ДВС) подключается к аккумуляторной батарее (АКБ) с помощью пускового тягового реле (ПТР). Это же реле посредством рычага с вилкой перемещает по оси стартера муфту свободного хода (МСХ) и тем самым механически сочленяет шестерню на валу стартерного электродвигателя непосредственно с венечной шестерней маховика ДВС.
Конструкция автомобильного стартера, при которой вал электродвигателя соединяется прямо с маховиком ДВС, имеет ряд недостатков. Так, передаточное число главного редуктора, состоящего из венечной шестерни маховика и шестерни МСХ, не может быть достаточно высоким. Ограничения накладываются расчетным размером диаметра маховика, а также числом, размером и прочностью зубцов шестерни МСХ. В такой редукторной паре — соотношение зубцов не может быть более 16—18.
Это приводит к необходимости использовать в стартере такой электродвигатель, у которого обороты якоря «мягко» сочетаются с механической нагрузкой на валу. К таким относятся электродвигатели с последовательной обмоткой возбуждения, обладающие мягкой механической характеристикой (рис. 1, а). Именно такие ЭДВ широко применяются в классических электростартерах.
Конструктивным недостатком ЭДВ с последовательным возбуждением является то, что в нем ток возбуждения, равный току якоря, делает обмотку возбуждения громоздкой, сильно нагревающейся, а магнитную систему статора недостаточно эффективной и с низким КПД. Даже при заданном ограничении на время работы, стартер получается тяжелым и больших размеров. Кроме того, ЭДВ с последовательным возбуждением в режиме холостого хода может пойти «вразнос».
19 Устройство и работа тягового реле стартера
Тяговое реле стартера находится над стартером в прочном соединении с ним. При необходимости оно достаточно просто снимается, но сделать это можно только на демонтированном стартере.
Разные производители предлагают реле в двух вариантах: разборное, которое при необходимости можно подвергнуть диагностике, ревизии и ремонту, и неразборное, которое в случае поломки меняется целиком.
Основными частями реле являются:
корпус;
якорь;
магнит с обмотками (втягивающая и удерживающая);
возвратная пружина;
контакты.
После поворота ключа в замке зажигания, в катушке возникает электромагнитное поле на втягивающей обмотке и якорь, притягиваясь, перемещается в сердечник, который посредством рычага вводит в зацепление с венцом маховика рабочую шестерню бендикса.
Как только сердечник достигает крайнего положения, «втягивающий» стартера замыкает пару контактов, которые называют «пятаками». В этот момент включается удерживающая обмотка и подаётся ток на обмотку мотора, который начинает вращать вал и маховик, находящийся в зацеплении с шестернёй.
С пуском мотора контакты в замке зажигания размыкаются, подача электроэнергии на стартер прекращается, и возвратная пружина возвращает якорь в исходное положение, а вместе с ним и шестерню с обгонной муфтой. Вот, собственно, такой принцип работы втягивающего реле стартера.
20 Маркировка свечей зажигания. Что такое калильное число свечи зажигания?
У каждой свечи зажигания есть своя маркировка, по которой можно узнать обо всех ее особенностях. Правда, у каждой компании своя маркировка свечей зажигания, ведь единой системы, к сожалению, не предусмотрели.
Например, маркировка свечей российского производства абсолютно не имеет ничего общей с маркировкой свечей иностранного производства. Например, можно рассмотреть российскую свечу А-У17ДВРМ10. В ней первая буква обозначает резьбу, а в случае с «А» это М14*1,25. Дефис говорит о том, что опорная поверхность плоская, но если на его месте будет бука «К», то значит коническая.
Немного похожая маркировка свечей зажигания ngk. В свече BC P R 6 E S — 11 две первые буквы «BC» говорят о резьбе и размере ключа. Третья буква «P» обозначает особенности конструкции, а в данном случае это смещенный вперед изолятор и наконечник, а четвертая цифра «R» говорит о наличии резистора. Цифра уже стандартно показывает калильное число свечи, буква «E» длину резьбы, буква « S» конструкцию самого электрода, а последние цифры говорят о свечном зазоре.
А вот маркировка свечей зажигания Bosch слегка отличается от предыдущих, ведь перед калильным числом обязательно две буквы, а после него уже три. Первая буква обозначает резьбу, вторая тип свечи зажигания (с полуповерхностным искровым зазором — L, с сопротивлением для подавления радиопомех — R, для маломощных двигателей — S или для гоночных и спортивных автомобилей — M).
Последняя буква в маркировке свечей зажигания Bosch значит материал центрального электрода. Последняя цифра определяет особенности свечи зажигания.
Также, совершенно не похожая на другихмаркировка свечей зажигания denso. Да, первой всегда идет буква, что обозначает диаметр резьбы и размер шестигранника, но за ней сразу стоит цифра калильного числа. Затем следуют четыре буквы, где первая показывает длину резьбы, вторая тип электрода, а третья — внутреннюю конструкцию, а четвертая — конфигурацию зазора. Ну, а в конце идут цифры, обозначающие искровой зазор.
калильное число свечи зажигания
Кали́льное число́ — величина, характеризующая свечу зажигания, пропорциональная среднему давлению, при котором в процессе испытаний свечи на моторной тарировочной установке начинает появляться калильное зажигание (неуправляемый процесс воспламенения рабочей смеси от раскаленных элементов свечи).
Калильное число – это величина, которая показывает время, по истечении которого, свеча достигнет состояния калильного зажигания. Чем больше калильное число, тем свеча меньше нагревается. Соответственно с малым калильным числом будет «горячая» свеча, а с большим «холодная».
Российская промышленность выпускает свечи зажигания с калильными числами 8, 11, 14, 17, 20, 23 и 26. За рубежом не существует единой шкалы калильных чисел
Калильное число (тепловая характеристика):
Горячие свечи 11-14;
Средние свечи 17-19;
Холодные свечи 20 и более;
Унифицированные свечи 11-20
Почему в качестве электродов свинцово-кислотного аккумулятора используется губчатый свинец и двуокись свинца?
В свинцовом аккумуляторе в токообразующихпроцессах участвуют двуокись свинца (диоксид свинца) PbO2 (окислитель) положительного электрода, губчатый свинец Pb (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты H2SO4). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу.
При разряде происходит химическая реакция, в результате которой активная масса обоих электродов начнет изменять свой химический состав, преобразуясь из губчатого свинца и его двуокиси в сернокислый свинец (сульфат свинца – PbSO4), а плотность электролита начнет падать. В результате внутри батареи образуется направленное движение ионов и в цепи потечет электрический ток.
3) Поясните физические процессы заряда и разряда аккумулятора.
При разряде аккумулятора генерируется ток за счет осаждения SO4 на пластинах и активная масса как положительного, так и отрицательного электродов превращается в сульфат свинца, в связи с чем снижается концентрация электролита и постепенно повышается внутреннее сопротивление.
При полном разряде плотность электролита снижается 1,10-1,14 г/см и практически вся активная масса превращается в сернокислый свинец (сульфат свинца), который имеет свойство постепенно кристаллизоваться и терять способность к электрохимическим преобразованиям, после чего батарею практически невозможно восстановить. Этот процесс называется «сульфатацией». Поэтому долгое пребывание в состоянии разрядки губительно для аккумулятора. Чтобы избежать «сульфатации» необходимо как можно быстрее произвести зарядку разряженной батареи.
Физические процессы, происходящие при пуске двигателя, отличаются от процессов при медленном разряде батареи потребителями. При пуске участвует не весь объем активной массы и электролита, а лишь та ее часть, которая находится на поверхности пластин и соприкасающийся с поверхностью пластин электролит. Поэтому, после неудачной попытки запустить двигатель, следует подождать некоторое время для того, чтобы электролит перемешался, плотность его выровнялась, он проник в поры активной массы.
Процесс зарядки батареи состоит в электрохимическом разложении PbSO4 на электродах под воздействием постоянного тока внешнего источника. Процесс заряда полностью разряженной батареи похож на процесс разряда, как бы развивающийся в обратном направлении. Первоначально ток заряда достаточно велик и ограничен лишь способностью внешнего источника генерировать необходимый ток и сопротивлением токонесущих элементов. Теоретически он ограничен только скоростью с которой продукты реакции выводятся из активной зоны. Затем, по мере «растворения» молекул серной кислоты, ток снижается.
4) Почему плотность электролита определяет степень заряженности аккумулятора?
Во время разряда расходуется серная кислота из электролита и одновременно в электролит выделяется вода. Поэтому по мере разряда свинцового аккумулятора уменьшается концентрация серной кислоты, из-за чего плотность электролита понижается. При заряде происходят обратные химические реакции – в электролит выделяется серная кислота и расходуется вода. При этом плотность электролита по мере заряда возрастает. Поскольку при разрядах и зарядах изменяется плотность электролита, то по ее величине можно судить о степени заряженности аккумулятора, чем и пользуются на практике.