Царская болезнь что это
Что такое гемофилия? (симптомы, диагностика, лечение)
— Павел Александрович, что это за болезнь – гемофилия и какими симптомами проявляется это заболевание?
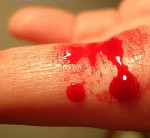
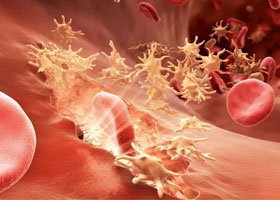
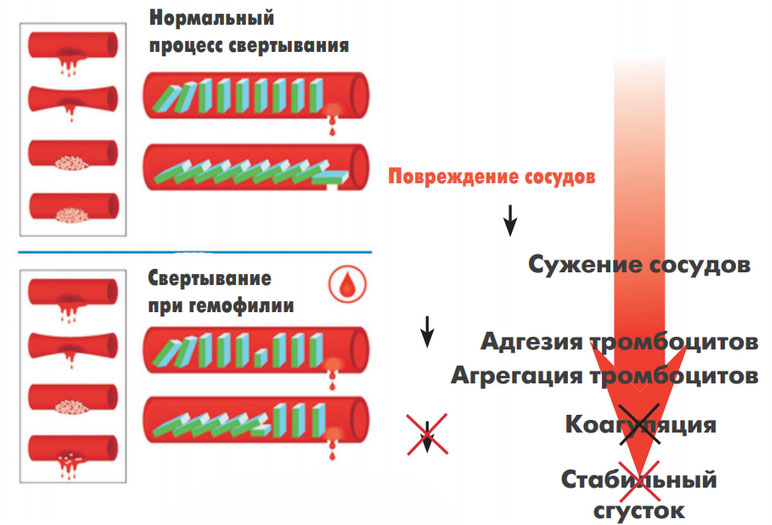
Кровеносные сосуды есть практически во всех органах и тканях человека. При травме и разрыве сосуда кровь вытекает, и для его остановки требуется запуск сложной системы свертывания крови. В результате формируется тромб, который, как пробка, закрывает повреждение.
Если у здорового ребенка без гемофилии при ушибе, образуется маленький «синяк» и система свертывания срабатывает быстро, то у ребенка с гемофилией такая, даже незначительная, травма может привести к образованию более крупного «синяка» и даже гематомы, при которой кровь скапливается в ткани. Такие кровотечения и кровоизлияния могут возникать почти в любом месте организма человека, наиболее опасными из которых являются кровотечения во внутренние органы или головной мозг. Для пациентов с гемофилией также характерны кровотечения в полость суставов, приводящие к гемартрозам и последующему нарушению функции суставов, а также кровоизлияния в мышцы, которые могут приводить к их последующему укорочению, уменьшению и нарушению функции.
— Где у человека находится ген гемофилии?
Ген гемофилии, вне зависимости от формы заболевания (А или В), располагается на Х-хромосоме, которая у мужчин имеется в одном экземпляре, а у женщин — в двух.
— На сегодняшний день сколько в России и мире больных гемофилией?
В мире более 400 000 пациентов, больных гемофилией, и их количество постепенно растет. В России, по данным Минздрава, на февраль 2017 года зарегистрировано более 8 000 больных гемофилией.
— Почему гемофилией страдают только мужчины?
Это не совсем так — в очень редких случаях гемофилией могут страдать и женщины. Это относится к тем случаям, когда у женщины появляется ингибитор к VIII (гемофилия А) или IX (гемофилия В) факторам свертывания. Кроме того, бывают различные генетические нарушения, когда одна из Х хромосом «выключается» или становится неактивна. При этом женщина должна быть носителем мутации в гене VIII или IX фактора свертывания. Однако, это бывает крайне редко.
— Носительница гена гемофилии обязательно родит больного ребёнка?
— Как проводится диагностика гемофилии?
Важнейшим и, наверное, основным на сегодняшний день направлением диагностики гемофилии является коагулологическое обследование или, если проще, исследование того, как сворачивается кровь. На первом этапе проводят общее исследование (скрининговую коагулограмму) и, тем самым, определяют есть ли нарушение со стороны функции белков свертывания. После этого, в зависимости от выявленного нарушения (в случае гемофилии будет удлинено активированное частичное тромбопластиновое время) определяют факторы свертывания крови.
Последнее время активно развивается и генетическая диагностика — это важно т.к. уже есть сведения, что некоторые мутации несут риск появления ингибитора — антитела, или если проще, «аллергии» на собственный и вводимый фактор свертывания. В результате такой «аллергии» терапия концентратом фактора становится неэффективна и контролировать кровотечения становится гораздо труднее.
— Гемофилия может возникнуть спонтанно или то, что ребёнок болен, ясно с момента рождения малыша?
Все зависит от тяжести заболевания. Если болезнь протекает тяжело и активность фактора свертывания крайне низкая, то первые признаки гемофилии могут быть видны уже сразу после рождения. Однако в ряде случаев (особенно при среднетяжелом или легком течении), гемофилию выявляют гораздо позже, и даже в подростковом периоде. Бывает еще и приобретенная гемофилия, о которой я вкратце рассказал ранее.
— Павел Александрович, расскажите, пожалуйста, об основных проблемах больных гемофилией.
Перейти на сайт Всероссийского общества гемофилии
Тем не менее после обеспечения лекарственными препаратами проблемы пациентов не закончились.
Во-первых, у каждого больного с гемофилией, особенно тяжелой, сохраняется риск появления ингибитора. В этом случае контролировать кровотечения становится тяжелее.
Во-вторых, остается целый ряд медицинских проблем – прежде всего, это качество профилактических медицинских осмотров. А дети с гемофилией должны быть самыми здоровыми. Это нужно для того, чтобы создавать минимум условий для возможного кровотечения. Уход за полостью рта, здоровье желудочно-кишечного тракта, опорно-двигательной системы. Список можно продолжать долго.
В-третьих, остается целый ряд социальных проблем. Дети с гемофилией зачастую испытывают трудности при поступлении в детский сад, посещении школы, спортивных секций. Ну и в-четвертых, конечно, многое зависит от семьи и окружения, ведь «болезнь», во многом, в наших головах. Если родители видят своего ребенка глубоким инвалидом, то он и вырастет с соответствующей психологией.
— Современная медицина научилась успешно лечить гемофилию?
— Что вы могли бы сказать о прогнозе жизни при гемофилии?
Благоприятный. Пациенты с гемофилией в развитых странах живут столько же, сколько и пациенты без нее.
— Где в нашей стране больные гемофилией могут получить качественное лечение?
Вопрос не совсем этичный. Обидно будет, если перечисляя, я кого-то забуду упомянуть.
— Какие правила необходимо соблюдать больным гемофилией с тем, чтобы улучшить качество своей жизни?
Я не буду глубоко касаться медицинской стороны вопроса – пациенты с гемофилией обеспечены лекарственными средствами. Повторю: такой пациент должен быть практически абсолютно здоровым человеком как с физической, так и психической стороны. Нужно проходить регулярные медицинские осмотры, заниматься физической культурой (именно культурой, а не спортом), больше двигаться. Профилактическое лечение позволяет это успешно делать. Нужно уметь слушать и слышать, быть активным и не искать виновных. Сейчас есть все средства для того, чтобы пациент с гемофилией жил достойно и качество его жизни соответствовало здоровому человеку. Проводятся школы, встречи пациентов, обсуждения, совместные мероприятия. Люди с гемофилией делятся опытом, знакомятся, помогают друг другу. Главное – не оставаться с болезнью один на один.
Жарков Павел Александрович
Выпускник педиатрического факультета Российского государственного медицинского университета (г. Москва) 2007 года.
В 2013 году окончил аспирантуру по специальности «Педиатрия/Гематология». Защитил кандидатскую диссертацию с присвоением ученой степени кандидата медицинских наук.
В 2016 году окончил докторантуру по специальности «Гематология/Педиатрия» 2016 год.
В настоящее время занимает должность врача-гематолога консультативного отделения ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева.
Является старшим научным сотрудником, руководителем группы изучения гемостаза отдела оптимизации лечения гематологических заболеваний ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева.
Доцент кафедры гематологии и клеточных технологий ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева.
Гемофилия
Гемофилия – наследственная патология системы гемостаза, в основе которой лежит снижение или нарушение синтеза VIII, IX или XI факторов свертывания крови. Специфическим проявлением гемофилии служит склонность больного к различным кровотечениям: гемартрозам, внутримышечным и забрюшинным гематомам, гематурии, желудочно-кишечным кровотечениям, длительным кровотечениям при операциях и травмах и др. В диагностике гемофилии первостепенное значение имеет генетическое консультирование, определение уровня активности факторов свертываемости, ДНК-исследование, анализ коагулограммы. Лечение гемофилии предполагает проведение заместительной терапии: трансфузии гемоконцентратов с факторами свертывания VIII или IX, свежезамороженной плазмы, антигемофильного глобулина и др.
Общие сведения
Гемофилия – заболевание из группы наследственных коагулопатий, обусловленное дефицитом факторов свертывания плазмы крови и характеризующееся повышенной склонностью к геморрагиям. Распространенность гемофилии А и В составляет 1 случай на 10000-50000 представителей мужского пола. Чаще всего дебют заболевания приходится на ранний детский возраст, поэтому гемофилия у ребенка является актуальной проблемой педиатрии и детской гематологии. Кроме гемофилии, у детей встречаются и другие наследственные геморрагические диатезы: геморрагическая телеангиэктазия, тромбоцитопатия, болезнь Гланцмана т. п.
Причины гемофилии
Гены, обусловливающие развитие гемофилии, сцеплены с половой Х-хромосомой, поэтому заболевание наследуется по рецессивному признаку по женской линии. Наследственной гемофилией болеют практически исключительно лица мужского пола. Женщины являются проводниками (кондукторами, носителями) гена гемофилии, передающими заболевание части своих сыновей.
У здорового мужчины и женщины-кондуктора с одинаковой вероятностью могут родиться как больные, так и здоровые сыновья. От брака мужчины, больного гемофилией со здоровой женщиной рождаются здоровые сыновья или дочери-кондукторы. Описаны единичные случаи гемофилии у девочек, рожденных от матери-носителя и больного гемофилией отца.
Врожденная гемофилия встречается почти у 70 % пациентов. В этом случае наследуется форма и тяжесть гемофилии. Около 30% наблюдений приходится на спорадические формы гемофилии, связанные с мутацией в локусе, кодирующем синтез плазменных факторов свертывания крови на Х-хромосоме. В дальнейшем такая спонтанная форма гемофилии становится наследственной.
Классификация гемофилии
В зависимости от дефицита того или иного фактора свертываемости крови, различают гемофилию А (классическую), В (болезнь Кристмаса), С и др.
Тяжесть клинического течения гемофилии зависит от степени недостаточности коагуляционной активности плазменных факторов свертывания крови.
Симптомы гемофилии
У новорожденных детей признаками гемофилии могут служить длительное кровотечение из культи пуповины, подкожные гематомы, кефалогематомы. Кровотечения у детей первого года жизни могут быть связаны с прорезыванием зубов, оперативными вмешательствами (инцизией уздечки языка, циркумцизио). Острые края молочных зубов могут стать причиной прикусывания языка, губ, щек и кровотечений из слизистых оболочек полости рта. Однако в грудном возрасте гемофилия дебютирует редко в связи с тем, что материнском молоке содержится достаточное количество активной тромбокиназы.
Вероятность посттравматических кровотечений значительно возрастает, когда ребенок с гемофилией начинает вставать и ходить. Для детей после года характерны носовые кровотечения, подкожные и межмышечные гематомы, кровоизлияния в крупные суставы. Обострения геморрагического диатеза случаются после перенесенных инфекций (ОРВИ, ветрянки, краснухи, кори, гриппа и др.) вследствие нарушения проницаемости сосудов. В этом случае нередко возникают самопроизвольные диапедезные геморрагии. Ввиду постоянных и длительных кровотечений у детей с гемофилией имеется анемия различной степени выраженности.
По степени убывания частоты кровоизлияния при гемофилии распределяются следующим образом: гемартрозы (70—80%), гематомы (10-20%), гематурия (14-20%), желудочно-кишечные кровотечения (8%), кровоизлияния в ЦНС (5%).
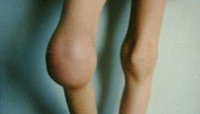
Гемартрозы являются наиболее частым и специфическим проявлением гемофилии. Первые внутрисуставные кровоизлияния у детей с гемофилией случаются в возрасте 1-8 лет после ушибов, травм или спонтанно. При гемартрозе выражен болевой синдром, отмечается увеличение сустава в объеме, гиперемия и гипертермия кожи над ним. Рецидивирующие гемартрозы приводят к развитию хронического синовита, деформирующего остеоартроза и контрактур. Деформирующий остеоартроз приводит к нарушению динамики опорно-двигательного аппарата в целом (искривлению позвоночника и таза, гипотрофии мышц, остеопорозу, вальгусной деформации стопы и др.) и к наступлению инвалидности уже в детском возрасте.
При гемофилии часто возникают кровоизлияния в мягкие ткани – подкожную клетчатку и мышцы. У детей обнаруживаются непроходящие синяки на туловище и конечностях, часто возникают глубокие межмышечные гематомы. Такие гематомы склонны к распространению, поскольку излившаяся кровь не сворачивается и, проникая вдоль фасций, инфильтрирует ткани. Обширные и напряженные гематомы могут сдавливать крупные артерии и периферические нервные стволы, вызывая интенсивные боли, паралич, атрофию мышц или гангрену.
Довольно часто при гемофилии возникают кровотечения из десен, носа, почек, органов ЖКТ. Кровотечение может быть инициировано любыми медицинскими манипуляциями (внутримышечной инъекцией, экстракцией зуба, тонзиллэктомией и др.). Крайне опасными для ребенка с гемофилией являются кровотечения из зева и носоглотки, поскольку могут привести к обструкции дыхательных путей и потребовать экстренной трахеостомии. Кровоизлияния в мозговые оболочки и головной мозг приводят к тяжелым поражениям ЦНС или летальному исходу.
Желудочно-кишечные кровотечения у пациентов с гемофилией могут быть связаны с приемом НПВС и др. лекарств, с обострением латентного течения язвенной болезни желудка и двенадцатиперстной кишки, эрозивным гастритом, геморроем. При кровоизлияниях в брыжейку и сальник развивается картина острого живота, требующая дифференциальной диагностики с острым аппендицитом, кишечной непроходимостью и др.
Характерным признаком гемофилии является отсроченный характер кровотечения, которое обычно развивается не сразу после травмы, а через некоторое время, иногда спустя 6-12 и более часов.
Диагностика гемофилии
Диагностика гемофилии проводится при участии ряда специалистов: неонатолога, педиатра, генетика, гематолога. При наличии у ребенка сопутствующей патологии или осложнений основного заболевания проводятся консультации детского гастроэнтеролога, детского травматолога-ортопеда, детского отоларинголога, детского невролога и др.
Супружеские пары, находящиеся в группе риска по рождению ребенка с гемофилией, должны пройти медико-генетическое консультирование еще на этапе планирования беременности. Выявить носительство дефектного гена позволяет анализ генеалогических данных и молекулярно-генетическое исследование. Возможно проведение пренатальной диагностики гемофилии с помощью биопсии хориона или амниоцентеза и исследования ДНК клеточного материала.
После рождения ребенка диагноз гемофилии подтверждается с помощью лабораторных исследований гемостаза. Основные изменения показателей коагулограммы при гемофилии представлены увеличением времени свертывания крови, АЧТВ, тромбинового времени, МНО, времени рекальцификации; уменьшением ПТИ и др. Решающее значение при диагностике формы гемофилии принадлежит определению снижения прокоагулянтной активности одного из факторов свертывания ниже 50%.
При гемартрозах ребенку с гемофилией проводится рентгенография суставов; при внутренних кровотечениях и забрюшинных гематомах – УЗИ брюшной полости и забрюшинного пространства; при гематурии – общий анализ мочи и УЗИ почек и т. д.
Лечение гемофилии
При гемофилии полное избавление от заболевания невозможно, поэтому основу лечения составляет заместительная гемостатическая терапия концентратами VIII и IX факторов свертывания крови. Необходимая доза концентрата определяется степенью выраженности гемофилии, тяжестью и видом кровотечения.
В лечении гемофилии выделяют два направления – профилактические и «по требованию», в период проявлений геморрагического синдрома. Профилактическое введение концентратов факторов свертывания крови показано пациентам с тяжелой формой гемофилии и проводится 2-3 раза в неделю для предупреждения развития гемофилической артропатии и прочих кровотечений. При развитии геморрагического синдрома требуются повторные трансфузии препарата. Дополнительно используются свежезамороженная плазма, эритромасса, гемостатики. Все инвазивные вмешательства у больных с гемофилией (наложение швов, удаление зубов, любые операции) проводятся под прикрытием гемостатической терапии.
При незначительных наружных кровотечениях (порезах, кровотечениях из полости носа и рта) может использоваться гемостатическая губка, наложение давящей повязки, обработка раны тромбином. При неосложненном кровоизлиянии ребенку необходим полный покой, холод, иммобилизация больного сустава гипсовой лонгетой, в дальнейшем – УВЧ, электрофорез, ЛФК, легкий массаж. Больным с гемофилией рекомендуется диета, обогащенная витаминами А, В, С, D, солями кальция и фосфора.
Прогноз и профилактика гемофилии
Длительная заместительная терапия приводит к изоиммунизации, образованию антител, блокирующих прокоагулянтную активность вводимых факторов, и неэффективности гемостатической терапии в обычных дозах. В таких случаях больному с гемофилией проводится плазмаферез, назначаются иммунодепрессанты. Поскольку больным с гемофилией проводится частое переливание компонентов крови, не исключается риск инфицирования ВИЧ-инфекцией, гепатитами В, С и D, герпесом, цитомегалией.
Легкая степень гемофилии не влияет на продолжительность жизни; при тяжелой гемофилии прогноз ухудшается при массивных кровотечениях, обусловленных операциями, травмами.
Общее описание заболевания
Нормальная свертываемость крови предотвращает и останавливает кровоизлияния в мышцы и суставы (гемартрозы и гематомы), а также кровотечения при порезах и царапинах, которые могут возникнуть при активной повседневной жизни любого человека.
История гемофилии
В 12 веке Абу аль Касим, врач служивший при дворе одного из арабских правителей Испании, первым описал симптомы гемофилии. Он писал о нескольких семьях, в которых дети мужского пола умирали от небольших повреждений.
Современное научное исследование гемофилии ведется с XIX века. Впервые термин «гемофилия» был введен в 1828 году швейцарским врачом Хопфом.
Первой высокопоставленной носительницей гемофилии считается английская королева Виктория. В «наследство» от нее это заболевание было получено царствующими семьями Германии, Испании и России.
Проявления гемофилии
Чем тяжелее гемофилия, тем раньше проявляются признаки кровоточивости. Неизбежные падения и ушибы, которые случаются у ребенка, начинающего ходить, могут вызвать синяки на коже и кровотечения из слизистых оболочек губ и языка.
В возрасте 1-3 лет могут начаться поражения мышц и суставов, с болезненными припухлостями, ограничением движений рук и ног. Обширные гематомы, бывающие опасными, могут вызываться внутримышечными инъекциями.
При болезни Виллебранда наиболее частыми симптомами бывают кровотечения из слизистых носа.
Диагностика гемофилии
Иногда наличие диагноза вызывает сомнения, даже при повышенной кровоточивости у самого больного или наличии у других членов семьи гемофилии. Точная диагностика может быть сделана только измерением уровня соответствующего фактора свертывания крови. Такие анализы проводятся в специализированных лабораториях гематологических центров.
Наследование гемофилии
Гемофилия А и В поражает почти исключительно мужчин, а передается по женской линии. По статистике ВОЗ примерно 1 младенец мужского пола из 5000 рождается с гемофилией А, вне зависимости от национальной или расовой принадлежности. Приблизительно одна треть больных гемофилией А не имела у предшествующих поколений подобных расстройств.
Наследование болезни Виллебранда и гипопроконвертинемии не сцеплено с полом.
нажмите, чтобы увеличить
Тяжесть гемофилии
Гемофилию различают по форме тяжести, обусловленной уровнем фактора свертывания крови.
Гемофилия тяжелой формы. Уровень FVIII или FIX менее 1%. Кровоизлияния в суставы, мышцы и другие органы случаются при минимальных или даже незаметных повреждениях.
Гемофилия средней формы тяжести. Уровень FVIII или FIX 1-5%. Кровотечения возникают из-за явных незначительных повреждений, а также после различных операций и удалений зубов.
Гемофилия легкой формы. Уровень фактора FVIII и FIX 6-30%. Кровоизлияния обычно следуют за крупными повреждениями, хирургическими операциями или удалением зубов. Эта форма может не быть диагностирована достаточно долго.
Тяжесть болезни Виллебранда зависит от её типа и подтипа.
Лечение гемофилии
Сейчас гемофилию А и В лечат концентратами соответствующих факторов свертывания крови. Комплекты поставки препарата включают в себя лиофилизированный (высушенный) фактор свертывания, воду для растворения, а также приспособления для внутривенных инъекций. Таким образом, имеется возможность для лечения пациента вне медицинского учреждений. Этот тип лечения называется домашним.
Гематологи с раннего детства при тяжелой форме заболевания рекомендуют больным гемофилией профилактическое лечение. При таком лечении, инъекции фактора производятся не по факту кровоизлияния (кровотечения), а вне зависимости от него, по специальному расписанию, составленному врачом-гематологом.
В последние годы в России удалось достичь уровня обеспечения пациентов с гемофилией А и В на уровне развитых стран Запада. Благодаря этому, новое поколение больных гемофилией минимально инвалидизировано. Препараты проходят вирусную инактивацию и шанс заразиться известными на данный момент вирусными инфекциями, передаваемыми через кровь, в современных условиях стремится к нулю.
Гемофилия
Общие сведения
Гемофилия — что это за болезнь? Гемофилия (латынь – haemophilia) представляет собой генетически наследуемое заболевание, в основе которого наследственный дефицит (снижение активности) плазменных факторов свертывания крови (VIII — гемофилия А или IX — гемофилия В), проявляющееся геморрагическим синдромом (снижением свертываемости крови, выраженной склонностью к кровоизлияния/кровотечениям). Под фактором свертывания крови подразумевается белок, содержащийся в тромбоцитах/плазме крови, который и обеспечивает свёртывание крови.
В норме уровень активности фактора свертывания крови варьирует в пределах 50-150%.
Тип наследования: Х-сцепленный рецессивный и в подавляющем большинстве случаев (около 70%) прослеживается положительный семейный анамнез. Гемофилия обусловлена мутациями в гене FIX (Xq27) или FVIII (Xq28). Реже встречаются случаи без наличия семейного анамнеза на фоне спорадических мутаций (Википедия). Спорадическая генная мутация может произойти в период овуляции/сперматогенеза в любом поколении и на протяжении нескольких поколений женщин-носителей оставаться скрытой, пока несущая ген гемофилии Х-хромосома случайно не передастся мальчику. При этом, в сперматогенезе мутации в гене возникают в 4-5 раз чаще, чем в оогенезе. То есть, матери в 80-85% спорадических случаев заболевания являются носителями генной мутации, которые возникли в зародышевых клетках отца. Прослеживается сильная корреляция между возрастом отца и риском получения дочерью носительницей от него мутации: средний возраст отца 40 лет.
Гемофилия (несворачиваемость крови) — достаточно редкое заболевание (ежегодные показатели заболеваемости в человеческой популяции варьируют в пределах 7-15 случаев/100 000 населения). При этом, на долю гемофилии А (ГА) приходится 78-88% из общего числа случаев заболеваний. В подавляющем числе случаев болеют гемофилией лица мужского пола. Женщины являются кондукторами (носителями/проводниками) гена гемофилии и передают части своих сыновей это заболевание.
Единичные случаи гемофилии встречаются и у лиц женского пола при наследовании гена от больного гемофилией отца и от носителя гена — матери или у женщин с наличием мутации гена на одной хромосоме при неактивном гене на другой хромосоме (болезнь Шерешевского-Тёрнера). Крайне редко могут быть клинические проявления у некоторых женщин – носителей фактора свертывания крови (FIX)/мутации гена фактора свертывания крови (FVIII).
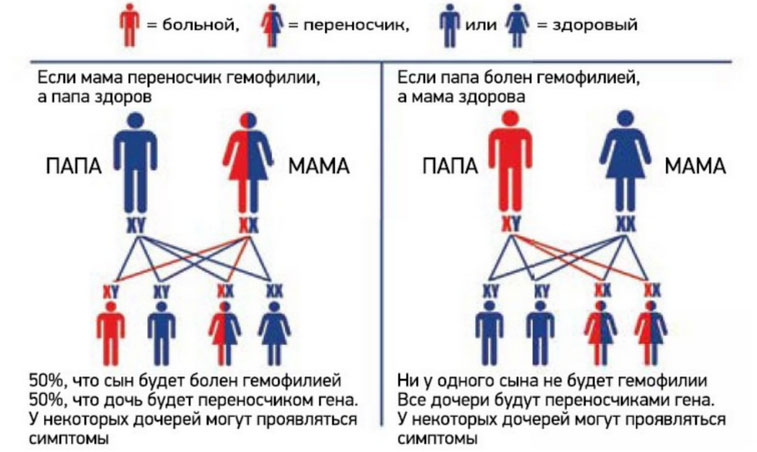
Ниже приведена схема наследования гемофилии, согласно которой вероятность рождения сыновей без признаков или с признаками гемофилии у женщин-носительниц патологического гена и здорового мужчины одинакова (50:50). При этом у некоторых дочерей может присутствовать симптоматика заболевания, а вероятность рождения дочери-переносчика гена составляет 50%. А мужчина больной гемофилией сможет зачать здоровых детей с женщиной не носительницей патологически измененного гена. При этом все рожденные дочери будут переносчиками заболевания.
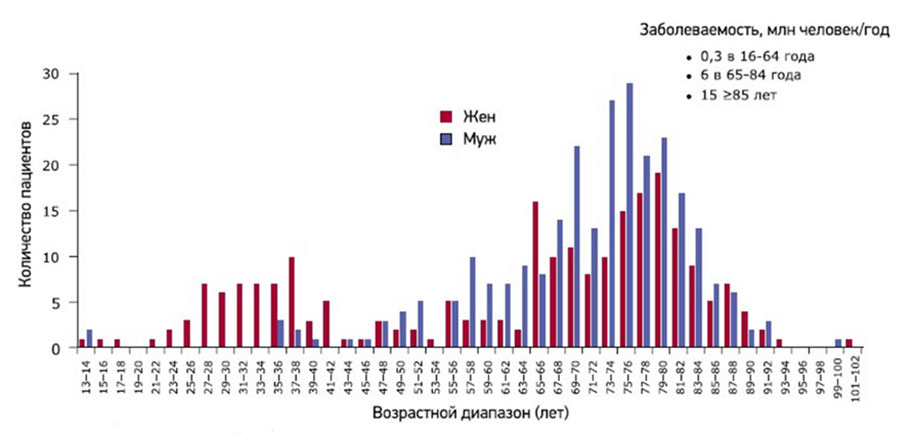
Кроме генетически обусловленных (наследственных) форм выделяют приобретенные формы гемофилии (болезнь Розенталя), в основе которых дефицит фактора ХI и которая относится к группе редких коагулопатий. Приобретенные формы гемофилии встречаются крайне редко и в основе их развития — появление антител к факторам свертывания, что характерно для аутоиммунных/миелопролиферативных заболеваний, гиперчувствительности к лекарственным препаратам, заболеваниям кожи и беременности. Приобретённая гемофилия наиболее распространена в возрастном периоде 69-80 лет, однако среди женщин патология часто встречается в репродуктивном возрасте. В целом распространенность приобретенной гемофилии составляет 1,5 случая/1 млн населения /год (рис. ниже).
Патогенез
В основе патогенеза гемофилии лежит дефицит плазменных факторов (VIII, IX, XI) свертывания крови, что вызывает нарушение процесса ее свертывания во внутреннем коагуляционном звене гемостаза (образование тромбопластина) и обуславливает гематомный отсроченный тип кровоточивости. Первый этап свертывания крови — это процесс тромбопластинообразования, который нормально протекает лишь при условии достаточной концентрации факторов VIII и IX. Его продолжительность составляет 12-15 минут, а последующий процесс свертывания крови после появления активного тромбопластина в крови происходит практически мгновенно.
Именно нарушение этой плазменной фазы гемостаза обуславливает характерный для гемофилии тип кровоточивости. Кровотечение сразу после травмы может отсутствовать, поскольку первичный (сосудисто-тромбоцитарный) гемостаз функционирует нормально, что и обеспечивает формирование первичного тромба.
Поскольку первичный тромб окончательную остановку кровотечения обеспечить не в состоянии, страдает вторичный гемостаз — формирование фибринового (окончательного) тромба, то кровотечение возобновляется и возникает внезапно через несколько часов (на следующие сутки) после хирургического вмешательства/травмы. При этом, несмотря на его длительность нарастание объема кровопотери отсутствует, что и является его особенностью. Ниже на рисунке схематически приведен патогенез гемофилии.
Классификация
Различают несколько типов заболевания:
Классификация гемофилии А и В — по степени тяжести заболевания, определяемая активностью FVIII и FIX, в соответствии с чем выделяют 3 формы тяжести:
Причины
Непосредственной причиной развития гемофилии А/В является генные мутации Х-хромосомы в зоне длинного (q27-q28) плеча. Около 70-75% больных имеют геморрагический синдром в семейном анамнезе (у родственников), а у 25-30% наследование заболевания в семейном анамнезе не прослеживается, то есть, в Х-хромосоме имеет место спонтанная мутация генов.
Выявлено, что ген, который кодирует процесс синтез фактора VIII, расположен в локусе Xq 28 на длинном плече Х-хромосомы и состоит из 25 интронов/26 экзонов. По размеру ген фактора VIII насчитывает 186 тыс. парных оснований ДНК. При этом мутации в этом гене могут происходить по разному типу: делеции, дупликации, включения новых оснований, сдвиги рамки считывания. В большинстве случаев наблюдается инверсия последовательности нуклеотидов, в частности, инверсии в гене VIII фактора интрона 22, что обуславливает низкий уровень этого фактора, а также вызывает тяжелые фенотипические проявления.
Ген фактора IX расположен на длинном плече X-хромосомы в локусе Xq 27 и включает 7 интронов/8 экзонов. При этом, мутации в гене фактора IX происходят в 7-10 раз реже, чем в гене фактора VIII. При тяжелой форме гемофилии часто происходят два вида генных мутаций.
Симптомы
Степень клинических проявлений и нарушений свертывания крови зависит от уровня активности фактора в крови, но в клинической практике прямая корреляция между клиническим фенотипами заболевания и лабораторными данными существует не всегда. Клинические симптомы гемофилии манифестируют геморрагическим синдромом, проявляющегося в виде гемартрозов, на долю которых приходится 70-80% проявлением гемофилии; гематом и кровотечений. Типичным является частое рецидивирование геморрагического синдрома, а его отличительной особенностью — неадекватность тяжести травмы.
Гемартрозы
Гемартрозы (кровоизлияния в суставы) являются типичным проявлением заболевания, а источником кровотечений в суставе является преимущественно суставная сумка. При отсутствии своевременного адекватного лечения, кровотечение может продолжаться до полного наполнения сустава кровью. У детей раннего возраста кровоизлияния в суставы встречаются редко. Однако, по мере взросления ребенка и повышения двигательной активности, возрастания нагрузки на суставы их частота резко возрастает. Наиболее часто отмечаются гемартрозы коленных (48%), локтевых (24%) и голеностопных (16%) суставов, значительно реже поражаются плечевые/тазобедренные (5-8%) и мелкие суставы стоп/кистей. Случаи поражения суставов позвоночника встречаются крайне редко. Как правило, в зависимости от тяжести заболевания/возраста пациента поражаются несколько суставов (от 1 до 8-10).
Кровоизлияние в суставы развивается преимущественно без видимых причин. Характерным является быстрое увеличение сустава в объеме, локальная гиперемия/гипертермия, резкая болезненность и напряженность кожи над суставом. Ниже на рисунке приведена клиническая симптоматика гемартроза, в зависимости от объема кровоизлияния в полость сустава.
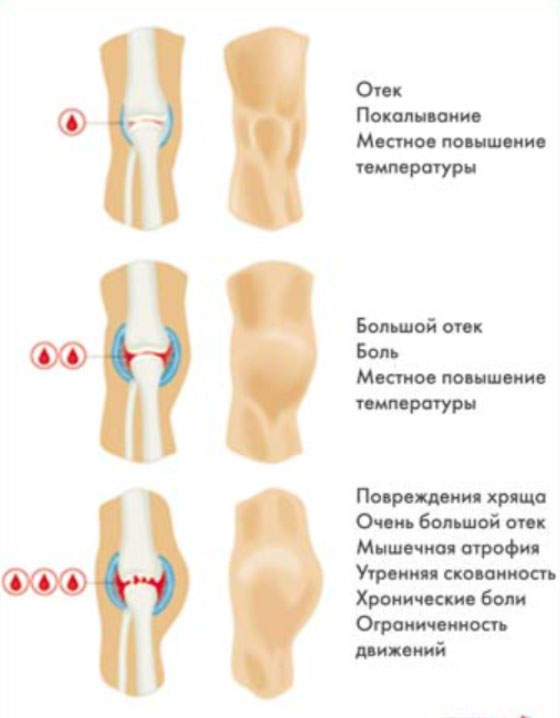
При частых кровоизлияниях в сустав и отсутствии скорой/адекватной заместительной терапии развивается гемофилическая артропатия, представляющая собой стойкое деформирующее изменения суставов.
Постепенно артроз поражает хрящ и капсулу сустава, а позже патологический процесс распространяется на мягкие ткани/прилегающие кости. Воспаленная синовиальная оболочка постепенно утолщается, а местные сосуды легко повреждаются, что и является источником повторных кровоизлияний. Развивающийся фиброз капсулы/окружающей ткани деформирует сустав и резко ограничивает его подвижность. Под воздействием протеолитических ферментов разрушается хрящ сустава (дегенерация хряща), а в прилегающей кости развивается остеопороз с образованием кист, наполненных студенистой жидкостью.
Мускулатура, окружающая сустав, постепенно атрофируется, что увеличивает нагрузку на сустав. При гемофилической артропатии различают следующие формы гемартроза: острый гемартроз (первичный, рецидивирующий); постгеморрагический синовиит (острый, подострый, хронический); деформирующий остеоартроз; анкилоз (фиброзный/костный). Как правило, раннее возникновение гемартрозов способствует устойчивому поражению поверхностей суставов и его компонентов, а развитие множественных артропатий приводит к глубокой инвалидизации пациента (рис. ниже).
Гематомы
Еще к одному характерному проявлению гемофилии относятся гематомы различной локализации (межмышечные, подкожные, поднадкостничные, ретроперитонеальные, субсерозные и др.), для которых характерна выраженная тенденция к распространению. Излившаяся кровь длительный период остается жидкой, что способствует ее легкому проникновению в прилегающие ткани и быстрому распространению вдоль фасций. Процесс рассасывания гематом медленный.
Наибольшую угрозу для жизни пациента представляют ретроперитонеальные гематомы, симптомы которой напоминают клинику острого аппендицита. Причиной частичной непроходимости кишечника могут быть субсерозные гематомы, которые зачастую ингибируют стенку и содержимое прорываться в просвет кишечника. Также, обширные гематомы в ряде случаев могут сдавливать крупные артерии/нервные стволы, вызывая расстройства кровообращения и нарушение чувствительности. Более того, сжатие гематомой кровеносных сосудов может вызывать некротизирование тканей и образование «гемофилических псевдоопухолей».
Клинически процесс формирования гематом может сопровождаться как местными (болезненность, ощущение жара, покалывание/онемение, ограничения движения за счет мышечного спазма), так и общими симптомами (слабость/недомогание, нарушении аппетита/сна лихорадка при рассасывании гематомы). Также, при излитии крови в большом объеме может развиваться анемия.
Кровотечения
У больных гемофилией кровотечения являются легко и часто встречаемыми, они обильны и длительны, могут происходить в любое время суток. Частота кровотечения во многом определяется тяжестью гемофилии. Так, частота эпизодов кровотечений у больного с тяжелой формой гемофилии А может варьировать в пределах (15-35 раз/год и более). У пациентов с среднетяжелой/легкой формой гемофилии А и В кровотечения развиваются значительно реже. Традиционные меры остановки кровотечения эффекта не дают.
Выделяют наружные кровотечения (из слизистых оболочек ротовой полости, десен, носа) встречающиеся в 75% случаев и внутренние кровотечения (почечные, желудочно-кишечные, кровоизлияния в головной мозг/мозговые оболочки), которые встречаются относительно редко и возникают преимущественно после различных инструментальных манипуляций/в результате травм. Длительные почечные кровотечения встречаются у 14-30% пациентов с тяжелой формой гемофилии, при этом, гематурия чаще возникает спонтанно и может привести к развитию анемии. Как правило, развитие внутреннего кровотечения у большинства больных сопровождается острой болью. Выделяют две категории кровотечений, критерием которых служит степень опасности для жизни: жизнеугрожающие и обычные.
К жизнеугрожающим кровотечениям относятся кровотечения в жизненно важные органы. Их частота варьирует в пределах 5-10%, однако они часто являются причиной параличей/летальных исходов (кровоизлияния в спинномозговой канал, мозговые оболочки, головной мозг, в ЖКТ). Особую опасность представляет ретрофарингеальное кровотечение, поскольку за счет скопления в верхних дыхательных путях сгустков крови может спровоцировать удушье. Как правило, тяжесть кровоизлияния не соответствует интенсивности/обширности травмы, а кровоизлияния могут возникать отсрочено (от 6-12 часов до суток) после травмы в зависимости от степени дефицита фактора. Это обусловлено тем фактом, что в основе первичной останови кровотечения лежит сосудисто-тромбоцитарное звено гемостаза, функции которого при гемофилии не нарушены.
Анализы и диагностика
Установление диагноза гемофилия проводится на основе изучения семейно-наследственного анамнеза, физикального обследования (наличие у пациента проявлений кожного геморрагического синдрома в виде множественных гематом/экхимозов различной степени выраженности), клинических проявлений (поражения суставов в виде отека/деформации, локального повышения температуры кожи, нарушения объема движений/подвижности суставов, гипотрофии мышц конечности и др.), а также данных лабораторного коагулологического обследования (активированное частичное тромбопластиновое время, тромбиновое время, протромбиновое время, время свертывания крови, кровиконцентрация фибриногена по Клауссу, снижение уровня фактора VIII/IX и др.). Также может проводится молекулярно-генетическое исследование.
С целью оценки тяжести поражения суставов и состояния органов, в которых отмечаются профузные кровотечения (почки, желудок, кишечник) проводят рентгенологическое исследование, УЗИ/КТ/МРТ суставов/мягких тканей, органов грудной клетки и брюшной полости, мочевыводящих путей, головного мозга, эзофаго-гастро-дуоденоскопию/колоноскопию.
Наиболее часто диагноз гемофилии устанавливается в раннем детском возрасте, когда ребенок начинает ходить и родители отмечают, что у него кровь не сворачивается.
Средний возраст постановки диагноза «гемофилия», тяжелая форма составляет 9 месяцев; при среднетяжелых формах — 22 месяца, а легкие формы заболевания диагностируют у детей в более позднем возрасте, преимущественно после инвазивных вмешательств/удаления зубов. Скрининговым тестом нарушений свертывающей системы является время свертывания и при удлинении этого показателя проводятся исследования уровня факторов в крови, на основании чего и устанавливается диагноз «гемофилии» и определяется тяжесть заболевания.
Лечение
Гемофилия — серьезное и неизлечимое заболевание, но своевременно начатое правильное лечение позволяет избежать инвалидности и преждевременной смерти. Лечение гемофилии заключается в заместительном применении концентратов отсутствующих у больного факторов свертывания. Это могут быть препараты, приготовленные из плазмы доноров (концентрат FVIII, FIX, VIII+vWF), или рекомбинантные концентраты (Адвейт, Когенэйт ФС, Рефакто АФ, Иннонафактор, НовоСэвен, Бенефикс, Нувик, РеФакто АF). Причем предпочтений препаратов той или иной группы нет. Все они вводятся внутривенно капельно. Лечение вне сомнения улучшает состояние больного: предотвращает кровотечения и спонтанные кровоизлияния, останавливает прогрессирование костно-суставных изменений.
Возможны следующие варианты лечения больного:
Профилактическое заместительное лечение концентратами факторов — необходимое условие для больных с тяжелой гемофилией и средней тяжести. Это основное направление у больных с 2 до 17 лет (весь период роста больного). При тяжелом течении такое лечение продолжается долго и зависит от возраста. Профилактическое лечение начинается с раннего детства после первого кровотечения или гемартроза. У взрослых больных чаще всего применяется лечение «по требованию» предупреждение для предупреждения опасных кровотечений.
Профилактическое лечение разрабатывается с учетом особенностей больного: подбирается тип фактора, доза, частота введения, чтобы минимизировать риск кровотечений и продолжительность курса. Первичная профилактика эффективна для предотвращения осложнений со стороны суставов и замедляет прогрессирование заболеваний суставов. Поскольку введение препаратов предполагается частым и постоянным, больным устанавливаются венозные катетеры иногда центральный венозный катетер.
В режиме профилактики внутривенно капельно вводятся:
Профилактическое введение проводят утром для того, чтобы максимальный уровень фактора был днем в период активности больного. Родственники больных обучаются проведению инфузии в домашних условиях и правильному уходу за венами. Поддержание фактора свертывания на уровне 2-5% является достаточным для многих больных и позволяет вести нормальную жизнь. Постоянная заместительная терапия нуждается в лабораторном контроле (определяется активность дефицитного фактора и тест восстановления его).
Использование низкой дозы или несоблюдение режима снижает эффективность лечения и ухудшает состояние. Наоборот, очень высокая доза вызывает развитие тромбозов. Вторичная профилактика бывает ранней (если проводится с 5 лет) и поздней (если проводится с 10 лет). Она замедляет развитие артропатий и обеспечивает качественную деятельность и активность. При различных состояниях (почечное кровотечение, гемартроз, кровоизлияние в мышцы, кровоизлияние в мозг, кишечные кровотечения) важно незамедлительное проведение заместительной терапии — с первого часа после травмы или признаков кровоизлияния, чтобы не допустить значимых кровопотерь.
В лечении легкой степени гемофилии А при различных ситуациях эффект может оказать гемостатическая терапия:
Данные препараты можно применять совместно с заместительной терапией при удалении зуба, лечении ран и даже при проведении операций на паренхиматозных органах.
Перспективным является применение моноклонального антитела эмицизумаб (препарат Гемлибра), который имитирует функции недостающего фактора VIII. Он связывает фактор IXа c X, восполняя отсутствующий фактор. Рассматривается как профилактический препарат для больных гемофилией А с ингибиторами к фактору и при их отсутствии. Вводится подкожно в разных режимах — один раз в неделю, в две или четыре недели. В странах ЕС и России Гемлибра разрешена только для больных гемофилией А ингибиторной формы.
Ситуация при лечении ухудшается, если у больного образуются ингибиторы факторов свертывания, что является тяжелым осложнением, возникающим при лечении. Чаще всего ингибиторы появляются при тяжелой форме гемофилии А (до 30%), а при тяжелой форме гемофилии В они обнаруживаются только у 3-5% больных. Ингибитор чаще всего развивается в первые дни введения фактора (50-100 дней) или после введения большого его количества при операции. Ингибиторы — это антитела, вырабатываемые иммунной системой, которые связываются с введенным фактором и блокируют его действие. В результате этого достаточный уровень фактора не достигается и контролировать кровотечение становится невозможным. Больным приходится повышать дозу и частоту введения, но и это оказывается неэффективным. В связи с этим первые 20 дней нужно определять уровень ингибитора раз в 5 дней, в последующем — раз в 10 дней, а до 150 дня введения — 2 раза в год.
Больным проводится подавление ингибиторов иммуносупрессивными препаратами (Преднизолон, Азатиоприн или Мабтера). Для остановки кровотечений применяются препараты шунтирующего действия: