Цифран с алкоголем что будет
Чем нельзя запивать и заедать таблетки?
В период новогодних праздников многим, как и в обычное время, нужно принимать лекарственные препараты. Однако, важно знать, что многие медикаменты несовместимы с определенными напитками или продуктами, в том числе – с праздничного стола.
Не употребляйте алкоголь во время приема этих лекарств
Более 100 лекарств взаимодействуют с вином, пивом, шампанским и крепкими напитками, вызывая проблемы, начиная от тошноты и головных болей и заканчивая опасными для жизни состояниями, такими как: внутреннее кровотечение и затрудненное дыхание [1].
С некоторыми лекарствами даже один глоток может представлять опасность. И вам может потребоваться воздержаться от алкоголя за день до или после приема определенных лекарств. Поэтому, если вы пьете, поговорите со своим врачом или фармацевтом, прежде чем принимать какое-либо лекарство, особенно эти:
Препараты и пища, напитки
Есть ряд напитков и продуктов питания, которые не рекомендовано совмещать с приемом лекарств, так как это может грозить развитием неблагоприятных взаимодействий между компонентами препаратов и пищи, напитков. Это может приводить к усилению токсичных эффектов или нейтрализации эффекта препарата. Это особенно важно для препаратов категории «лонг» – с медленным высвобождением. Поэтому, предварительно нужно уточнять у врача, с чем нельзя принимать препарат. Определим наиболее известные неблагоприятные сочетания напитков, продуктов и лекарств.
Прием статинов и цитрусы
Если пациент принимает препараты для снижения уровня холестерина из класса статинов, либо другие группы лекарств, помогающих в снижении уровня липидов, важно отказаться от употребления сока грейпфрута или самих фруктов, а также снизить потребление других цитрусов (лимоны, лаймы, мандарины), употребляя их не ранее, чем через 3 часа после таблеток.
Аналогично нужно поступить людям, которым назначен амиодарон для коррекции аритмии. Компоненты этих продуктов взаимодействуют с препаратами, изменяя их активность и нарушая работу лекарств в организме. Особенно активны фурнокумарины, они тормозят расщепление и выведение лекарств, что создает угрозу их передозировки.
Антибиотики, ингибиторы МАО и белковые продукты
Если пациент принимает препараты из группы ингибиторов моноаминооксидазы (МАО) при лечении депрессии, стоит отказаться от зрелых сыров, а также снизить употребление мяса, особенно обработанного (ветчина, колбаса, бекон). Аналогично нужно поступать при приеме антибиотиков, особенно мощных, показанных при лечении пневмонии. Между приемом препаратов и пищей должно проходить не менее 4 часов, а доза белковой пищи должна быть уменьшена в 2-3 раза. Причина такого запрета – содержание в сырах и некоторых видах мяса тирамина, аминокислоты, регулирующей давление. Эти препараты нарушают метаболизм тирамина, что грозит такими побочными эффектами, как учащение пульса, давление и ощущение боли в груди.
Газировки и препараты в оболочке
Шипучие напитки могут быть опасны при приеме таблеток, покрытых пленочной оболочкой, защищающей их от растворения в желудке. Из-за содержания углекислоты они способны растворять оболочку, образуя кислоты, что приводит к потере эффективности препарата, снижению его терапевтической концентрации. Тогда лечение будет малоэффективным.
Молоко и нестероидные препараты, антибиотики
Содержание кальция в молоке может приводить к инактивации некоторых антибиотиков, особенно – группы тетрациклинов. Также с молоком несовместимы доксициклин и ципрофлоксацин, которые применяют при микробных инфекциях. Важно разделять прием препаратов и молока как минимум за два часа до или четыре часа после молока. Аналогичными эффектами обладают йогурты, сыры, сливки или сметана.
Есть данные о том, что совместный прием нестероидных препаратов (например, ибупрофена) с молочными напитками или продуктами, может усиливать расстройства желудка.
Капуста и варфарин
Для людей, принимающих антикоагулянты, опасны смузи с крестоцветными и различные блюда из капусты. Особенно опасно их сочетание с варфарином, препятствующим тромбообразованию и разжижающему кровь. Это связано с содержанием витамина К, нейтрализующего их действие. Опасны также шпинат, салат, и любые крестоцветные, которые могут содержать большой объем витамина К. поэтому, объем этих продуктов нужно сократить, и принимать эти овощи как минимум через 3-4 часа после таблеток.
Антипсихотические средства и кофе, чай
Кофеин, содержащийся в чае и кофе, крайне плохо совместим с препаратами, которые применяют при биполярном расстройстве и шизофрении, расстройствах психики. Он усиливает эффект и может стимулировать появление побочных эффектов. Также опасно сочетать эти напитки с препаратами от астмы, бронхо-расширяющими эффектами. Кофеин может снижать их эффективность.
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
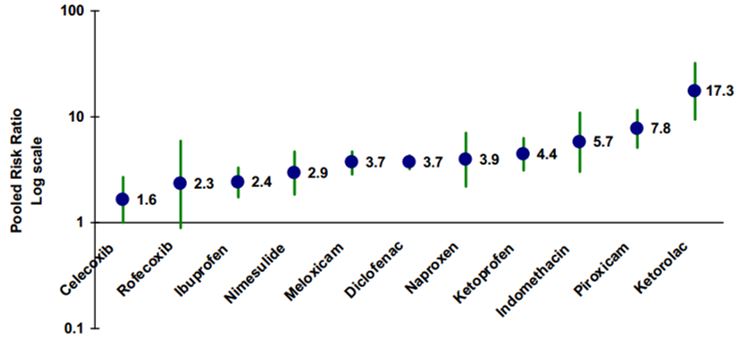
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Бактериальный вагиноз
Нормальная микрофлора влагалища женщин репродуктивного возраста является одним из показателей здоровья, так как играет большую роль в поддержании микроэкологического статуса. Взаимодействие между представителями нормальной микрофлоры и клетками вагиналь
Нормальная микрофлора влагалища женщин репродуктивного возраста является одним из показателей здоровья, так как играет большую роль в поддержании микроэкологического статуса. Взаимодействие между представителями нормальной микрофлоры и клетками вагинального эпителия осуществляется на клеточном и молекулярном уровнях и постоянно контролируется со стороны ряда систем макроорганизма. Результатом этого взаимодействия являются создание и поддержание высокой колонизационной резистентности вагинального эпителия к внедрению патогенных и условно-патогенных микроорганизмов [1–6].
Бактериальный вагиноз выделен из категории неспецифических вагинитов в отдельную нозологическую форму. К нему относят патологические состояния во влагалище, сопровождающиеся нарушениями качественного и количественного состава нормальной микрофлоры и не связанные с бактериальными инфекциями, передаваемыми половым путем (ИППП), грибами или простейшими.
Согласно современным представлениям, бактериальный вагиноз — инфекционный невоспалительный синдром полимикробной этиологии, который связан с дисбиозом вагинального биотопа. Нарушение микроэкологии влагалища при бактериальном вагинозе характеризуется резким снижением количества или отсутствием лактобактерий, продуцирующих перекись водорода и увеличением количества Gardnerella vaginalis, грамотрицательных анаэробных бактерий (Bacteroides spp., Mobiluncus spp., Fusobacterium spp., Peptostreptoicoccus spp., M. hominis, U. urealyticum).
Гарднереллы, как и лактобациллы, обладают выраженной способностью к адгезии на поверхности вагинальных эпителиоцитов. Gardnerella vaginalis могут продуцировать токсические биопродукты, к которым относятся муколитические ферменты и гемолизин, являющийся лейкотоксическим фактором. Гемолизин, воздействуя на эритроциты, вызывает образование многочисленных пор в эритроцитарной мембране, а также оказывает влияние на лейкоциты, вызывая их структурные и функциональные нарушения. Этим и объясняется отсутствие существенной лейкоцитарной инфильтрации, т. е. активности лейкоцитов в присутствии Gardnerella vaginalis.
Определенную роль в патогенезе бактериального вагиноза играют представители семейства Mycoplasmataceae — Mycoplasma hominis и Ureaplasma urealyticum. 70% выделенных штаммов Ureaplasma urealyticum относятся к биовару Parvo, 23,3% — к биовару Т960. Большинство пациенток, у которых была выделена Ureaplasma urealyticum, относящаяся к биовару Parvo, имели в прошлом раннее начало половой жизни, частую смену половых партнеров, наличие одновременно нескольких половых партнеров, большое количество беременностей и абортов, а также сопутствующие гинекологические заболевания и ИППП.
При обследовании половых партнеров пациенток с бактериальным вагинозом морфотипы ассоциированных с бактериальным вагинозом микроорганизмов выявлялись у 25% мужчин, при этом клинические проявления (баланопостит) наблюдались только у 3,1% [2].
В результате субмикроскопического исследования вагинального экссудата пациенток с бактериальным вагинозом определены структурно-функциональные особенности микробных клеток, участвующих во взаимодействии друг с другом, при этом клетки организма-хозяина представлены преимущественно плоским эпителием. Установлена грамвариабельность Gardnerella vaginalis вне зависимости от характера микробных ассоциаций. Анализ электронограмм продемонстрировал, что структурная организация Gardnerella vaginalis, адгезированных на поверхности эпителиальных клеток, не зависела от сочетания бактериального вагиноза с другими инфекционными агентами.
При сочетании бактериального вагиноза с Chlamydia trachomatis, Mycoplasma hominis, Ureaplasma urealyticum наблюдали значительное количество микроорганизмов в межклеточном пространстве и бактерий, морфологически идентичных микоплазмам [2].
Пациентки предъявляют жалобы на обильные выделения из половых путей белого или серого цвета, часто с неприятным запахом, особенно после полового акта или во время менструации. При длительно текущем процессе выделения приобретают желтовато-зеленую окраску, становятся более густыми, нередко напоминают творожистую массу, обладают свойством пениться; слегка тягучие и липкие, они равномерно распределяются по стенкам влагалища. Количество белей варьирует от умеренных до весьма обильных, составляя в среднем 20 мл в сутки. Жалобы на зуд и дизурические расстройства встречаются редко: они могут совсем отсутствовать или появляться периодически. Эти симптомы обнаруживаются у 16–23% пациенток с нарушениями микрофлоры влагалища. Характерным признаком бактериального вагиноза является отсутствие воспалительного процесса стенок влагалища. Нередко женщины с бактериальным вагинозом жалуются на обильное менструальное кровотечение, боли в низу живота. В то же время у части пациенток какие-либо субъективные ощущения отсутствуют.
Диагностика бактериального вагиноза основана на данных анамнеза, оценке субъективных и объективных симптомов заболевания, результатах лабораторных тестов — микроскопического исследования материала, аминного теста и рН вагинального экссудата [3].
При сборе анамнеза выясняют:
Диагноз бактериального вагиноза устанавливается на основании наличия трех критериев из нижеперечисленных:
Обследование пациентки следует проводить не ранее, чем через 72 ч после последнего полового контакта (без использования презерватива); оно не проводится также во время менструации. В течение 3 нед до обследования женщина не должна получать терапию системными и местнодействующими антибактериальными препаратами [3].
При микроскопическом исследовании нативного и окрашенного по Граму вагинального мазка определяются следующие признаки:
Оценка общей микробной обсемененности вагинального отделяемого проводится по 4-балльной системе — по числу микробных клеток, обнаруживаемых в одном поле зрения при иммерсионной микроскопии:
1 балл (+) — до 10 микробных клеток в поле зрения, незначительное их количество (скудный рост);
2 балла (++) — от 11 до 100 микробных клеток в поле зрения, умеренное их количество;
3 балла (+++) — от 100 до 1000 микробных клеток в поле зрения, большое их количество;
4 балла (++++) — более 1000 микробных клеток в поле зрения, массивное их количество.
Так как Gardnerella vaginalis может быть обнаружена у здоровых женщин, культуральное исследование и ПЦР-диагностику для идентификации Gardnerella vaginalis не проводят. Культуральное исследование проводят при наличии показаний для определения видового и количественного состава вагинального микроценоза и исключения возбудителей ИППП.
При культуральном исследовании могут быть обнаружены изменения, характерные для бактериального вагиноза: общая микробная обсемененность превышает 10 9 КОЕ/мл; при использовании только аэробных условий культивирования рост микроорганизмов отсутствует или наблюдается рост сопутствующих условно-патогенных микроорганизмов (чаще в небольшом титре); полимикробный характер микрофлоры с абсолютным преобладанием облигатно-анаэробных видов и Gardnerella vaginalis; отсутствие роста лактобацилл или резкое снижение их титра ( 4 КОЕ/мл).
На основании проведенных исследований в настоящее время рекомендуется в план ведения пациенток включать:
Целью лечения является уменьшение выраженности клинических симптомов, нормализация лабораторных показателей, предотвращение развития возможных осложнений в период беременности, а также в послеродовом периоде и при выполнении инвазивных гинекологических процедур.
Результаты лабораторных исследований в норме следующие.
Лечение
Основное направление терапии — применение местных или системных антибактериальных препаратов с антианаэробным эффектом.
Показано применение клиндамицина. Препарат является 7-дезоксипроизводным линкомицина, ингибирует синтез белков в микроорганизмах, оказывает бактериостатическое или бактерицидное действие в зависимости от концентрации в макроорганизме и чувствительности микроорганизма. Препарат эффективен в отношении грамположительных микроорганизмов (стафилококков, стрептококков, пневмококков, палочки дифтерии), гарднерелл, микоплазм. Устойчивость микроорганизмов к клиндамицину вырабатывается медленно. При приеме внутрь клиндамицин всасывается лучше, чем линкомицин. После внутримышечного введения максимум его концентрации в крови отмечается через 2–2,5 ч. Препарат хорошо проникает в жидкости и ткани организма, выводится с мочой и желчью. При нарушении функции почек и печени выведение клиндамицина замедляется. При бактериальном вагинозе можно назначать одну из лекарственных форм клиндамицина: крем 2%-ный 5 г в аппликаторе (разовая доза) интравагинально 1 раз в день (на ночь) в течение 6 дней; овули 100 мг интравагинально на ночь в течение 3 дней; капсулы 300 мг внутрь 2 раза/сут в течение 7 дней.
Клиндамицин разрешенн к применению у беременных в виде 2%-го крема 5 г (разовая доза) интравагинально 2 раза/сут в течение 5 дней.
Также при бактериальном вагинозе можно назначать метронидазол. Он обладает широким спектром действия в отношении простейших, подавляет развитие Trichomonas vaginalis, Entamoeba histolytica и лямблий. В отношении анаэробных бактерий препарат высокоэффективен. Метронидазол хорошо всасывается при приеме внутрь, проникает в органы и ткани, проходит через плаценту и гематоэнцефалический барьер, накапливается в печени. Период полувыведения препарата составляет 8–10 ч, полностью выводится из организма через 1–2 сут после введения. Метронидазол в основном выводится с мочой в неизмененном виде и в виде метаболитов, частично — с калом. При применении метронидазола могут отмечаться потеря аппетита, сухость и неприятный вкус во рту, тошнота, рвота, диарея, головная боль, крапивница, зуд. Эти явления проходят после окончания лечения или отмены препарата. Возможна лейкопения. Препарат противопоказан при беременности и кормлении грудью, нарушениях кроветворения, остром течении заболеваний центральной нервной системы. Во избежание развития тяжелых побочных реакций следует предупреждать пациентов о недопустимости приема алкоголя и содержащих его продуктов как в ходе терапии метронидазолом, так и в течение 24 ч после ее окончания. При бактериальном вагинозе можно применять одну из следующих схем лечения с использованием метронидазола:
Также используют и другие производные метронидазола:
Ранее было проведено сравнительное изучение эффективности местнодействующих пробиотиков. Поскольку не было выявлено достоверных отличий в результатах лечения у пациенток, получавших и не получавших эти средства, в настоящее время их не рекомендуют при лечении бактериального вагиноза [3].
При сочетании бактериального вагиноза с ИППП, одновременно применяют антибактериальные препараты в соответствии с нозологической формой заболевания [2]. При неосложненной гонорейной инфекции назначают цефтриаксон однократно внутримышечно в дозе 250 мг (препарат является цефалоспориновым антибиотиком III поколения; после внутримышечного введения пик концентрации в крови отмечается через 1,5 ч; из организма выводится медленно). При обнаружении хламидий и/или микоплазм показано применение антибиотиков — макролидов, тетрациклинов.
Высокий терапевтический эффект, хорошая переносимость способствовали значительному распространению применения макролидов. Их антимикробный эффект обусловлен нарушением синтеза белка в рибосомах микробной клетки. Как правило, макролиды оказывают бактериостатическое действие, но в высоких концентрациях способны вызывать и бактерицидный эффект. Кроме антибактериального действия, макролиды обладают умеренной иммуномодулирующей и противовоспалительной активностью. Представителем III поколения макролидов является джозамицин (Вильпрафен). Этот антибиотик быстро абсорбируется из желудочно-кишечного тракта (ЖКТ), хорошо проникает через биологические мембраны и накапливается в тканях. Максимальная концентрация достигается через 1–2 ч после приема. Через 45 мин после приема дозы 1 г средняя концентрация джозамицина в плазме составляет 2,41 мг/л; связывание с белками плазмы не превышает 15%. Прием препарата с интервалом в 12 ч обеспечивает сохранение эффективной концентрации джозамицина в тканях в течение суток. Равновесное состояние достигается через 2–4 дня регулярного приема. Концентрация джозамицина в полиморфонуклеарных лейкоцитах человека, моноцитах и альвеолярных макрофагах примерно в 20 раз выше, чем в других клетках организма. Препарат биотрансформируется в печени до менее активных метаболитов. Джозамицин выводится главным образом с желчью, выведение же с мочой составляет менее 20%. Препарат назначается по 500 мг 2 раза в день в течение 10 дней.
Из группы тетрациклинов при ИППП наиболее эффективен доксициклин; в последние годы широко применяется Юнидокс Солютаб. Препарат отличается от Доксициклина гидрохлорида нейтральной реакцией, оказывает меньшее раздражающее действие на слизистую оболочку пищеварительного тракта и обладает улучшенными противомикробными и фармакокинетическими свойствами. Юнидокс Солютаб блокирует рибосомальную полимеразу и тормозит синтез белка в микроорганизмах.
Таблетки Юнидокс Солютаб обладают контролируемой растворимостью. Их можно не только принимать внутрь целиком или по частям, но и быстро приготовить из них сироп, суспензию (растворив таблетку в 20 мл воды) или раствор (растворив таблетку в 100 мл воды), которые обладают приятным вкусом. Таблетки растворяются в воде в течение 5–10 с, в биологических жидкостях — в течение 1 мин, превращаясь в равномерную суспензию.
Юнидокс Солютаб всасывается полностью. Биодоступность препарата составляет 95%. Через 2 ч после приема (200 мг в первый день и 100 мг в последующие дни) уровень в сыворотке составляет от 1,5 до 3 мг/мл. Препарат на 80–90% связывается с белками плазмы, хорошо проникает в ткани, накапливается в ретикулоэндотелиальной системе. Период полувыведения составляет 16–18 ч, после приема повторных доз — 22–23 ч.
Ранее были отмечены преимущества, заключающиеся в отсутствии побочных эффектов по типу эзофагитов, встречающихся при применении обычных форм Доксициклина гидрохлорида, способности накапливаться в высоких концентрациях в репродуктивных органах и активно воздействовать на инфекционный агент.
Юнидокс Солютаб назначают в дозе 200 мг в течение 10 дней.
Лабораторный контроль эффективности терапии следует проводить непосредственно по окончании этиотропного лечения: при микроскопии вагинальных мазков, окрашенных по Граму, необходимо констатировать степень эрадикации микроорганизмов, ассоциированных с бактериальным вагинозом; при посеве вагинального отделяемого — выявлять случаи колонизации факультативно анаэробными условно-патогенными микроорганизмами.
При сочетании бактериального вагиноза с урогенитальным хламидиозом и/или микоплазмозом лабораторный контроль необходимо повторить через 3 нед по окончании терапии.
По вопросам литературы обращайтесь в редакцию.
И. В. Хамаганова, доктор медицинских наук, профессор
РГМУ, Москва