Цифран или ципрофлоксацин что лучше
Сравнительная оценка эффективности применения ципрофлоксацина и «Цифрана СТ» для профилактики вторичного инфицирования эрозивно-язвенных поражений слизистой оболочки полости рта
Л. Р. Мухамеджанова
д. м. н., доцент, заведующая кафедрой терапевтической стоматологии ГОУ ВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ
Ю. В. Фазылова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ
С. И. Мушарапова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ
Эрозивно-язвенные поражения (ЭЯП) слизистой оболочки полости рта представляют собой группу заболеваний, сопровождающихся образованием дефектов эпителия (единичных, множественных, сливных) в различных топографо-анатомических зонах преддверия полости рта, собственно полости рта, а также красной каймы губ. Данная группа объединяет различные по этиопатогенезу, во многом схожие по клиническому течению заболевания: эрозивно-язвенную форму красного плоского лишая, хронический рецидивирующий афтозный стоматит, язвенно-некротический гингивостоматит, рецидивирующий герпетический стоматит и др. ЭЯП полости рта подвержены вторичному инфицированию, что обусловлено резким снижением мукозального иммунитета, изменениями биохимических свойств секрета слюнных желез, затруднением гигиенического ухода за полостью рта, отсутствием возможности самоочищения поверхности слизистой оболочки из-за невозможности приема пищи.
Присоединение вторичной инфекции зачастую приводит к усилению болевого синдрома, способствует увеличению площади ЭЯП, углублению дефектов (что сопровождается разрушением волокнистых структур базальной мембраны и вовлечению в процесс суббазальной соединительной ткани), формированию выраженного воспалительного бордюра по периферии очага поражения. Эти причины в значительной степени ухудшают прогноз лечения заболевания и требуют включения в комплексную терапию дополнительных фармакотерапевтических средств.
Поиск лекарственных препаратов, предупреждающих процесс вторичного инфицирования, весьма актуален. Один из них — новый оригинальный препарат, выпускаемый компанией Ranbaxy (Индия), «Цифран СТ».
«Цифран СТ» представляет собой комбинацию ципрофлоксацина гидрохлорида (фторхинолоновый антибиотик) и тинидазола (производное имидазола). Включение в состав препарата тинидазола значительно расширяет спектр антибактериальной активности:
Целью настоящего исследования явилась сравнительная оценка эффективности применения ципрофлоксацина и «Цифрана СТ» для профилактики вторичного инфицирования очагов поражения на слизистой оболочке полости рта у больных эрозивно-язвенной формой красного плоского лишая (КПЛ).
Под нашим наблюдением находились 18 пациентов (женщины) в возрасте 43—65 лет с диагнозом «красный плоский лишай, эрозивно-язвенная форма». Изолированное поражение слизистой оболочки полости рта имело место у 14 пациентов, сочетанное поражение кожи и слизистой полости рта — у 4 пациентов. Все наблюдаемые пациенты были обследованы врачом-дерматовенерологом, диагностический комплекс включал также общий анализ крови, исследование на сифилис, ВИЧ-инфекцию, гепатит В и С, люминесцентную диагностику (желтоватое свечение очагов гиперкератоза по периферии эрозий и язв). Все пациенты получали следующее лечение: per os — делагил 2,5 мг 2 раза в день, аевит 2 капсулы 2 раза в день, метилурацил 500 мг 2 раза в день, раствор димефосфона 15%-ный по 15 мл 2 раза день. Местное лечение включало антисептическую обработку полости рта раствором хлоргексидина биглюконата 0,02 %; аппликации на эрозивно-язвенные очаги тампонов, смоченных раствором тантум-верде, гелем куриозин или актовегин. С целью профилактики вторичного инфицирования очагов поражения назначали системную антибиотикотерапию «Цифраном СТ» 500/600 мг 2 раза в день (исследуемая группа, 9 пациентов) и «Ципрофлоксацином» 500 мг 2 раза в день (контрольная группа, 9 пациентов). Поскольку все пациенты, страдающие эрозивно-язвенной формой красного плоского лишая, имеют сниженную общую иммунологическую реактивность организма, местных профилактических мероприятий оказывается недостаточно.
Оценку эффективности проводили по следующим клиническим критериям: уменьшение выраженности гиперемии по периферии очага поражения, уменьшение выраженности воспалительного инфильтрата, уменьшение болезненности, наличие налета на поверхности эрозий и язв, цвет налета, запах. Полученные результаты были подвергнуты статистической обработке с использованием критерия Стьюдента.
Результаты: проведенных исследований показали, что у пациентов исследуемой группы имело место уменьшение выраженности гиперемии на 2—3-и сутки после назначения препарата, у пациентов контрольной группы — на 3—4-е сутки (р > 0,005), воспалительный инфильтрат уменьшался у пациентов обеих групп на 3—4-е сутки, очищение поверхности эрозивно-язвенных очагов от налета происходило на 3-и сутки у пациентов исследуемой группы, на 5—6-е сутки у пациентов контрольной группы (р
Таким образом, результаты проведенных исследований доказывают эффективность применения антибактериальных препаратов широкого спектра действия (ципрофлоксацин, «Цифран СТ») в клинике терапевтической стоматологии с целью профилактики вторичного инфицирования эрозивно-язвенных очагов поражения при красном плоском лишае. При этом «Цифран СТ» показал более высокую эффективность в сравнении с ципрофлоксацином. Полученные данные позволяют рекомендовать вышеуказанные препараты для широкого применения в клинике.
Ципрофлоксацин в урологической практике: современное значение и новые возможности
Опубликовано в журнале «Фарматека»
И.И. Деревянко
НИИ урологии МЗ РФ, Москва
Синтез соединений из группы фторхинолонов, осуществляемый в широких масштабах с целью поиска новых антимикробных препаратов, проводится свыше 15 лет. За указанный период в этом ряду химических веществ были разработаны высокоэффективные лекарственные средства, которые с успехом применяются для лечения различных бактериальных заболеваний, хламидиозов, микоплазменной инфекции.
В настоящее время фторхинолоны рассматриваются как важная самостоятельная группа химиотерапевтических препаратов в составе класса хинолонов – ингибиторов ДНК-гиразы, которые характеризуются высокой клинической эффективностью (в т.ч. при пероральном использовании), широкими показаниями к применению и составляют серьезную альтернативу b-лактамным антибиотикам широкого спектра действия.
Особенно большой клинический опыт накоплен в отношении применения ципрофлоксацина – одного из первых и наиболее активных препаратов этой группы, в настоящее время применяемых в клинике. Ципрофлоксацин очень широко используется в клинической практике в различных регионах мира, превосходя по частоте назначений все остальные фторхинолоны со сходным механизмом действия. В целом ципрофлоксацин был применен у 340 млн., офлоксацин – у 170 млн., левофлоксацин – у 150 млн., ломефлоксацин – у 15 млн., моксифлоксацин – у 10 млн. и спарфлоксацин – у около 5 млн. пациентов (Материалы компании Байер, 2002 г.).
К настоящему времени разработано более 15 фторхинолонов. Несколько новых активных соединений этого класса проходят расширенную клиническую апробацию, поэтому целесообразно привести общие сведения, характеризующие лекарственные препараты указанной группы.
Основные характеристики действия фторхинолонов состоят в следующем (В.П. Яковлев и соавт., 2000):
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
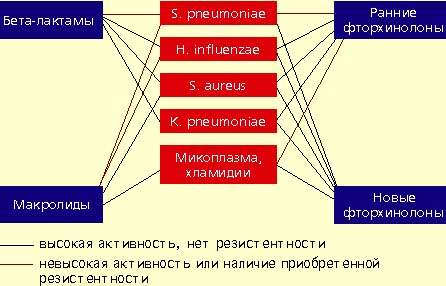
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Цифран ОД
Инструкция
Торговое название
Международное непатентованное название
Лекарственная форма
Таблетки, покрытые пленочной оболочкой, с пролонгированным высвобождением
Состав
Одна таблетка содержит
активное вещество – ципрофлоксацина 1000 мг
интрагранулят: натрия алгинат, гипромеллоза, натрия бикарбонат, кросповидон, магния стеарат;
экстрагранулят: магния стеарат, тальк очищенный, кремния диоксид коллоидный безводный;
оболочка: опадрай 31В58910 белый (гипромеллоза, лактозы моногидрат, титана диоксид (Е171), макрогол 400), гипромеллоза, тальк очищенный;
чернила Opacode S-1-17823 (Black): шеллак глянцевый, спирт изопропиловый, железа(III) оксид черный (Е172), спирт бутиловый, пропиленгликоль, 28 % раствор аммиака.
Описание
Таблетки овальной формы, покрытые пленочной оболочкой от белого до почти белого цвета, с надписью «Cifran OD 1000 MG» пищевой краской на одной стороне. Длина 21.2 ± 0.1 мм, ширина 10.6 ± 0.1 мм, толщина 7.6 ± 0.3 мм.
Фармакотерапевтическая группа
Антибактериальные препараты для системного использования. Противомикробные препараты – производные хинолона. Фторхинолоны. Ципрофлоксацин.
Фармакологические свойства
Фармакокинетика
Ципрофлоксацин таблетки с пролонгированным действием разработаны для высвобождения препарата при более низкой скорости по сравнению с таблетками быстрого высвобождения.
Фармакокинетический профиль ципрофлоксацина таблетки с пролонгированным действием 1000 мг один раз в сутки сравним с профилем 500 мг ципрофлоксацина таблетки с быстрым высвобождением два раза в сутки, в пересчете на сравнимый AUC на протяжении 24-часового периода дозирования.
Связь ципрофлоксацина с белками плазмы крови составляет 20-30%; активное вещество присутствует в плазме крови преимущественно в неионизированной форме. Ципрофлоксацин свободно распределяется в тканях и жидкостях организма. Объем распределения в организме составляет 2-3 л/кг. Концентрация ципрофлоксацина в тканях значительно превышает концентрацию в сыворотке крови.
Биотрансформируется в печени. В крови могут обнаруживаться четыре метаболита ципрофлоксацина в небольших концентрациях: диэтилципрофлоксацин (Ml), сульфоципрофлоксацин (М2), оксоципрофлоксацин (МЗ), формилципрофлоксацин (М4), три из которых (М1-МЗ) проявляют антибактериальную активность in vitro, сопоставимую с антибактериальной активностью налидиксовой кислоты. Антибактериальная активность in vitro метаболита М4, присутствующего в меньшем количестве, больше соответствует активности норфлоксацина.
Фармакокинетические анализы оральных таблеток с немедленным высвобождением (однократная доза) и форм ципрофлоксацина для внутривенного введения (однократные и многократные дозы) показывают, что концентрации ципрофлоксацина в плазме выше у пожилых людей (старше 65 лет) по сравнению с молодыми взрослыми. Cmax повышается с 16% до 40%, а средняя AUC повышается приблизительно на 30%, что может быть, по меньшей мере, частично вызвано снижением почечного клиренса у пожилых людей. Период полувыведения только немного дольше у пожилых людей (
20%). Данные различия не являются клинически значимыми.
У больных со сниженной функцией почек, период полувыведения ципрофлоксацина может удлиняться. Корректировка дозы не требуется больным с неосложненными инфекциями мочевыводящих путей, получающих 500 мг лекарственной формы ципрофлоксацина с пролонгированным действием. Для осложненных инфекций мочевыводящих путей и острого неосложненного пиелонефрита, где применяется доза 1000 мг, следует уменьшить дозировку лекарственной формы ципрофлоксацина с пролонгированным действием до 500 мг 1 раз в сутки (клиренс креатинина ниже 30 мл/мин).
При исследовании больных со стабильным хроническим циррозом печени не наблюдались существенные изменения в фармакокинетике ципрофлоксацина. При этом кинетика ципрофлоксацина у больных с острой печеночной недостаточностью недостаточно выявлена.
Фармакодинамика
Ципрофлоксацин представляет собой синтетический антибактериальный препарат широкого спектра действия из группы фторхинолонов.
Ципрофлоксацин обладает активностью in vitro в отношении широкого спектра грамотрицательных и грамположительных микроорганизмов. Бактерицидное действие ципрофлоксацина осуществляется посредством ингибирования бактериальных топоизомераз II типа (топоизомераза II (ДНК-гираза) и топоизомераза IV), которые необходимы для репликации, транскрипции, репарации и рекомбинации бактериальной ДНК.
Резистентность in vitro к ципрофлоксацину часто обусловлена точечными мутациями бактериальных топоизомераз и ДНК-гиразы и развивается медленно посредством многоступенчатых мутаций.
Единичные мутации могут приводить скорее к снижению чувствительности, чем к развитию клинической устойчивости, однако множественные мутации в основном приводят к развитию клинической резистентности к ципрофлоксацину и к перекрестной резистентности к препаратам хинолонового ряда. Резистентность к ципрофлоксацину, как и.ко многим другим антибиотикам, может формироваться в результате снижения проницаемости клеточной стенки бактерий (как это часто происходит в случае Pseudomonas aeruginosa) и/или активации выведения из микробной клетки (эффлюкс). Сообщается о развитии резистентности, обусловленной локализованным на плазмидах кодирующим геном Qnr. Механизмы резистентности, которые приводят к инактивации пенициллинов, цефалоспоринов, амино-гликозидов, макролидов и тетрациклинов, вероятно, не нарушают антибактериальную активность ципрофлоксацина. Микроорганизмы, резистентные к этим препаратам, могут быть чувствительными к ципрофлоксацину. Минимальная бактерицидная, концентрация (МБК) обычно не превышает минимальную ингибирующую концентрацию (МИК) более чем в 2 раза.
Перекрестная резистентность. Перекрестной резистентности между ципрофлоксацином и противомикробными препаратами других классов не отмечается.
Ципрофлоксацин проявляет активность в отношении большинства штаммов следующих бактерий как в условиях in vitro, так и в клинической практике лечения инфекций.
Аэробные грамположительные микроорганизмы: Bacillus anthracis, Staphylococcus aureus (метициллин-чувствительные), Staphylococcus saprophyticus, Streptococcus spp. Аэробные грамотрицательные микроорганизмы: Aeromonas spp., Moraxella catarrhalis, Brucella spp., Neisseria meningitidis, Citrobacter koseri, Pasteurella spp., Francisella tularensi, Salmonella spp., Haemophilus ducreyi, Shigella spp., Haemophilius influenzae, Vibrio spp., Legionella spp., Yersinia pestis. Анаэробные микроорганизмы: Mobiluncus spp.
Другие микроорганизмы: Chlamydia trachomatis, Chlamydia pneumoniae, Mycoplasma hominis, Mycoplasma pneumoniae. Была продемонстрирована варьирующая степень чувствительности к ципрофлоксацину для следующих микроорганизмов: Acinetobacter baumann, Burkholderia cepacia, Campylobacter spp., Citrobacter freundii, Enterococcus faecalis, Enterobacter aerogenes, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Morganella morganii, Neisseria gonorrhoeae, Proteus mirabilis, Proteus vulgaris, Providencia spp., Pseudomonas aeruginosa, Pseudomonas fluorescens, Serratia marcescens, Streptococcus pneumoniae, Peptostreptococcus spp., Propionibacterium acnes. Считается, что природной резистентностью к ципрофлоксацину обладают Staphylococcus aureus (метициллин-резистентный), Stenotrophomonas maltophilia, Actinomyces spp., Enteroccus faecium, Listeria monocytogenes, Mycoplasma genitalium, Ureaplasma urealitycum, анаэробные микроорганизмы (за исключением Mobiluncus spp., Peptostreptococus spp., Propionibacterium acnes).
Показания к применению
Неосложненные и осложненные инфекции, вызванные чувствительными к ципрофлоксацину микроорганизмами.
— инфекции дыхательных путей. Ципрофлоксацин рекомендуется назначать при пневмониях, вызванные Klebsiella spp., Enterobacter spp., Proteus spp., Esherichia coli, Pseudomonas aeruginosa, Haemophilus spp., Moraxella catarrhalis, Legionella spp. и стафилококками
— инфекции среднего уха (средний отит), придаточных пазух (синусит), особенно если эти инфекции вызваны грамотрицательными микроорганизмами, включая Pseudomonas aeruginosa или стафилококки,
— инфекции почек и/или мочевыводящих путей
— инфекции половых органов, включая аднексит, гонорею, простатит
— инфекции брюшной полости (бактериальные инфекции желудочно-кишечного тракта, желчевыводящих путей, перитонит)
— инфекции кожи и мягких тканей
— инфекции или профилактика инфекций у пациентов со сниженным иммунитетом (пациенты, принимающих иммунодепрессанты или пациенты с нейтропенией)
— селективная деконтаминация кишечника у пациентов со сниженным иммунитетом
— профилактика и лечение легочной формы сибирской язвы (инфицирование Bacillus anthracis)
— профилактика инвазивных инфекций, вызванных Neisseria meningitidis.
Необходимо принимать во внимание действующие официальные руководства о правилах применения антибактериальных средств.
— лечение осложнений, вызванных Pseudomonas aeruginosa у детей с муковисцидозом легких от 5 до 17 лет
— профилактика и лечение легочной формы сибирской язвы (инфицирование Bacillus anthracis)
Способ применения и дозы
Таблетки необходимо глотать не разжевывая, запивая водой. Их можно принимать независимо от времени приема пищи. При приеме на голодный желудок, активное вещество всасывается быстрее.
Таблетки Цифран ОД принимаются один раз в день.
Дозировка и курс лечения зависят от показаний, степени тяжести и локализации инфекции, восприимчивости к ципрофлоксацину патогенного микроорганизма(ов), функции почек больных и от клинической и бактериологической эффективности.
Для лечения некоторых бактериальных инфекций (напр. Pseudomonas aeruginosa, Acinetobacter or Staphylococci) могут понадобиться более высокие дозы ципрофлоксацина и совместное введение с другими надлежащими антибактериальными средствами.
Для лечения некоторых инфекций (напр. воспалительные заболевания органов малого таза, интраабдоминальные инфекции, инфекции у нейтропенических больных и инфекции костей и суставов) может понадобиться совместное введение с другими надлежащими антибактериальными средствами в зависимости от вовлеченных патогенов.
Показания
Суточная
доза в мг
Продолжительность лечения (потенциально включающего начальное парентеральное лечение ципрофлоксацином)
Инфекции нижних дыхательных путей
Инфекции верхних дыхательных путей
Обострение хронического синусита
Хронический гнойный средний отит
Злокачественный наружный отит
28 дней до 3 месяцев
Инфекции мочевыводящих путей
У женщин предклимактерического возраста 500 мг (однократная доза)
Осложненный цистит, неосложненный пиелонефрит
минимум 10 дней, может длиться более 21 дня при некоторых тяжелых инфекциях (напр. абсцессы)
Инфекции половых путей
Гонококковый уретрит и цервицит
500 мг (однократная доза)
1 день (однократная доза)
Орхоэпидидимит и воспалительные заболевания органов малого таза
Инфекции ЖКТ и интраабдоминальные инфекции
Диарея, вызванная бактериальными патогенами, в т.ч. Shigella spp., кроме 1 типа Shigella dysenteriae и эмпирическое лечение тяжелой степени диареи путешественников
Диарея, вызванная 1 типом Shigella dysenteriae