Цитостатики для чего применяют
Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
Диагноз ревматоидного артрита ставится на основании:
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
Биологические (генно-инженерные) БПВП – биологические агенты
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Цитостатики для чего применяют
Препарат был разработан Леонидом Федоровичем Ларионовым – руководителем лаборатории экспериментальной терапии рака, созданной в 1945 году при поддержке директора Института Николая Николаевича Петрова, и профессором Ленинградского технологического института Вульфом Григорьевичем Немецем.
Под руководством Л.Ф. Ларионова и В.Г.Немеца был синтезирован целый ряд производных азотистых ипритов (хлорэтиламинов), в числе которых был и метил-бис-(?-хлорэтил)-амин, названный авторами эмбихин. Доступных сведений ни о методике лечения хлорэтиламинами в клинике, ни о дозах и способах их введения в то время не было. Доклиническое изучение противоопухолевых и токсических свойств эмбихина проводила сотрудница лаборатории экспериментальной терапии рака врач Лидия Леонидовна Малюгина, которая в 1947 году по категорическому требованию самого пациента, специальному разрешению правительственных и партийных инстанций и по просьбе Николая Николаевича Петрова впервые ввела больному лимфопролиферативным заболеванием противоопухолевый препарат эмбихин.
В монографии Л.Ф. Ларионова «Лечение белокровия и лимфогранулематоза эмбихином», вышедшей в 1951 году, описан этот случай:
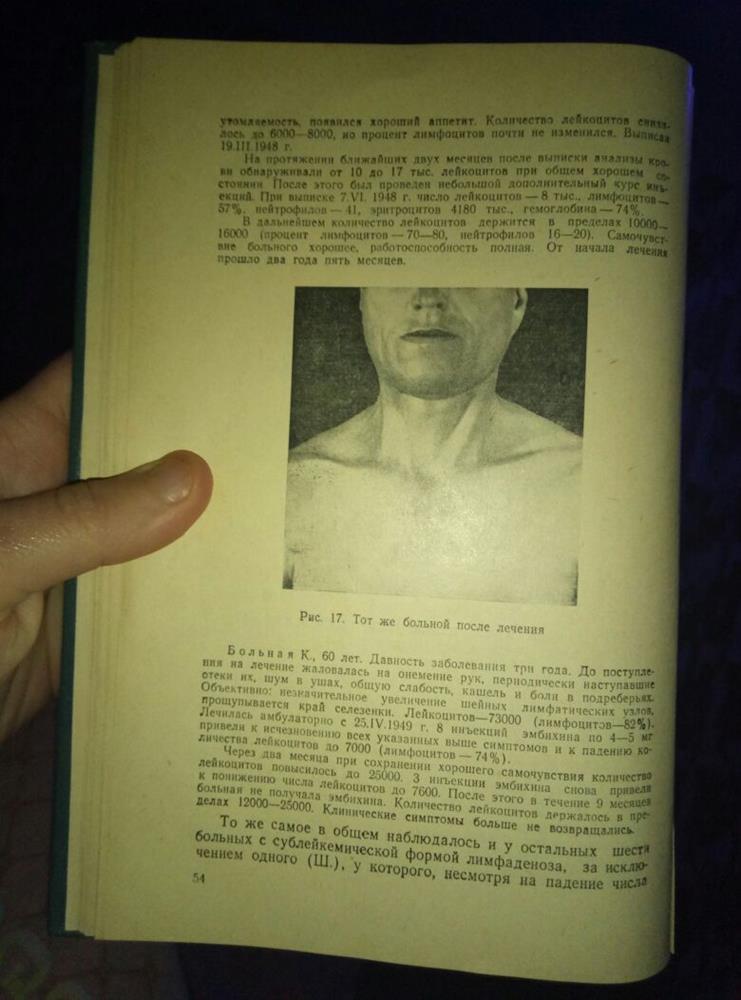
Клиническое наблюдение: «Больной С., 49 лет, поступил в НИИ онкологии 08.12.1947 года с жалобами на слабость, быструю утомляемость, значительную потливость и похудание. Периферические лимфатические узлы во всех областях (шейные, подчелюстные, подбородочные, подмышечные, паховые) увеличены, некоторые до 4 см в диаметре. Лейкоцитоз – 35 тыс. при 78% лимфоцитов. Гистологическое исследование удаленного узла подтвердило диагноз лимфаденоза. Больному было сделано 30 введений эмбихина по 3 раза в неделю в дозе 4-5 мг. Все лимфатические узлы значительно уменьшились, некоторые почти перестали прощупываться. Полностью прекратились клинические симптомы. Выписан 19.03.1948г. Затем через 2 месяца последовал очередной цикл химиотерапии. При выписке 07.06.1948 г. клинический анализ нормализовался. В дальнейшем число лейкоцитов держится в пределах 10.000-16.000 тыс. (процент лимфоцитов 70-80, нейтрофилов 16-20). От начала лечения прошло два года и пять месяцев».

Монохимиотерапия эмбихином больных «белокровием», лимфогранулематозом и некоторыми опухолями была продолжена в НИИ онкологии АМН СССР. В 1950 году Л.Ф. Ларионову и В.Г. Немецу «За разработку нового метода лечения лимфогранулематоза и белокровия препаратом «Эмбихин» и внедрение его в практику здравоохранения» была присуждена Сталинская премия.
В 1951 году Л.Ф.Ларионов был переведен на работу в Москву в недавно созданный институт экспериментальной и клинической онкологии АМН СССР, где он также организовал лабораторию экспериментальной химиотерапии опухолей, которой руководил до последних дней. Талант экспериментатора, сила научного предвидения, аналитический ум и широкая эрудиция, а также слаженная работа единомышленников (В.Г. Немеца, И.Я. Постовского, З.В. Пушкарева, И.Л. Кнунянц, О.Ф. Гинзбург, Л.Б. Радиной) позволили академику АМН СССР, профессору Л.Ф. Ларионову заложить более полувека назад фундамент всей современной лекарственной терапии злокачественных опухолей.
Основные принципы, сформулированные в трудах Л.Ф. Ларионова:

На протяжении последующих десятилетий в рамках отечественных и международных исследований в НИИ Петрова было изучено более 150 различных противоопухолевых препаратов и средств сопроводительной терапии, вошедших в практику современной онкологии и гематологии. Сегодня, базируясь на результатах фундаментальных и клинико-экспериментальных исследований, успешно изучаются и внедряются все новые подходы в системном лечении злокачественных опухолей, включающие таргетную терапию и иммунотерапию. Как результат, с помощью системной терапии онкологи научились полностью излечивать одни опухоли и переводить некогда инкурабельные заболевания в хронические.
Т.Ю.Семиглазова, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации,
врач высшей категории, доктор медицинских наук.
Цитостатики для чего применяют
Данная обзорная статья посвящена основным характеристикам широко применяемого в медицине цитостатического препарата – циклофосфана (ЦФ). Несмотря на то, что прошло более 60 лет с момента открытия ЦФ, данный препарат не утратил своей актуальности. Он до сих пор используется в составе различных комбинаций препаратов, применяемых для лечения злокачественных новобразований [1, 13, 24, 25, 34, 38]. Велико его значение и в теоретическом плане при разработке моделей индуцированной иммуносупрессии в эксперименте с целью понимания процессов формирования вторичных иммунодефицитов и методов их иммунокорреции [3, 14, 18, 19, 20, 21, 23, 33, 40].
Лекарственное лечение злокачественных новобразований – химиотерапия
Химиотерапия является одним из способов воздействия на злокачественные новообразования наряду с оперативным вмешательством и лучевой терапией [26]. В химиотерапии могут применяться алкилирующие средства, антиметаболиты, антибиотики а также препараты растительного происхождения [36].
Лекарственная терапия может быть:
Первичную (или индуктивную) химиотерапию применяют при местно распространённом неоперабельном опухолевом процессе.
Неоадъювантную терапию проводят при операбельных опухолях до выполнения оперативного вмешательства. Адъювантное лечение используют после оперативного вмешательства (в том числе циторедуктивного) при отсутствии клинических проявлений отдалённых метастазов. Цель адъювантной терапии – снижение частоты системных рецидивов заболевания путём уничтоженияотдалённых микрометастазов. Паллиативную химиотерапию осуществляют при наличии отдалённых метастазов [11].
Общие сведения о цитостатических препаратах
Цитостатические препараты (цитостатики) – группа противоопухолевых лекарственных веществ, которые задерживают развитие перерожденных клеток злокачественных опухолей (рак и др.) и форменных элементов крови (лейкозы и др.) [27].
Под действием цитостатиков поражаются преимущественно клетки, обладающие высоким митотическим индексом, либо клетки, биохимические процессы которых в наибольшей степени подвергаются дестабилизации [28]. Примерами цитостатиков могут служить доксорубицин, фторурацил, циклофосфан.
Циклофосфан или циклофосфамид – производное азотистого иприта (горчичного газа), использовавшегося как боевое отравляющее вещество в годы Первой мировой войны. Помимо противоопухолевого воздействия, на которое делается акцент в данной статье, препарат используют как иммунодепрессант для профилактики отторжения трансплантанта и при аутоиммунных процессах [37].
Данный препарат разработан в 1957 году, после открытия в 40-х годах цитостатического действия бис-(B-хлорэтил) аминов (ипритов), которое привело со временем к созданию большого количества препаратов разной направленности, эффективных в онкологии [16]. Несмотря на то, что со времени открытия препарата прошло около 60 лет, он не потерял своей актуальности и до сих пор широко используется в клинической практике.
Циклофосфан относится к группе алкилирующих соединений, а конкретнее – к хлорэтиламинам. По физическим свойствам ЦФ представляет собой белый кристаллический порошок, растворимый в воде (1:50), легко растворяющийся в спирте, трудно – в изотоническом растворе хлорида натрия [17].
Получают препарат путём конденсации дихлорангидрида амидофосфорной кислоты с 3-амино-1-пропанолом в присутствии триэтиламина в растворе этилацетата с последующей обработкой продукта конденсации водой [29].
Противоопухолевое действие ЦФ реализуется непосредственно в клетках опухоли, где циклофосфамид биотрансформируется с образованием активного метаболита, обладающего алкилирующим действием [39].
Циклофосфан хорошо всасывается из желудочно-кишечного тракта, максимальная концентрация в крови его достигается через 1 час, связь с белком минимальная. Он может накапливаться в почках, печени, селезёнке. Выводится из организма в неизменённом виде (20% введённой дозы) и в виде активных и неактивных метаболитов. Период полувыведения составляет 7 часов [12].
В экспериментах на животных показано, что однократное введение ЦФ сразу повышает концентрации реактивных метаболитов ЦФ в плазме крови, которые достигают максимума через 10 минут после введения препарата и снижаются до нуля через 3 часа [15]. Максимум концентрации реактивных метаболитов наблюдается через 15 мин после двукратного введения ЦФ. Максимальная концентрация реактивных метаболитов при двукратном введении ЦФ была меньше, чем при однократном. Это связано с тем, что изначально ЦФ не обладает ни цитотоксической, ни алкилирующей активностью. Для появления реактивных метаболитов ЦФ нуждается в метаболической активации монооксигеназами печени. Однако при образовании реактивных метаболитов ЦФ они повреждают гепатоциты (в которых находятся монооксигеназы), и активность ферментных систем клеток печени снижается. Полное исчезновение реактивных метаболитов ЦФ в плазме крови экспериментальных мышей наблюдалось через 5 часов при любом режиме введения цитостатика.
Таким образом, изучение фармакокинетики реактивных метаболитов ЦФ показывает, что препарат быстро метаболизируется в печени и обладает выраженным кумулятивным эффектом. Установлено изменение фармакокинетики циклофосфана, снижение уровня его реактивных метаболитов и расширение пика их максимальной концентрации. Трёхкратное введение ЦФ оказывает общетоксическое действие, но не приводит к гибели животных. Продолжительность нарушений позволяет использовать данные режимы для создания модели индуцированной иммуносупрессии [15].
Механизм действия циклофосфана
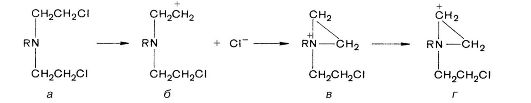
ЦФ относится к хлорэтиламинам, которые в растворах и биологических жидкостях отщепляют ионы хлора. При этом образуется электрофильный карбониевый ион (б), который переходит в этиленимоний (в). Последний также образует функционально активный карбониевый ион (г), взаимодействующий, согласно имеющимся представлениям, с нуклеофильными структурами ДНК (с гуанином, фосфатными, аминосульфгидрильными группами и др.). Таким образом происходит алкилирование субстрата.
Рис. 1 Метаболиты циклофосфана
Взаимодействие алкилирующих веществ с ДНК, в том числе поперечное связывание молекул ДНК, нарушает ее стабильность, вязкость и впоследствии целостность. Все это приводит к резкому угнетению жизнедеятельности клеток и изменению их функциональных свойств [8, 40, 42]. Их способность к делению подавляется, многие клетки гибнут путём апоптоза [24, 35, 36].
Применение циклофосфана в медицине
Циклофосфан широко используется в современной медицине, как средство, тормозящее развитие злокачественных новообразований [1].
Использование циклофосфана при лечении рака легких
Химиотерапию рака легкого назначают при невозможности хирургического вмешательства и лучевой терапии или ее неэффективности, отдаленных метастазах, метастатическом плеврите. Эффективность химиотерапии определяется гистологической структурой опухоли. Циклофосфан может применяться в качестве противоопухолевого препарата в случаях и немелкоклеточного, и мелкоклеточного рака лёгких [2].
Использование циклофосфана при лечении рака шейки матки
С начала 1970-х гг. интенсивно изучаются возможности внедрения в клиническую практику химиотерапевтического лечения и его сочетания с лучевой терапией и/или хирургическим лечением. В первую очередь этому способствовали результаты исследований, которые показали, что цитостатики усиливают лучевое повреждение опухолевых клеток за счёт нарушения механизмов репарации ДНК и способны девитализировать злокачественные клетки, которые резистентны к лучевой терапии. Кроме того, в других исследованиях было показано, что рак шейки матки наиболее чувствителен к цитостатикам перед лучевой терапией или операцией. В связи с этим уменьшение опухолевой массы с помощью использования химиотерапии приводит к увеличению эффективности лучевой терапии.
Согласно недавнему исследованию, которому подвергли 50 препаратов, было выяснено, что применение циклофосфана имеет 15% эффективность (процент означает количество пациенток, у которых наступила ремиссия), что является низкой эффективностью по сравнению с использованием других препаратов. В связи с этим в лечении злокачественных образований шейки матки ЦФ используется не очень часто [9].
Использование циклофосфана при лечении рака молочной железы
Лечебная химиотерапия рака молочной железы проводится в случае генерализованного рака молочной железы (при наличии отдаленных метастазов). Целью этого вида химиотерапии является уменьшение размеров метастатических опухолей [30].
В настоящее время используются следующие схемы лечения рака молочной железы: CMF (Циклофосфан, Метотрексат, Фторурацил), FAC (Фторурацил, Адриабластин, Циклофосфан), CAF (Циклофосфан, Адриабластин, Фторурацил). Таким образом, циклофосфан присутствует в каждой из схем лечения [31].
Побочные эффекты действия циклофосфана
Следует иметь в виду наличие побочных эффектов действия циклофосфана при его применении в терапии злокачественных новообразований. Кроме нарушения роста волос, типичного для химиотерапии, существуют другие изменения связанные с использованием циклофосффана
Все препараты алкилирующей группы характеризуются местно раздражающим действием, воздействуют на ЖКТ, гемопоэз, иногда проявляют нефро- и нейротоксичность. Некоторые препараты мутагенны, в частности, и циклофосфан [25]. Он является сильным канцерогеном в экспериментах на животных. У некоторых пациентов ЦФ вызывал развитие миелокарцином. Описан случай развития карциномы почечной лоханки у пациента, длительное время получавшего циклофосфан [32]. Необходимо помнить об инфекционных заболеваниях, возникающих у пациентов в результате подавления иммунитета, связанного с иммуносупрессирующим действием циклофосфана [45].
В исследовании, проведенном с целью оценки побочных эффектов, возникающих у пациентов, которые проходили курс лечения циклофосфаном, было установлено следующее: из 168 пациентов у 68 наблюдались побочные эффекты со стороны жеудочно-кишечного тракта (понос, рвота), потеря волос отмечена в 38-ми случаях. Кроме того зарегистрировано 58 случаев возникновения инфекций. Также были выявлены единичные случаи аменореи у женщин [43].
Следует обратить внимание на исследование побочных действий циклофосфана в экспериментах на животных [10, 15, 20, 21, 22, 23, 40, 42]. Например, при изучении морфологических изменений в печени крыс с продвинутой стадией развития карциносаркомы на фоне противоопухолевой терапии выявлено, что в печени животных спустя 14 дней после однократного введения циклофосфана наблюдаются дистрофические и некробиотические изменения, связанные с возросшей функциональной нагрузкой на орган [22]. Однако в работе отмечено также, что противоопухолевый эффект циклофосфана обеспечивает снижение степени влияния интоксикации, что выражается в уменьшении застойных явлений в сосудистом русле печени и активации иммунных реакций.
Проведённые исследования показали, что однократное введение ЦФ не влияет на массу тела животных по сравнению с контрольной группой (21,7±2,1). На третьи сутки после двукратного введения ЦФ масса мышей составляла 19,8±1,7 г. Статистически значимое уменьшение массы тела наблюдалось на третьи (до 17,9±1,1 г) и шестые (до 18,7±1,1 г) сутки после трёхкратного введения цитостатика. К двенадцатым суткам при данном режиме введения ЦФ масса тела животных составляла 20,1±1,3 г. Общетоксическое действие ЦФ проявляется в изменении числа лейкоцитов периферической крови. На 3 – 5-й день после введения ЦФ формируется выраженная лейкопения. При двукратном введении ЦФ лейкопения наблюдалась с 3 по 8-й день, а при трёхкратном введении ЦФ возникает стойкая лейкопения, которая держится более 10 суток [15].
В одном из экспериментальных исследований было выяснено, что введение циклофосфана мышам с карциномой легких приводит к торможению роста опухоли и метастазов, однако сопровождается длительной лейкопенией на протяжении всего периода исследования [23].
Комбинации циклофосфана с различными лекарственными препаратами с целью коррекции его иммуносупрессивного воздействия
Ряд экспериментальных исследований на лабораторных животных показали возможности коррекции супрессивного влияния циклофосфана на иммунную систему [4, 5, 6, 7, 14, 18, 19, 20, 28].
Исследовалось действие ЦФ, введёние которого в определённых дозах мышам линии СВА приводило к значительному уменьшению абсолютного количества лимфоцитов в периферической крови и селезенке, изменению структуры органов иммуногенеза, субпопуляционного состава лимфоцитов и снижению их функциональной активности. В работах установлена возможность коррекции изменений, вызванных циклофосфаном, с помощью отечественного бактериального иммуномодулятора Иммуновак ВП-4, который способен дать быстрый нормализующий эффект [5, 6, 20]. Это может иметь большое значение для предупреждения инфекционных осложнений у онкологических больных с проявлениями индуцированной химиопрепаратами иммуносупрессии. Авторы делают вывод о том, что полученные данные о способности Иммуновак ВП-4 стимулировать противоинфекционный и противоопухолевый иммунитет, представляется целесообразным проведение клинических испытаний этого препарата для профилактики нарушений иммунного статуса у онкологических больных после проведения курсов химиотерапии.
Также отмечена возможность совместного применение циклофосфана и стимфорте – иммуномодулирующего препарата животного происхождения. Стимфорте способен восстанавливать структуру центральных и периферических органов лимфопоэза и иммуногенеза, эффекторные функции клеток врожденного иммунитета, которые могут быть нарушенны при введении цитостатика [4, 7].
Исследователями показано, что циклофосфан в комбинации с потенцированым циклофосфаном увеличивает антиметастатическую активность противоопухолевого агента, снижая таким образом риск возникновения метастазов [28].
При изучении возможности использования ЦФ для лечения меланомы кожи было выяснено, что он оказывает положительный эффект в комбинированной иммунотерапии совместно с вакциной БЦЖ, а также тамоксифеном и индометацином. Такая комбинация обеспечивает эффективность в виде ремиссии в 42% случаев и стабилизации процесса – в 35% [13].
Также, введение мелатонина совместно с циклофосфаном при опухолевом росте стимулирует биосинтетическую функцию эпителия концевых отделов поднижнечелюстной слюнной железы [33].
Исследования, связанные с дальнейшим использованием циклофосфана
Следует отметить, что в настоящее время действие циклофосфана в качестве цитостатического препарата активно исследуется, что свидетельствует о его перспективности и вновь открывающихся возможностях использования в медицине. Исследования направлены на поиск эффективного комбинирования препаратов и методов лечения, а также поиск новых областей применения ЦФ.
Установлено, что комбинированное применение красного света и циклофосфана при фотомодифицированной химиотерапии, например, приводит к увеличению его противоопухолевой эффективности [41].
Выявлено, что ЦФ обладает циторедуцирующим эффектом при обработке трансплантанта Кребс-2 [34]. Недавние исследования объясняют связь между потерей веса у раковых больных и введением им совместно циклофосфана и метотрексата [44]. Также проверена на практике возможность использования ЦФ для лечения острых отторжений, возникающих при трансплантациях почек [46].
Таким образом, циклофосфан является достаточно перспективным препаратом в плане его применения в медицине. Это обусловлено не только широким использованием его в клиничекой практике до настоящего времени, но в большей степени научными исследованиями, повышающими его значимость как для теоретической медицины при разработке экспериментальных моделей индуцированной циклофосфаном иммуносупрессии, так и для открытия новых, в том числе комбинированных вариантов его применения в лечебных целях.