Цитрат железа что это такое
Цитрат железа
| Бренд | Название | Кол-во | Цена |
| Deva | Хелат железа для веганов 29 мг | 90 | ₽327.64 |
| Now Foods | Iron | 120 | ₽427.89 |
| Nature’s Way | Iron Chelated | 100 | ₽371.66 |
Как и другие препараты железа, эта добавка используется прежде всего для профилактики и устранения дефицита этого элемента.
Кому необходим минерал цитрат железа
Потребность в дополнительном железе может возникнуть у следующих категорий людей:
Напомним, что из продуктов наше тело способно усвоить в лучшем случае лишь около 10% всего присутствующего в них железа. Именно поэтому людям, попадающим в одну из перечисленных групп риска, важно получать добавки в как можно более биодоступной форме, такой как цитрат железа.
Польза железа в форме цитрата для организма
Железо является важным минералом, необходимым для образования гемоглобина, переносящего кислород к тканям, где он используется для высвобождения энергии из пищи. Железо важно для метаболизма витаминов группы B, меди и кальция, а также для укрепления иммунной системы.
Первыми симптоматическими признаками нехватки железа могут быть боль в мышцах, головная боль, упадок сил, слабость, ломкость ногтей и выпадение волос, субфебрилитет, склонность к простудам.
Цитрат железа и лимонная кислота
Эффективность и безопасность новых железосодержащих фосфатсвязывающих препаратов
У больных с четвертой-пятой стадией хронической болезни почек (ХБП) персистирующая гиперфосфатемия индуцирует кальцификацию сосудов, усугубляет проявления вторичного гиперпаратиреоза, увеличивает сердечно-сосудистую и общую смертность. Кроме того, сопутствующее повышение в сыворотке фактора роста фибробластов (fibroblast growth factors) 23-го типа независимо от артериальной гипертензии вызывает гипертрофию левого желудочка, которая является самостоятельным фактором риска сердечно-сосудистых осложнений [1–4].
Гиперфосфатемия обычно развивается при скорости клубочковой фильтрации (СКФ) менее 20 мл/мин. При потреблении 1000 мг/сут фосфата и его 60%-ной фракционной абсорбции в желудочно-кишечном тракте еженедельная нагрузка фосфором составляет 4200 мг [5]. Тремя процедурами гемодиализа из организма больных еженедельно элиминируется 3171 мг фосфата, при этом пациенты задерживают 150 мг фосфора в неделю [6].
Коррекция гиперфосфатемии и поддержание нейтрального баланса фосфора диетой с потреблением белка до 1,4 г/кг массы тела, рекомендуемой пациентам на заместительной почечной терапии, практически невозможны, а снижение уровня неорганического фосфата (Pi) во время стандартной процедуры диализа быстро восполняется поступлением фосфата в циркуляцию из внутриклеточного пула. Назначаемые диализным больным метаболиты витамина D, за исключением парикальцитола, повышают всасывание фосфора в желудочно-кишечном тракте, оправдывая применение фосфатбиндеров, которые предупреждают всасывание фосфата, связывая его в кишечнике.
Исторически одними из первых фосфатбиндеров, или, как называются эти препараты в отечественных рекомендациях по лечению минеральных и костных нарушений при ХБП, фосфатсвязывающие препараты (ФСП), были соли алюминия, образующие нерастворимые соединения Pi в кишечнике при различных значениях pH. От солей алюминия через несколько лет пришлось отказаться, поскольку они вызывали алюминиевую деменцию и ряд других тяжелых осложнений [7, 8].
В силу доступности и низкой стоимости в качестве ФСП используют соли кальция – карбонат и ацетат кальция, прием которых нередко сопровождается эпизодами гиперкальциемии и усилением метастатической кальцификации. В этой связи их суточное потребление, согласно тем же рекомендациям, не должно превышать 1,5 г элементарного кальция, что, как правило, недостаточно для достижения целевых значений Pi в сыворотке [9, 10].
Стоимость лантана карбоната – одного из современных ФСП – намного превышает стоимость кальциевых ФСП при еще не установленных последствиях накопления лантана в печени и других органах. Не рекомендуется также назначать лантана карбонат при заболеваниях кишечника и лицам моложе 18 лет. По данным метаанализа, проведенного W.F. Finn, при длительном приеме лантана карбоната (более двух лет) до 70% больных выбывают из исследования [11].
Наиболее часто в России в качестве ФСП применяется севеламера гидрохлорид, распределяемый среди диализных больных в соответствии с региональными программами. Севеламер, доступный для широкого использования с 1997 г., представляет собой ионообменную смолу, не содержащую кальция и алюминия, способную связывать фосфат в обмен на высвобождение ионов хлора. В отличие от кальциевых ФСП прием севеламера не сопровождается повышением кальция в сыворотке крови и не усугубляет метастатическую кальцификацию. Теоретически 4,8 г севеламера (суточная доза) могут связать в кишечнике 1100 мг фосфата, однако сорбируют только 200 мг, поскольку конкурентно взаимодействуют и с другими ионами [12].
Наряду с фосфором севеламер снижает произведение концентраций ионов Ca и Pi в сыворотке, активность костного изофермента щелочной фосфатазы, уровень паратгормона, общего холестерина и холестерина липопротеинов низкой плотности, фактора роста фибробластов 23-го типа, С-реактивного белка и конечных продуктов гликирования. Особая роль севеламера в повышении выживаемости диализных больных связана с его способностью замедлять и предупреждать кальцификацию коронарных сосудов, что снижает общую и сердечно-сосудистую смертность и частоту госпитализаций [13–16]. В то же время применение севеламера ассоциировано с необходимостью приема большого числа таблеток, появлением диспепсии, несоблюдением во многих случаях рекомендованной схемы лечения, что препятствует достижению целевых значений Pi в сыворотке. Согласно данным Y. Chiu и соавт., больным на гемодиализе нередко приходится принимать более 25 таблеток в день (в среднем 19) и почти половина этого количества приходится на ФСП [10]. Это не только не формирует приверженность лечению, но и ухудшает качество жизни. На фоне систематического приема севеламера гидрохлорида усугубляется метаболический ацидоз вследствие высвобождения ионов хлора при связывании фосфата, а молекулы севеламера могут сорбировать метаболиты витамина D, усиливая дефицит кальцитриола.
Еще в конце прошлого века было установлено, что нерастворимое полинуклеарное соединение железа (III) оксигидроксида способно связывать фосфат и использоваться для коррекции гиперфосфатемии у больных ХБП аналогично другим широко применяемым ФСП [17]. У человека 1,0 г этого соединения связывает приблизительно 1,33 ммоль фосфата [18].
In vitro из раствора, содержащего 1 моль Fe и 0,4 моля Pi, полинуклеарное соединение железа (III) оксигидроксида сорбирует 0,0063 ммольРi/мгFe. Изменение рН раствора от 3 до 8 изменяет сорбционную способность менее чем на 3%, а добавление в раствор кальция ацетата не влияет на абсорбцию. Полинуклеарное соединение железа (III) оксигидроксида не растворяется при температуре 37 °С и практически не усваивается организмом: у голодающих и не голодающих белых мышей утилизируется соответственно 0,55 и 0,46% введенного 59 Fe 3+ оксигидроксида.
В 1999 г. в открытом неконтролируемом исследовании O. Hergessell и E. Ritz назначили 13 больным с креатинином сыворотки 5,4 ммоль/л и уровнем фосфата 2,2 ммоль/л полинуклеарное соединение железа оксигидроксида (stabilized polynuclear iron oxyhydroxide) в дозе 2,5 г три раза в день, курс – четыре недели [18]. Важным условием было одинаковое потребление фосфора с пищей. После двух недель приема содержание Pi в сыворотке снизилось на 20%, а его выведение с мочой – на 37%, причем эти значения с небольшими вариациями сохранялись до конца исследования. Среди побочных эффектов отмечали изменение цвета кала и умеренно выраженную диарею. Содержание в сыворотке паратгормона, метаболитов витамина D, ферритина и железа не изменялось.
Железа (III) оксигидроксид (sucroferric oxyhydroxide), получивший название Velphoro, или PA21, был разрешен к применению Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в качестве ФСП у больных на гемодиализе в ноябре 2013 г. и предварительно апробирован в ряде клинических исследований.
В 2010 г. P. Geisser и E. Philipp в течение семи дней назначали PA21 в дозе 10 г/сут восьми больным на гемодиализе, восьми пациентам с преддиализной хронической почечной недостаточностью (ХБП третьей-четвертой стадии) и восьми здоровым испытуемым [19]. Содержание Pi в сыворотке снизилось у больных на гемодиализе с 2,85 до 2,15 ммоль/л, у пациентов с ХБП – с 1,44 до 1,10 ммоль/л. Утилизация 59 Fe из препарата была 50%. Основными побочными реакциями во время приема железа цитрата были потемнение стула, запоры, метеоризм. Было установлено, что доза железа цитрата 4,5 г/сут не снижает уровень Pi в сыворотке диализных больных.
В исследовании J. Dwyer и соавт. (2013) доза железа цитрата зависела от уровня Pi в сыворотке [28]. Пациенты с содержанием Pi в сыворотке 7,3 мг/дл получали препарат в дозе 1 г/сут, 7,6 мг/дл – 6,0 г/сут и 7,5 мг/дл – 8 г/сут. Лечение проводилось в течение 28 дней, всего под наблюдением находился 181 больной. Снижение Pi в сыворотке составило по группам 0,1, 1,7 и 2,1 мг/дл. Как и при применении других ФСП, гипофосфатемический эффект железа цитрата был дозозависимым.
Железа цитрат снижал фосфор сыворотки и у больных с ХБП четвертой стадии. K. Yokoyama и соавт. (2014) назначали плацебо или железа цитрат на 12 недель 90 больным со СКФ 9,21 мл/мин [29]. В результате лечения уровень Pi в сыворотке снизился в среднем на 1,29 мг/дл (в группе плацебо на 0,06 мг/дл), а целевые значения Pi (2,5–4,5 мг/дл) были достигнуты у 64,9% пациентов (в группе плацебо у 6,9%). У получавших ФСП снижался уровень фактора роста фибробластов 23-го типа и значимо повысился уровень железа в сыворотке, ферритина и насыщение трансферрина. Побочные реакции в виде желудочно-кишечного дискомфорта отмечены у 30% пациентов, лечившихся железа цитратом, и у 26,7%, получавших плацебо.
В настоящее время подведены предварительные итоги третьей фазы открытого рандомизированного исследования безопасности и эффективности железа цитрата [30]. В исследование был включен 441 пациент, находившийся на диализе. Больные были рандомизированы в отношении 2:1 и получали в течение 52 недель в качестве ФСП железа цитрат, севеламера карбонат или кальция ацетат (Phoslo), а последние четыре недели – плацебо. Контрольную группу составили 149 пациентов. В среднем больные принимали по шесть капсул препарата, каждая из которых содержала 1,0 г железа цитрата. По эффективности (снижение фосфора сыворотки) железа цитрат не уступал севеламера карбонату и кальция ацетату и значимо превосходил плацебо. Одновременно у больных на 47% вырос уровень ферритина сыворотки и на 24% увеличилось насыщение железом трансферрина, что позволило сократить в/в введение препаратов железа и снизить дозу эритропоэтина. Число побочных реакций значимо не различалось в основной группе и в группе контроля. Основываясь на полученных данных, в качестве стартовой дозы авторы рекомендовали две таблетки железа цитрата во время каждого приема пищи (в сутки восемь таблеток). Не следует начинать лечение у больных с признаками перегрузки железом, а если перегрузка возникает во время лечения, необходимо переходить на прием других ФСП.
Данные приведенных исследований свидетельствуют, что наряду с уже известными апробированными ФСП появились новые препараты аналогичного действия. Они не уступают прежним по эффективности и безопасности при длительном употреблении, а также снижают лекарственную нагрузку, обеспечивая большую приверженность назначаемому лечению и улучшая качество жизни больных.
Биодоступность железа и влияние ионов кальция на ее эффективность
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям, 20% железа является резервным (костный мозг, печень, макрофаги), 4% входит в состав миоглобина, около 1% содержится в дыхательных ферментах, катализирующих процессы дыхания в клетках и тканях, а также в других ферментативных структурах. Железо осуществляет свою биологическую функцию, находясь в составе биологически активных соединений, преимущественно ферментов. Железосодержащие ферменты выполняют следующие основные функции:
Железо обладает несколькими особыми свойствами, которые отличают его от других биологически активных ионов и веществ.
В организме человека нет никаких специальных механизмов для выведения железа. В основном железо выделяется через кожу и кишечник (I. Guinote et al., 2006). Кроме этого, оно теряется также с волосами, ногтями, мочой и потом. Общее количество выделяемого железа у здорового человека (мужчины) составляет около 1 мг в сутки. Такое же количество в норме усваивается из потребляемой пищи (Linder, 1991). Отличие составляет менструальный период, когда потребление должно составлять около 4 мг железа в день. Таким образом, концентрация элемента в сыворотке крови зависит от его всасывания в желудочно-кишечном тракте, от накопления в селезенке, костном мозге и скелетных мышцах (миоглобин), а также от синтеза и распада гемоглобина и выделения его из организма. В пище железо может присутствовать в двух видах — гемовое и негемовое, которые характеризуются разными механизмами всасывания. Гемовое железо (порфириновое кольцо с атомом железа в центре, связанное с 4 атомами азота) в желудочно-кишечном тракте освобождается от белковых цепей и в виде металлопорфирина всасывается энтероцитами кишечника. Там происходит неспецифическое эндосомальное проникновение гема в клетку с последующим его разрушением. Далее, с помощью белковой транспортной системы IREG1, ионы железа окисляются до трехвалентного железа, связываются с трансферрином и покидают энтероцит, выходя в ток крови (Linder et al., 2006). В плазме крови железо перемещается в соединении с этим же белком, который выполняет как функцию депо, так и функцию переносчика. Наличие свободных ионов железа в крови не характерно и является патологией. Всасывание гемового железа происходит в пределах 15–50% (в среднем 20–30%).
В литературе описывается несколько механизмов транспортировки железа внутри энтероцита, основанные главным образом на экспериментах, проведенных на культуре ткани Caco2 (M. Linder et al., 2006). Согласно первой теории, двухвалентное железо, поступившее в энтероцит с помощью транспортера DMT1, доставляется посредством везикул с трансферрином (некоторые отводят ему роль внутриклеточного рецептора) или в свободном состоянии к базолатеральной мембране энтероцита, где присутствует другой транспортер — IREGI/ferroportin/MTP1 (Donovan et al., 2000). Этот транспортер окисляет двухвалентное железо до трехвалентного и транспортирует в кровь, где он соединяется с плазменным трансферрином. Согласно второй теории, внутри энтероцита железо транспортируется, по-видимому, в везикулах вместе с апотрансферрином, который путем эндоцитоза попадает из тока крови в энтероцит (эндо-/экзоцитоз) (Ma et al., 2002). Во время этой транспортировки двухвалентное железо окисляется до трехвалентного и путем экзоцитоза поступает через базилярную мембрану энтероцита в кровь. В этом процессе возможно участие уже упоминавшейся системы IREG. Согласно литературным данным, именно механизм транспорта железа через базолатеральную мембрану энтероцита в кровь является лимитирующим в процессе адсорбции железа (Roy and Enns, 2000). Усвоение неорганического двухвалентного железа обычно происходит в пределах 6–15%.
Негемовое трехвалентное железо может быть восстановлено с помощью ферриредуктазы до двухвалентного железа и усвоено с помощью DMT1. Восстановление трехвалентного железа сильно зависит от кислотности желудочного сока. Невосстановленное железо может всасываться с помощью специфической интегрин-мобифериновой системы IMP. Усвоение трехвалентного железа происходит наименее полно и редко превосходит 4%.
Количество железа, поступающего в эффекторную клетку, куда оно транспортируется с кровью, прямо пропорционально числу мембранных рецепторов. В клетке происходит высвобождение железа из трансферрина. Затем плазменный апотрансферрин возвращается в циркуляцию. Повышение потребности клеток в железе при их быстром росте или синтезе гемоглобина ведет к индукции биосинтеза рецепторов трансферрина и, напротив, при повышении запасов железа в клетке число рецепторов на ее поверхности снижается. Железо, высвободившееся из трансферрина внутри клетки, связывается с ферритином, который доставляет микроэлемент в митохондрии, где он включается в состав гема. Помимо синтеза гема, двухвалентное железо используется в митохондриях для синтеза железосерных центров. В организме человека происходит постоянное перераспределение железа. В количественном отношении наибольшее значение имеет метаболический цикл: плазма — красный костный мозг — эритроциты — плазма. Обычно 70% плазменного железа поступает в костный мозг. За счет распада гемоглобина в сутки высвобождается около 21–24 мг железа, что во много раз превышает поступление железа из пищеварительного тракта (1–2 мг/сут).
Существует выраженная обратная зависимость между обеспеченностью организма железом и его всасыванием в пищеварительном тракте. В основном всасывание железа происходит в двенадцатиперстной кишке и проксимальных отделах тощей кишки и отсутствует в подвздошной кишке.
Всасывание железа зависит от следующих причин: возраста, обеспеченности организма железом, состояния желудочно-кишечного тракта, количества и химических форм поступающего железа и прочих компонентов пищи. Для оптимального всасывания железа необходима нормальная секреция желудочного сока. Прием соляной кислоты способствует усвоению железа при ахлоргидрии. В таблице приведены основные вещества, содержащиеся в продуктах питания человека, которые могут активизировать или уменьшать всасывание железа, содержащегося в этих продуктах или мультивитаминной таблетке. Аскорбиновая кислота, восстанавливающая железо и образующая с ним хелатные комплексы, повышает доступность этого элемента так же, как и другие органические кислоты. Она является одним из наиболее сильных стимуляторов всасывания железа. Другим компонентом пищи, повышающим всасывание железа, является «фактор животного белка», в котором содержится миоглобин и гемоглобин. Улучшают всасывание железа простые углеводы: лактоза, фруктоза, сорбит, а также такие аминокислоты, как гистидин, лизин, цистеин, образующие с железом легковсасываемые хелаты.
Самыми сильными ингибиторами, блокирующими всасывание железа, являются фитаты и полифенолы. Фитаты представляют собой форму хранения фосфатов и минералов, присутствующих в зернах злаковых растений, овощах, семенах и орехах. Они активно тормозят всасывание железа, действуя при этом в прямой зависимости от дозы. Всасывание железа снижают такие напитки, как чай, содержащий таннин, а также другие полифенольные соединения, которые прочно связывают этот элемент. Феноловые соединения существуют почти во всех растениях и являются частью системы защиты против насекомых и животных. Поэтому чай применяют для профилактики повышенного усвоения железа у больных талассемией. Большое влияние на усвоение железа оказывают различные заболевания. Оно усиливается при недостаточности железа, при анемиях (гемолитической, апластической, пернициозной), гиповитаминозе В6 и гемохроматозе, что объясняется повышением эритропоэза, истощением запасов железа и гипоксией.
Из перечисленных веществ, которые могут уменьшать всасывание железа, особое внимание обращает на себя ион кальция. Кальций обладает высокой биологической активностью, в значительном количестве содержится в основных продуктах питания и, как правило, присутствует в одной мультивитаминной таблетке с железом.
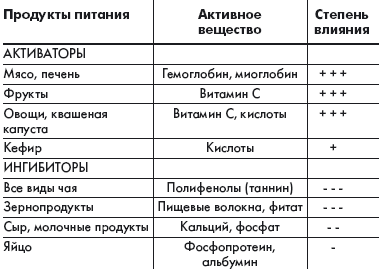 |
| Таблица. Активаторы и ингибиторы всасывания железа, содержащиеся в пищевом рационе человека |
В связи с этим вопрос о возможном влиянии кальция на биодоступность железа изучается длительное время как в экспериментах на животных, так и в исследованиях на людях.
Необходимо отметить, что клеточные механизмы всасывания, т. е. поступления ионов железа и кальция из просвета кишечника в ток крови через энтероциты кишечника, различны. Многочисленными работами было показано, что в этом процессе участвуют различные клеточные транспортеры (J. Hoenderop et al., 2005). Кроме того, имеются данные о том, что кальций уменьшает поступление в организм как гемового (L. Hallberg, 1991), так и негемового железа. Все вместе указывает на то, что кальций может влиять на биодоступность железа, оказывая ингибирующее влияние либо на транспорт его в желудочно-кишечном тракте, либо на связывание с рецепторами, расположенными на апикальной мембране энтероцитов.
В экспериментах на изолированный кишечной петле в условиях in vivo на крысах было показано уменьшение всасывания железа из раствора FeCl2, вводимого непосредственно в петлю при добавлении кальция. Причем эффект зависел от абсолютной концентрации кальция в двенадцатиперстной кишке, а не от молярного соотношения Ca/Fe (Barton et al., 1983). Изучение влияния на клеточный транспорт железа различных солей, содержащих кальций, показало, что наибольший ингибирующий эффект вызывает СаСО3, в то время как эффекты СаSO4 и Na2CO3 присутствуют, но в меньшей степени (Prather, 1992). Эта кальциевая соль, добавленная в количестве 500 мг, способна уменьшить всасывание негемового железа, содержащегося в пищевых продуктах на 32% в случае потребления пищи, не содержащей дополнительные ингибирующие вещества, и на 42% при потреблении продуктов в сочетании с яйцами, кофе и др. (Сook et al., 1991). СaCO3 уменьшает также всасывание железа при совместном использовании их в одной таблетке. В этом случае 300 мг кальциевой соли при совместном употреблении с 37 мг железа, присутствующего в виде FeSO4, уменьшает всасывание железа на 15% (Seligman et al., 1983; Cook et al., 1991).
930 мг кальция в день). Это привело к снижению абсорбции железа на 30–50% (Hallberg, 1995). На основании полученных данных авторы предполагают, что ингибирование всасывания железа происходит на этапе «просвет кишечника — энтероцит».
В исследованиях на людях также изучалось влияние искусственных минеральных добавок: сульфата железа, цитрата и фосфата кальция и др. Работа была проведена на 61 здоровом испытуемом. Для оценки всасывания использовался также двойной радиоизотопный метод. При употреблении цитрата кальция (600 мг) абсорбция железа снижалась на 49%, фосфата — на 62% (Cook et al., 1991). Интересно, что в этом исследовании эффект от применения кальциевых добавок отмечался только на фоне употребления пищи. Вероятно, конкуренция между катионами возникала при заполненном кишечнике. Теоретически возможно, что высокие концентрации кальция могут изменять реологические свойства пищевого комка в просвете верхней части тонкого кишечника (Conrad et al., 1993). На людях также изучалось различие во влиянии кальция на потребление гемового и негемового железа. Так, в исследованиях на 27 добровольцах с применением полного промывания кишечника для измерения степени усвоения железа при использовании кальциевых добавок (450 мг) было показано снижение абсорбции только гемового железа на 20%. В этой работе добавление кальция не влияло на абсорбцию негемового железа (Z. K. Roughead, 2005). В другом исследовании, проведенном на 44 мужчинах и 81 женщине, наблюдали снижение всасывания гемового железа из рациона при добавлении кальция в дозах от 40 до 300 мг. Максимальное снижение наблюдалось при дозе 300 мг и составило 74%. Дальнейшее увеличение содержания кальция до 600 мг не приводило к возрастанию ингибирования иона железа (L. Hallberg et al., 1991). Противоречивые результаты, получаемые в разных работах, связаны, по-видимому, со сложностью воспроизведения точности методических подходов, проводимых на людях.
Во всех приведенных выше исследованиях было показано в той или иной мере уменьшение абсорбции железа в желудочно-кишечном тракте на 20–60% при совместном употреблении с кальцийсодержащими продуктами в ходе однократного приема пищи или таблетированных препаратов. Характерно, что использованные дозы кальция не превышали дневную норму взрослого человека (во всех описанных случаях суммарное поступление кальция за сутки было меньше 1000 мг). Однако непосредственный механизм антагонистического влияния кальция на всасывание железа остается неясным.
Серия исследований, проведенных на добровольцах при длительном совместном приеме пищи, содержащей определенное количество железа и кальция, не позволила получить однозначного ответа о влиянии иона кальция на биодоступность железа, а главное — на уровень гемоглобина у этих испытуемых. Часто эффект выявлялся (ингибирование составляет 19%), но был статистически недостоверен (Reddy et al., 1997). По-видимому, длительные исследования на людях осложняются контролем над соблюдением диеты и составлением диеты для контрольной группы (S. R. Lynch, 2000).
Анализ литературы позволяет заключить, что экспериментальные исследования на животных и работы, проведенные на испытуемых, подтвердили, что ионы кальция способны уменьшать уровень всасывания железа. Степень выявления эффекта зависела от используемых методических подходов, которые в разных работах отличались друг от друга, и это затрудняет интерпретацию результатов. Однако возможность таких взаимодействий может быть наиболее актуальна и должна безусловно учитываться для людей, страдающих железодефицитными состояниями (анемии) или входящих в группу риска по этому состоянию (дети, беременные и т. д.). Для лечения и профилактики таких состояний необходимо увеличить потребление железа, как за счет соблюдения соответствующей диеты, так и с помощью минеральных добавок. Но следует помнить, что эффективность этих мер может значительно снижаться на фоне потребления диетического кальция или кальцийсодержащих витаминных комплексов. Ограничивать потребление кальция не желательно, поскольку во многих случаях (беременность, возраст 12–18 лет) существует повышенная потребность в обоих элементах. Выходом из ситуации может служить раздельное применение кальция и железа. Экспериментальные данные показали, что интервал между приемом кальция и железа даже в 4 ч исключает эффект ингибирования (A. Gleeprup et al., 1993). Помимо этого, во время приема препарата железа стоит воздержаться от употребления любых продуктов, содержащих кальций, т. е. требуется исключить весь спектр молочной продукции, а также зеленые части растений.
В данном случае удобно применять витаминно-минеральные комплексы, которые заранее предусматривают раздельное употребление железа и кальция. И это не единственное сочетание жизненно важных микронутриентов, проявляющих антагонистические свойства. Таким образом, грамотное разделение компонентов витаминно-минеральных комплексов по времени приема является необходимым условием эффективности их применения.
Литература
Н. А. Медведева, доктор биологических наук, профессор
МГУ, Москва