в патогенезе остеоартрита ведущее значение принадлежит
ОСТЕОАРТРОЗ: патогенез, клиника, лечение
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
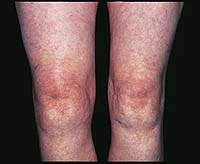 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
Неоднородность причин, механизмов развития, клиники и исходов позволяют предположить, что остеоартроз (ОА) — собирательное понятие, включающее в себя несколько заболеваний, что затрудняет выбор акцентов терапии. ОА является наиболее распространенной формой суставной патологии, им болеет 10-12% населения. По данным многоцентровых эпидемиологических исследований, распространение ОА среди населения бывшего СССР соответствовало 6,4% и коррелирует с возрастом. По данным ревматологов Европы и США, на долю этого заболевания приходится до 69-70% всех ревматических болезней. Частота встречаемости ОА в семьях больных в два раза выше, чем в популяции, причем риск развития ОА у лиц с врожденными дефектами опорно-двигательного аппарата повышен в 7,7 раза, у лиц с избыточным весом — в два раза.
Патогенез
В основе патогенеза ОА лежат нарушения молекулярной структуры гиалинового хряща. Суставной хрящ представляет собой высокоспециализированную ткань, в которой происходят процессы ремоделирования, включающие как деградацию, так и синтез экстрацеллюлярного матрикса, составляющего основу хрящевой ткани. Особое значение для нормального функционирования хряща имеет соотношение в ткани коллагена, протеогликанов, неколлагеновых гликопротеинов и воды. Ключевая роль при этом отводится хондроцитам — высокодифференцированным клеткам хрящевой ткани, которые по невыясненным до конца причинам при ОА начинают продуцировать «неполноценные» низкомолекулярные белки матрикса (межуточной ткани хряща), что снижает амортизационные свойства хряща. Хондроцит обладает значительной чувствительностью к содержанию протеогликанов в окружающем матриксе хряща и быстро реагирует на их изменения. Состояние хряща зависит от равновесия анаболических и катаболических процессов, причем интенсивность катаболических процессов усиливают цитокины (интерлейкин-1, фактор некроза опухоли-α), циклооксигеназа-2, металлопротеиназы (коллагеназа, стромелизин), продуцируемые как хондроцитами, так и клетками синовиальной оболочки и субхондральной кости. С другой стороны, для восстановления хрящевой ткани важна синтетическая репаративная активность хондроцитов. Здесь большое значение придается факторам роста, особенно инсулиноподобному и трансформирующему, а также морфогенетически измененным костному и хрящевому белкам.
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
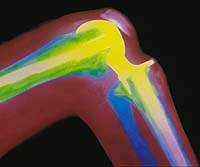 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Костные суставные поверхности, лишенные амортизации из-за деструкции хрящевой ткани, испытывают повышенную и неравномерную механическую нагрузку. В субхондральной кости появляются зоны динамической перегрузки, которые вызывают перераспределительные нарушения микроциркуляции. Это способствует возникновению субхондрального остеосклероза, кистовидной перестройки, изменению кривизны суставных поверхностей и образованию краевых костно-хрящевых разрастаний — остеофитов.
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Клиническая картина
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Кратковременная «стартовая» боль возникает после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит — фрагменты хрящевой и костной деструкции. При первых движениях в суставе детрит выталкивается в завороты суставной сумки, и боли значительно уменьшаются или прекращаются полностью.
Прогрессирующий фиброз сутавной капсулы ведет к сдавлению нервных окончаний, результатом чего являются боли при определенных движениях, связанные с растяжением капсулы. Реактивный тендобурсит также влияет на зависимость возникновения боли от конкретных движений. При этом часто наблюдаются характерные для сустава болевые зоны, определяющиеся пальпаторно, например, область «гусиной лапки» — внутренняя поверхность коленного сустава.
Возможна так называемая «блокада сустава» или «застывший сустав» — резко выраженный быстро развивающийся болевой синдром вследствие появления «суставной мыши» — костного или хрящевого фрагмента с ущемлением его между суставными поверхностями или внедрением остеофита в мягкие околосуставные ткани. Интенсивность боли при этом лишает пациента возможности сделать малейшее движение в данном суставе.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений параартикулярных тканей. На ранней стадии ОА нарушения функции сустава обусловлены болевым синдромом и рефлекторным спазмом мышц. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты, внутрисуставные «свободные тела» и нарушение конгруэнтности суставных поверхностей.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Неинвазивные методы исследования
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Современные патогенетические подходы к лечению остеоартроза
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Немедикаментозная терапия
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
Медикаментозная терапия
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
Препараты с хондропротективными свойствами
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
Локальная стероидная терапия
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Реабилитационные мероприятия
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
Лечебная физкультура преследует те же цели, что и массаж, и осуществляется по принципу: легкая динамическая нагрузка при полной статической разгрузке. Крайне ошибочными являются нередко встречающиеся советы усиленно разрабатывать сустав, «разгонять соли, превозмогая боль» — это часто провоцирует болевой спазм параартикулярных мышц с нарушением трофики, вызывает обострение синовита и в конечном итоге усугубляет течение ОА.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Профилактика остеоартроза
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Остеоартроз
Общая информация
Краткое описание
Общероссийская общественная организация «Ассоциация ревматологов России»
Федеральные клинические рекомендации по диагностике и лечению остеоартроза
МКБ-10: М15–М19 Артрозы
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
| Первичный (идиопатический) | Локализованный (поражение менее 3 суставов) — Суставы кистей — Суставы стоп — Коленные суставы — Тазобедренные суставы — Позвоночник — Другие суставы Генерализованный (поражение 3 групп суставов и более) — Эрозивный |
| Вторичный | — Посттравматический — Врождённые, приобретённые, эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.) |
— Метаболические болезни ( охроноз, гемохроматоз, болезнь Вильсона—Коновалова, болезнь Гоше)
— Эндокринопатии ( акромегалия, гиперпаратиреоз, сахарный диабет, гипотиреоз)
— Болезнь отложения кальция (пирофосфат кальция, гидроксиапатит)
— Невропатии (болезнь Шарко)
— Другие заболевания (остеонекроз, ревматоидный артрит, болезнь Педжета и др.)
Диагностика
Диагностика
Диагноз ОА устанавливается на основании жалоб и анамнестических данных больного, клинико-инструментального исследования и исключения других заболеваний. Важным фактором диагностики является тщательный сбор анамнеза, позволяющий выделить определенные причины (факторы риска) развития ОА.
Факторы риска, связанные с развитием ОА
| Факторы | Описание |
| Системные | Возраст |
| Пол | |
| Раса | |
| Гормональный статус | |
| Генетические факторы | |
| Минеральная плотность кости | |
| Витамин Д | |
| Локальные | Предшествующее повреждение сустава |
| Слабость мышц | |
| Неправильная ось сустава | |
| Гипермобильность | |
| Внешние факторы | Ожирение |
| Избыточная нагрузка суставов | |
| Спортивная физическая нагрузка | |
| Профессиональные факторы |
Клиническая картина
Чаще в процесс вовлекаются суставы, подвергающиеся большой нагрузке (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые суставы, первый пястно-запястный сустав) и позвоночник. Большое значение имеет поражение тазобедренных и коленных суставов, являющееся основной причиной снижения качества жизни и инвалидизации больных, страдающих ОА.
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
Характер болей разнообразный, но, как правило, механический, т.е. боли усиливаются при физической активности и ослабевают в покое. О наличии воспалительного компонента в происхождении болей может свидетельствовать внезапное без видимых причин их усиление, появление ночных болей, утренней скованности (чувство вязкости, геля в поражённом суставе), припухлости сустава (признак вторичного сино-вита). Иногда интенсивность боли меняется в зависимости от погодных условий (усиливается в холодное время года и при высокой влажности) и атмосферного давления, оказывающего влияние на давление в полости сустава. Гонартроз и коксартроз имеют определённые клинические особенности:
— При поражении коленного сустава боли возникают при ходьбе (особенно при спуске по лестнице), локализуются по передней и внутренней поверхностям коленного сустава и усиливаются при сгибании, наблюдается слабость и атрофия четырехглавой мышцы, определяется болезненность при пальпации проекции суставной щели и/или периартикулярных областей (область «гусиной лапки»). У 30—50% больных развивается деформация коленного сустава с отклонением его кнаружи (genu varum), нестабильность сустава.
— При поражении тазобедренного сустава в начале заболевания боли локализуются не в области бедра, а в колене, паху, ягодице, усиливаются при ходьбе, стихают в покое, определяется ограничение и болезненность при внутренней ротации сустава в согнутом положении. Наблюдается атрофия ягодичных мышц, болезненность при пальпации паховой области латеральнее места пульсации бедренной артерии, укорочение ноги.
• Увеличение объёма сустава чаще происходит за счёт пролиферативных изменений (остеофитов), но может быть и следствием отёка околосуставных тканей. Особенно характерно образование узелков в области дистальных (узелки Гебердена) и проксимальных (узелки Бушара) меж-фаланговых суставов кистей. Выраженная припухлость и локальное повышение температуры над суставами возникает редко, но может появляться при развитии вторичного синовита. Постепенно развиваются деформации конечностей (варусная деформация коленных суставов, «квадратная» кисть, узелки Гебердена и Бушара соответственно в дистальных и проксимальных межфаланговых суставах кистей).
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
Лабораторные исследования
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
— Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
— Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
— Для выявления воспаления необходимо исследовать СОЭ и С-реактивный протеин. Умеренное повышение характерно для вторичного синовита на фоне ОА. Выраженное повышение свидетельствует о другом заболевании.
— Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
Инструментальные исследования
Рентгенологическое исследование — наиболее достоверный метод диагностики ОА, который выявляет сужение суставной щели, краевые остеофиты и заострение мыщелков большеберцовой кости, субхондральный склероз.
При подозрении на ОА коленных суставов рентгеновский снимок делается в передне-задней и боковой проекциях в положении стоя, для исследования пателло-феморального сустава – снимок в боковой проекции при сгибании (В).
При подозрении на ОА тазобедренного сустава необходимо проводить рентгенологическое исследование костей таза с захватом обоих тазобедренных суставов (уровень С).
Классификация рентгенологических изменений при остеоартрите Келлгрена и Лоуренса (1957)
| 0 | Изменения отсутствуют |
| I | Сомнительные рентгенологические признаки |
| II | Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты) |
| III | Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты) |
| IV | Выраженные изменения (суставная щель почти не прослеживается, выявляются грубые остеофиты) |
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Молодой возраст
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Планируемая консультация ортопеда
‒ Неэффективность адекватной консервативной терапии
Повторное рентгенологическое исследование суставов при ОА должно использоваться только в клинических целях. Повторное рентгенологическое исследование суставов при ОА проводится при подозрении на присоединение новой патологии или планируемое хирургическое вмешательство на суставе(при направлении на консультацию к ортопеду).
Диагностические критерии
Таблица . Классификационные критерии остеоартроза (Альтман и др., 1991)
| Клинические | Клинические, лабораторные, рентгенологические |
| Коленные суставы | |
| 1. Боль | 1. Боль |
| и | и |
| 2а. Крепитация | 2. Остеофиты |
| 2б. Утренняя скованность | или |
| 2в. Возраст | 3а. Синовиальная жидкость, характерная для ОА (или возраст |
| или | |
| 3а. Крепитация | 3б. Утренняя скованность |
| 3б. Утренняя скованность | 3в. Крепитация |
| 3в. Костные разрастания | |
| или | |
| 4а. Отсутствие крепитации | |
| 4б. Костные разрастания | |
| Чувствительность 89% | Чувствительность 94% |
| Специфичность 88% | Специфичность 88% |
| Тазобедренные суставы | |
| 1. Боль | 1. Боль |
| и | и не менее 2-х из 3 критериев |
| 2а. Внутренняя ротация | 2а. СОЭ |
| 2б. СОЭ 115°) | 2б. Остеофиты |
| или | 2в. Сужение суставной щели |
| 3а. Внутренняя ротация 50 лет 3г. Боль при внутренней ротации | |
| Чувствительность 86% | Чувствительность 89% |
| Специфичность 75% | Специфичность 91% |
| Суставы кистей | |
| 1. Боль продолжительная или скованность 2. Костные разрастания 2-х и более суставов из 10 оцениваемых* 3. Менее 2 припухших пястно-фаланговых суставов 4а. Костные разрастания, включающие 2 и более дистальных межфаланговых сустава** (2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а) | |
| или | |
| 4б. Деформация одного и более суставов из 10 оцениваемых* | |
| Чувствительность 93% Специфичность 91% | |
Примечания. * — 2-й и 3-й дистальные межфаланговые суставы; 2-й и 3-й проксимальные межфаланговые суставы; 1-й запястно-пястный сустав обеих кистей. ** — 2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а
Дифференциальный диагноз
Диагностика ОА с учётом диагностических критериев трудностей не вызывает. Тем не менее, каждую клиническую ситуацию необходимо проанализировать с точки зрения возможности вторичного происхождения ОА.
Заболевания, с которыми необходимо проводить дифференциальную диагностику ОА
| Анкилозирующий спондилоартрит | Псевдоподагра |
| Реактивный артрит | Псориатический артрит |
| Подагра | Ревматоидный артрит |
| Инфекционный артрит | Фибромиалгия |
| Ревматическая полимиалгия | Диабетическая артропатия |
| Посттравматический синовит | Паранеопластическая артропатия |
| Врождённая гипоплазия головки бедра |
Лечение
Лечение ОА
Цели лечения
· Обеспечить понимание больным своего заболевания и умение управлять им: изменение образа жизни, применение физических упражнений, поддерживающих функцию суставов, защита суставов
· Улучшить функциональное состояние суставов и предотвратить развитие деформации суставов и инвалидизации больного
· Улучшить качество жизни больных
· Предотвратить дальнейшее разрушение суставного хряща
· Избежать побочных эффектов фармакотерапии и обострения сопутствующих заболеваний
При лечении ОА надо учитывать
· Интенсивность боли и степень нарушения функций сустава
· Локализацию и выраженность структурных нарушений
· Пожелания и ожидания больного
Лечение ОА должно быть комплексным и включать нефармакологические, фармакологические и хирургические методы.
Нефармакологические методы
| Результаты исследований | Рекомендации | |
| Обучение больных | Повышение уровня знаний о заболевании уменьшает боль и улучшает функции суставов. Обучение больных и их супругов навыкам ежедневных тренировок приводит к уменьшению боли. Эти методы обладают невысокой стоимостью затрат. | Обучение больных должно быть обязательным компонентом всех терапевтических программ при ОА, проводиться с учетом индивидуальных особенностей больного и включать рекомендации по изменению образа жизни, снижению веса и необходимости выполнения физических упражнений (А, В). |
| Снижение веса тела | Снижение веса уменьшает боль и улучшает функцию коленных суставов, при уменьшении веса на 6,1 кг размер эффекта на боль и функцию коленных суставов составляет 0,20 и 0,23 соответственно. Снижение веса позитивно влияет на структурные изменения в хряще и биохимические маркеры обмена хряща и кости. | Больным ОА с избыточным весом (ИМТ более 25 кг/м 2 ) рекомендуется уменьшение веса (В,С). |
| Лечебная физкультура | ||
| Ортопедические приспособления | Наколенники, фиксирующие колено при вальгусном положении, ортопедические стельки с приподнятым на 5–10° латеральным краем уменьшают нагрузку на медиальные отделы коленного сустава, оказывают обезболивающий эффект и улучшают функцию суставов. Коленные ортезы при варусной деформации уменьшают боль, улучшают функциональную активность и качество жизни. Эластичный наколенник облегчает боль и улучшает проприоцептивное чувство. С целью механической разгрузки суставов рекомендуют хождение с помощью трости, в руке, противоположной поражённой нижней конечности (специальные исследования по этому поводу отсутствуют; тем не менее, использование трости внесено в международные рекомендации). Ортез и шинирование 1–го запястно-пястного сустава устраненяет подвывих и улучшает функции кисти. | При поражении медиального отдела коленного сустава, варусной деформации или нестабильности коленного сустава могут использоваться коленные ортезы (В) и клиновидные ортопедические стельки (С). Рекомендуется хождение с тростью в руке, противоположной поражённой нижней конечности (С). При ОА 1–го запястно-пястного сустава применяются шинирование и ортезы (В). |
| Физиотерапевтические методы | Местное применение поверхностного холода или тепла способствует обезболивающему эффекту. Чрескожная электростимуляция нервов имеет достоверный, но непродолжительный анальгетический эффект. Акупунктура может использоваться у некоторых больных с гонартрозом с анальгетической целью. | При ОА коленных суставов с признаками воспаления можно рекомендовать применение холодовых аппликаций (пакеты со льдом, массаж льдом) (В). Для уменьшения боли при ОА коленных и суставов кистей рекомендуются тепловые процедуры (В), чрезкожная электронейростимуляция (А,В). У некоторых больных может использоваться акупунктура (В). |
Медикаментозное лечение
Симптоматические лекарственные средства быстрого действия
| Результаты исследований | Рекомендации | |
| Анальгетики | Парацетамол показан при слабых или умеренных болях при ОА без признаков воспаления. В дозе 3,0 г/сут. доказана безопасность применения парацетамола при ОА в течение 2 лет. Высокие дозы сопровождаются развитием осложнений со стороны ЖКТ, почек и вызывают повышение артериального давления у мужчин и женщин. Препарат не следует назначать больным с поражениями печени и хроническим алкоголизмом. | При слабых или умеренных болях в суставах применяется парацетамол в минимальной эффективной дозе, но не выше 3,0 г/сут. (максимальная разовая доза должна не превышать 350 мг) (А). Парацетамол можно применять длительно (А). |
| Нестероидные противовоспалительные препараты | Применяют только в период усиления болей, для купирования болей назначаются минимальные эффективные дозы и по возможности не длительно. Больные должны быть детально информированы о достоинствах и недостатках НПВП, включая безрецептурные препараты. Все НПВП в эквивалентных дозах обладают сходной эффективностью, выбор НПВП определяется прежде всего его безопасностью в конкретных клинических условиях. Осложнения со стороны ЖКТ — одни из наиболее серьёзных побочных эффектов НПВП. Относительный риск их возникновения варьирует у различных НПВП и дозозависим. Наименьшим риском развития желудочно-кишечного кровотечения обладают селективные ингибиторы ЦОГ2. Их следует назначать при наличии следующих факторов риска развития нежелательных явлений: возраст старше 65 лет, наличие в анамнезе язвенной болезни или желудочно-кишечного кровотечения, одновременный приём ГКС или антикоагулянтов, наличии тяжёлых сопутствующих заболеваний. |
Внутрисуставное введение глюкокортикоидов (ГЛК) показано при ОА коленных суставов с симптомами воспаления (А).
Симптоматические лекарственные средства медленного действия
| Результаты исследований | Рекомендации | |
| Хондроитин сульфат и глюкозамин | Препараты, содержащие хондроитин сульфат и глюкозамин, обладают умеренным анальгетическим действием и высокой безопасностью. Получены данные об их возможном структурно-модифицирующем действии (замедление сужения суставной щели) при ОА коленных суставов (хондроитин сульфат, глюкозамин сульфат) и мелких суставов кистей (хондроитин сульфат). Хондроитин сульфат применяют по 500 мг 2 раза в сутки, длительно. Глюкозамин сульфат назначают по 1500 мг/сутки в течение 4–12 нед., курсы повторяют 2–3 раза в год. | |
| Диацереин | В эксперименте показано, что механизм действия заключается в ингибировании ИЛ-1β. Уменьшает боль, эффект сохраняется в течение нескольких месяцев после завершения лечения при ОА коленных и тазобедренных суставов. Диацереин применяют по 50 мг 1раз в сутки, затем по 50мг 2 раза в сутки длительно. | Ингибитор интерлейкина 1 – диацереин применяют для уменьшения боли, улучшения функции суставов и, вероятно, замедления прогрессирования ОА (А). |
| Пиаскледин | Многочисленные исследования in vitro и in vivo показали, что НСАС повышают уровень стимуляторов тканевой продукции и оказывают хондропротективный эффект при индуцированном ОА. НСАС уменьшает боль, снижает потребность в НПВП и обладает последействием в течение нескольких месяцев после завершения лечения. Структурно-модифицирующий эффект НСАС продемонстрирован в 2 исследованиях при ОА тазобедренных суставов. Пиаскледин применяют по 300 мг 1раз в сутки, длительно. | Не омыляемые соединения авокадо и сои (НСАС) – пиаскледин применяют для уменьшения боли, улучшения функции суставов и, вероятно, замедления прогрессирования ОА (А). |
| Препараты гиалуроновой кислоты | Препараты гиалуроновой кислоты уменьшают боль, улучшают функции сустава, но отмечена большая гетерогенность в оценке исходов анализируемых исследований. В настоящее время применяют низкомолекулярные (мол. масса 500–730 килодальтон) и высокомолекулярные (мол. масса 12000 килодальтон) препараты гиалуроната. Низко-молекулярные и высоко-молекулярные препараты демонстрируют одинаковые результаты, эффект длится от 60 дней до 12 мес. Лечение хорошо переносится, очень редко при введении боли в суставе могут усиливаться по типу псевдоподагрической атаки. | |
| Стронция ранелат | Обладает симптоматическим эффектом (уменьшает боль и улучшает функции сустава в дозе 2,0 в сутки) и структурно-модифицирующим действием в дозах 1,0 и 2,0 в сутки при ОА коленных и тазобедренных суставов, применяемых в течение 3-х лет | Применяют для уменьшения боли и замедления прогрессирования ОА крупных суставов (А) |
Хирургическое лечение
Уменьшает боль, улучшает двигательную функцию и улучшает качество жизни при ОА тазобедренных суставов. Продолжительность эффекта составляет около 10 лет, частота инфекционных осложнений и повторных операций — 0,2–2,0% ежегодно. Наилучшие результаты эндопротезирования отмечены у больных в возрасте 45–75 лет, с массой тела
Эндопротезирование коленных суставов приводит к уменьшению боли и улучшению двигательной функции.
Показано при ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, при наличии серьёзного нарушения функций сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии) (А).
Алгоритм ведения больных ОА коленных и тазобедренных суставов




