Чадлв у ребенка что это
Чадлв у ребенка что это
Существует много анатомических разновидностей этого порока, которые определяют его гемодинамические особенности. Сочетание с дефектом межжелудочковой или межпредсерднои перегородки сопровождается выраженным цианозом и недостаточностью кровообращения преимущественно по левожелудочковому типу с выраженными застойными явлениями в легких.
Кровообращение. При этой аномалии значительная часть артериальной крови из легочных вен поступает не в левое предсердие, а в правое, затем через правый желудочек снова в малый круг кровообращения. Вследствие такого возврата большая часть крови циркулирует в пределах малого круга кровообращения, количество циркулирующей крови в большом круге кровообращения уменьшено.
• При впадении всех легочных вен в правое предсердие жизнь после рождения возможна только в том случае, если имеются другие аномалии строения сердца или сосудов, облегчающие поступление крови из правого предсердия в артериальное русло — дефект межжелудочковой, межпредсерднои перегородки.
• Обычно отмечается аномальное расположение 1—2 вен правого легкого, чаще в сочетании с дефектом межпредсердной перегородки. Характерны циркуляция смешанной крови с незначительным снижением содержания кислорода в большом круге кровообращения, перегрузка правых отделов сердца, легочная гипертензия.
Клиническая картина этого порока определяется анатомо-гемодинамическими особенностями: уровнем общелегочного сопротивления, степенью легочной венозной обструкции, размером межпредсердного сообщения, состоянием миокарда правого желудочка.
Первые признаки порока часто появляются с первых дней жизни в виде сердечной недостаточности, повторных пневмоний, ОРВИ, кашля, малой прибавки в массе тела. У ребенка с рождения наблюдается тахипноэ и диспноэ, наличие влажных хрипов в легких. При аускультации иногда может отмечаться систолический шум слева во втором межреберье, акцент и расщепление II тона над легочной артерией.
У некоторых детей в периоде новорожденности развивается выраженная обструкция венозного возврата, что характерно для впадения легочных вен в систему ниже диафрагмы. При этом появляются выраженный цианоз и резкое тахипноэ. Шумы в области сердца в этом случае могут не выслушиваться.
Для другой группы новорожденных со значительным шунтом слева-направо характерно раннее развитие застойной сердечной недостаточности. Из-за легочной сосудистой гипертензии заболевание протекает очень тяжело. Аускультативно у них по левому краю грудины выслушиваются систолические шумы, иногда ритм галопа. Цианоз выражен слабо.
У новорожденных без нарушения оттока из легочных вен, с шунтом слева-направо и отсутствием легочной гипертензии клиническая симптоматика в периоде новорожденности мало выражена или отсутствует. Цианоз практически не возникает. Декомпенсация развивается в более позднем возрасте.
Диагностика. На электрокардиограмме регистрируются признаки отклонения электрической оси сердца вправо, блокады правой ножки пучка Гиса, увеличения правого предсердия, правого желудочка.
На рентгенограмме легочный рисунок значительно усилен, наблюдается умеренная или значительная кардиомегалия из-за увеличения правых камер сердца. Левые отделы нормальных размеров, иногда видна расширенная тень верхней полой вены.
• При супракардиальной форме порока характерна тень в виде восьмерки, где нижней частью является само сердце, а верхней — коллектор, собирающий кровь из всех легочных вен и открывающийся в левую или правую полую или безымянную вены, которые дилатированы из-за вмещения большого объема крови. Иногда форма сердца имитирует увеличенную вилочковую железу.
• При впадении легочных вен в коронарный синус или нижнюю полую вену характерные рентгенологические проявления порока отсутствуют.
На эхокардиограмме выявляются признаки перегрузки правого желудочка, промежуточные или парадоксальные колебания межжелудочковой перегородки. Размер левого желудочка составляет 50—65% от нормы. Корень аорты уменьшен. Общий венозный канал, в который впадают легочные вены, можно лоцировать при расположении его непосредственно за левым предсердием.
Коррекция. Лечение хирургическое. В этом случае проводят пересадку легочных вен в левое предсердие.
Сердечная недостаточность при этом пороке трудно поддается лечению мочегонными и сердечными гликозидами.
Прогноз, как правило, неблагоприятен.
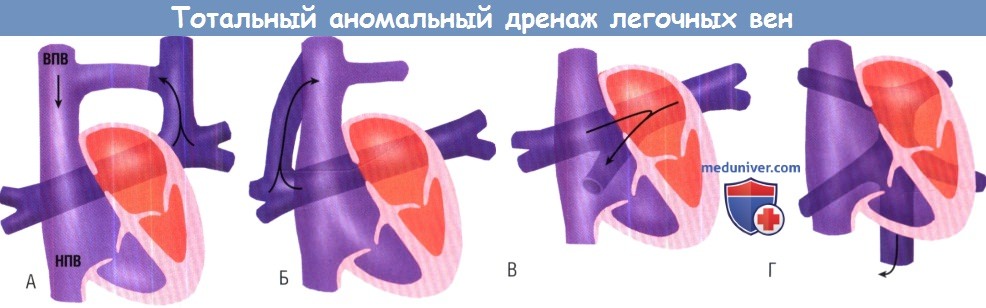
супракардиальный вариант, при котором легочные вены дренируются либо через вертикальную вену (А),
либо непосредственно в верхнюю полую вену (ВПВ) с расположением устья коллектора вблизи устья непарной вены (Б).
(В) Кардиальный вариант дренирования через коронарный синус в правое предсердие.
(Г) Инфракардиальный вариант дренирования, осуществляемый через вертикальную вену в воротную вену или нижнюю полую вену (НПВ).
Чадлв у ребенка что это
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва, Россия
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
Семейная форма частичного аномального дренажа легочных вен
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(1): 53-59
Иванов А. С., Гламазда С. В., Луговский М. К., Лебедева А. В., Абрамова Н. Н., Говорова Т. Н., Сацюк О. В. Семейная форма частичного аномального дренажа легочных вен. Кардиология и сердечно-сосудистая хирургия. 2019;12(1):53-59.
Ivanov A S, Glamazda S V, Lugovskiĭ M K, Lebedeva A V, Abramova N N, Govorova T N, Satsiuk O V. Hereditary partial anomalous pulmonary venous connection. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2019;12(1):53-59.
https://doi.org/10.17116/kardio20191201153
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви. В данной статье представлен клинический случай семейной формы ЧАДЛВ. Причины возникновения ЧАДЛВ могут быть связаны с хромосомными аномалиями. Отклонения в эмбриогенезе, наличие врожденного порока сердца у ближайших родственников увеличивают вероятность возникновения этой аномалии.
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
ФНЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова, Москва
ФГБУ «НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва, Россия
ФГБУ «Федеральный научный центр трансплантологии и искусственных органов им. акад. В.И. Шумакова» Минздрава России, Москва
В настоящее время выявлены этиологические факторы многих генетических синдромов и семейных врожденных пороков сердца (ВПС), но генетические основы большинства «спорадических» ВПС до сих пор остаются неизвестными. Ведущие причины развития ВПС представлены на рис. 1. 
Определены многие гены, связанные с развитием сердца. Установлено, что ряд отдельных ВПС и генетических синдромов ассоциируется с мутациями в различных единичных генах [1].
Многие гены, кодируемые посредством транскрипционных факторов или сигнальных молекул, в настоящее время ассоциированы с ВПС у человека. Транскрипционные факторы являются белками, которые содержат ДНК-связывающие домены и играют фундаментальную регулирующую роль, контролируя экспрессию генов. Сигнальными молекулами являются белки, которые позволяют клеткам реагировать на их окружение и таким образом участвуют в регуляции многих важных биологических функций.
Фенотипы ВПС варьируют от небольших септальных дефектов, которые могут остаться незамеченными на протяжении всей жизни, до гемодинамически значимых аномалий, которые проявляются клинической симптоматикой. К ним относятся аномалии в диапазоне от персистенции фетального кровообращения (например, открытый артериальный проток) до сложных пороков, таких как транспозиция магистральных сосудов, единый желудочек, синдром гипоплазии левых отделов сердца и другие варианты гетеротаксии. В соответствии с патогенетической классификацией врожденных пороков сердечно-сосудистой системы существуют 6 причинных механизмов: аномалии миграции эктомезенхимальной ткани (аномалии дуги аорты), дефекты внутрисердечного кровотока (септальные дефекты и обструктивные пороки левых или правых отделов сердца), аномалии, связанные с гибелью клеток (септальные дефекты и аномалии клапанов), аномалии экстрацеллюлярного матрикса (дефекты атриовентрикулярного канала), аномальный рост (частичная или полная мальформация легочного венозного возврата и трехпредсердное сердце) и неправильная позиция и перекручивание, что включает нарушение лево-правой асимметрии [2].
Например, homeobox — содержащие белки, кодируемые генами группы NKX-2,5, играют важную роль в регулировании тканеспецифической экспрессии генов, необходимых для дифференцировки тканей, а также для определения временных и пространственных моделей развития. Исследования показали, что в последнее время несиндромные ВПС могут быть результатом дефекта одного гена. Исходя из этого, можно сделать вывод, что предрасположенность к ВПС является результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий (см. таблицу) 
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви [4].
Существуют четыре анатомические формы ЧАДЛВ, в основу которых положена локализация места впадения легочных вен: супракардиальный, интракардиальный, инфракардиальный и смешанный. Аномальный дренаж правых легочных вен встречается в 2 раза чаще, чем левых. Правые легочные вены могут дренироваться в верхнюю полую вену, что часто сочетается с дефектом венозного синуса (рис. 2, а), 
Впервые порок был описан Winslow в 1739 г. При патологоанатомическом исследовании был обнаружен аномальный дренаж вены верхней доли правого легкого в верхнюю полую вену. Наиболее полно анатомию и клинику этого порока изучил Brody (1942 г.). Систематизировали анатомические варианты (типы) порока R. Darling и соавт. [4] в 1957 г.
Первая успешная операция коррекции частичного аномального дренажа с использованием закрытого метода «атриосептопексии» была выполнена W. Neptune в 1953 г. В 1956 г. J. Kirklin и соавт. [4] сообщили о 5 успешных операциях коррекции порока по полуоткрытому методу Гросса.
Конкретные причины возникновения ЧАДЛВ неизвестны. Они могут быть связаны с хромосомными аномалиями, выявляемыми при кариотипировании более чем у 1/3 больных с ВПС. Чаще всего это трисомия по 21, 18 и 13-й парам хромосом. Помимо болезни Дауна, существует около 20 наследственных синдромов, в большинстве случаев сопровождающихся различными ВПС. В общей сложности синдромальная патология обнаруживается у 6—36% больных. Моногенная природа ВПС доказана в 8% наблюдений; около 90% наследуются многофакторно, т. е. являются результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды. Последние выступают в качестве провоцирующих, выявляющих наследственную предрасположенность при превышении порога их совместного действия [6, 7].
По данным различных исследований [8—10], частота встречаемости ЧАДЛВ среди всех врожденных пороков сердца находится в пределах от 0,7 до 9,4%. Из всех случаев аномального дренажа легочных вен около 2/3 из них приходится на ЧАДЛВ. Чаще в процесс вовлечены правые легочные вены. Верхняя полая вена является наиболее частым местом впадения аномальных правых легочных вен (35—57% от всех случаев ЧАДЛВ). Реже легочные вены впадают в непарную вену, крайне редкий вариант — впадение одной или всех легочных вен в безымянную или добавочную левую вену.
Второе место по частоте занимает интракардиальный тип правостороннего ЧАДЛВ. Аномальный дренаж левых легочных вен встречается крайне редко, при этом легочные вены впадают в коронарный синус или непосредственно в правое предсердие.
При инфракардиальном типе порока вены (чаще средней и нижней долей правого легкого) впадают в нижнюю полую вену (НПВ) сразу под диафрагмой [11].
ЧАДЛВ может также входить в состав более сложных ВПС. Около 20% пациентов с ЧАДЛВ имеют сопутствующие пороки сердца, например, тетраду Фалло, дефект межпредсердной (ДМПП) или межжелудочковой перегородки (ДМЖП), единый (общий) желудочек, общее предсердие, транспозицию магистральных сосудов и синдром гипоплазии левых отделов сердца [12]. Однако чаще всего ЧАДЛВ встречается в комплексе с ДМПП (более 50% случаев) [9].
Между 4-й и 5-й неделями эмбриогенеза в дорсальном мезокарде начинают формироваться легочные вены, исходящие из среднеглоточного эндотелиального стебля [13]. Формирование ЧАДЛВ происходит в результате атрезии крупной ветви общей легочной вены. Как только правая или левая часть общей легочной вены становится атрезированной, то персистенция легочно-системной венозной связи на этой стороне создает этиологическую основу для ЧАДЛВ [12].
Факторами риска развития ЧАДЛВ являются возраст матери выше 40 лет, токсикоз и угроза прерывания беременности в I триместре, наличие мертворождения в анамнезе, наличие детей с врожденными пороками развития у родителей и ближайших родственников [14].
Следует отметить, что у ближайших родственников пациента с аномалиями сердца частота ВПС в 2—5 раз выше [14]. Однако в доступной нам литературе семейной формы ЧАДЛВ описано не было.
Гемодинамика и клинические признаки при ЧАДЛВ соответствуют таковым при ДМПП. При рентгенологическом обследовании можно выявить расширение тени верхней полой вены (ВПВ) и корня правого легкого при аномальном дренаже в ВПВ. При впадении легочных вен в ВПВ в переднезадней проекции на фоне нижней доли правого легкого выявляется тень аномально идущего сосуда в виде «турецкой сабли» (С. Dolter, 1949). Увеличение сосудистого пучка влево позволяет заподозрить аномальное впадение левых легочных вен в левую безымянную вену [15].
В настоящее время эхокардиография (ЭхоКГ) является основным диагностическим методом исследования у пациентов с ЧАДЛВ, однако только компьютерная томография (КТ) с внутривенным контрастированием позволяет установить окончательный диагноз, уточнить анатомию врожденного порока и определить дальнейшую хирургическую тактику [16, 17].
Существует несколько описанных техник коррекции частичного правого аномального дренажа легочных вен: простая туннелизация (переключение легочных вен в левое предсердие заплатой), туннелизация с расширением ВПВ заплаткой, туннелизация с иссечением ВПВ и ее перемещением в правое предсердие (как правило, в ушко предсердия) [18].
Различий в результатах трех техник нет. Выбор техники оперативного вмешательства зависит от типа аномального дренажа и клиники порока [18].
Представляем клиническое наблюдение пациентки А., 18 лет, поступившей в кардиохирургическое отделение с диагнозом: ВПС, ДМПП. Частичный аномальный дренаж правых верхних легочных вен в верхнюю полую вену. Легочная гипертензия I ст. Недостаточность кровообращения IIa степени, II функциональный класс.
На момент осмотра пациентка предъявляла жалобы на одышку и слабость при умеренных физических нагрузках. Из анамнеза известно, что диагноз ДМПП установлен в ноябре 2017 г. в возрасте 17 лет по данным ЭхоКГ. В январе 2018 г. выполнена мультиспиральная КТ (СКТ) сердца с в/в контрастированием, выявлены вторичный ДМПП без верхнего края, частичный аномальный дренаж правых легочных вен в ВПВ, расширение правых камер сердца.
По данным СКТ, три вены от верхней, средней и частично нижней правых легочных вен единым коллектором (диаметром 17 и 11 мм) от средней доли впадают в нижнюю треть ВПВ (рис. 3, 4). 

Состояние пациентки при осмотре средней степени тяжести. АД 110/70 мм рт.ст., ЧСС 70 уд/мин. Тоны сердца ясные, ритмичные. Во втором межреберье слева выслушивается систолический шум. На ЭКГ отмечалась атриовентрикулярная блокада 1-й степени (интервал PQ 0,22 с), а также неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ, отмечались увеличение правых отделов сердца, дискинезия межжелудочковой перегородки, легочная гипертензия до 40 мм рт.ст. В области верхней трети МПП определялся сброс слева направо диаметром 12—13 мм.
Поступившая в наше отделение пациентка была оперирована. Интраоперационно: сердце увеличено в размерах за счет правых отделов. Экстраперикардиально визуализирован коллектор из трех легочных вен от верхней и средней долей правого легкого диаметром 4, 6 и 7 мм (рис. 5), 

Была выполнена пластика дефекта туннелевидной заплатой из ксеноперикарда (рис. 7). 
Послеоперационный период протекал без особенностей и осложнений. Пациентка была выписана на 8-е сутки после операции в удовлетворительном состоянии. При выписке на ЭКГ нижнепредсердный, правильный ритм с частотой 75 уд/мин, а также неполная блокада правой ножки пучка Гиса.
Из анамнеза известно, что у отца пациентки в возрасте 15 лет также были выявлены ЧАДЛВ и ДМПП. Он был оперирован, и интраоперационно обнаружено аномальное впадение верхней правой легочной вены в устье ВПВ. Пациенту была выполнена пластика ДМПП с перемещением легочной вены от верхней доли правого легкого в левое предсердие.
Кроме того, двоюродная сестра пациентки была прооперирована в возрасте 8 мес по поводу ВПС. Были выявлены центральный дефект межпредсердной перегородки диаметром 15 мм и аномальный дренаж верхней правой легочной вены в правое предсердие, дефект закрыт заплатой из ксеноперикарда с перемещением устья легочной вены в левое предсердие.
В нашем центре им было выполнено МРТ сердца для визуализации анатомического строения и контроля отдаленных результатов операционного лечения пациентов (рис. 8), 
Предрасположенность к ВПС обусловливается результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий. Конкретные причины возникновения ЧАДЛВ неизвестны. Отклонения в эмбриогенезе и наличие ВПС у ближайших родственников увеличивают вероятность возникновения аномалии в развитии сердца. В приведенном выше клиническом наблюдении отмечено наличие ЧАДЛВ у отца пациентки и у двоюродной сестры. ЧАДЛВ чаще встречается в комбинации с ДМПП и зачастую представлен одной или несколькими аномально впадающими правыми легочными венами. По данным отдаленных результатов, оперативное вмешательство в виде туннелизации (перемещения устьев легочных вен в левое предсердие заплатой) является надежным и эффективным методом лечения ЧАДЛВ. В доступной литературе мы не встретили описания семейной формы ЧАДЛВ.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
«Клинические рекомендации «Частичный аномальный дренаж легочных вен (ЧАДЛВ)» (утв. Минздравом России)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЧАСТИЧНЫЙ АНОМАЛЬНЫЙ ДРЕНАЖ ЛЕГОЧНЫХ ВЕН (ЧАДЛВ)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: Q26.3
Год утверждения (частота пересмотра): 2018
Возрастная категория: Взрослые, Дети
Год окончания действия: 2020
Разработчик клинической рекомендации
— Ассоциация сердечно-сосудистых хирургов России
Одобрено Научно-практическим Советом Минздрава РФ
Термины и определения
1. Краткая информация
1.2 Этиология и патогенез
К нарушению органогенеза и формированию врожденного порока сердца приводят генетические, физические, экологические и инфекционные факторы. Риск развития порока у будущего ребенка существенно выше в тех семьях, где есть родственники с ВПС. Кроме наследственной обусловленности, к возникновению порока могут приводить вирусные заболевания беременной (краснуха, ветряная оспа и др.), эндокринопатии, прием некоторых медикаментов и алкоголя во время беременности, производственные вредности, гестационные осложнения (токсикозы, угроза выкидыша и др.).
Врожденные аномалии крупных вен (Q26):
1.6 Клиническая картина
Пороки этого типа имеют скудную клиническую картину и часто протекают бессимптомно. Они могут манифестировать сниженной толерантностью к физической нагрузке, частыми инфекционными заболеваниями легких. Явления недостаточности кровообращения незначительны и могут ограничиваться умеренно выраженной слабостью, потливостью ребенка, цианозом носо-губного треугольника. Изолированный ЧАДЛВ может проявлять себя кровохарканьем. Дети с пороками типа ДМПП нередко имеют астеническое телосложение с заметной бледностью кожных покровов. Диффузный цианоз может отмечаться в случаях вено-артериального сброса.
При физикальном осмотре могут отмечаться расщепление II тона (следствие большей продолжительности систолы правого желудочка) и/или систолический шум функционального стеноза над легочной артерией. В случаях больших дефектов возможно наличие диастолических шумов над трехстворчатым клапаном (функциональный стеноз) и легочной артерией (недостаточность клапана легочной артерии, шум Грехема-Стилла).
2.1 Жалобы и анамнез
Комментарии: Как правило, данный ВПС имеет скудную клиническую картину и часто протекает бессимптомно. Явления недостаточности кровообращения незначительны и могут ограничиваться умеренно выраженной слабостью, потливостью ребенка, цианозом носогубного треугольника.
2.2 Физикальное обследование
2.3 Лабораторная диагностика
— Если пациент с ЧАДЛВ поступил в профильный стационар для оперативного лечения порока рекомендуется определить его группу крови и резус-фактор для подбора крови [2].
— Рекомендуется всем пациентам выполнять общий анализ крови для определения исходного уровня гемоглобина и тромбоцитов перед оперативным вмешательством [2].
2.4 Инструментальная диагностика
Диагноз ЧАДЛВ ставится при помощи визуализирующих методов исследования.
Комментарии: Заподозрить ЧАДЛВ возможно при отсутствии визуализации при трансторакальном исследовании в проекции 4-х камер в режиме цветного допплеровского картирования потока в левом предсердии из правых или левых легочных вен. При ЧАДЛВ в верхнюю полую вену отмечается ее расширение и ускоренный поток в ней (в режиме непрерывно-волнового допплера). В высокой правой парастернальной позиции в проекции по длинной оси или при субкостальном доступе в проекции по короткой оси визуализируется место впадения ЧАДЛВ в верхнюю или нижнюю полые вены. Трудности могут возникать при эхокардиографической диагностике ЧАДЛВ левых легочных вен в коронарный синус при наличии верхней левой полой вены, смешанной формы ЧАДЛВ. При оценке потока в легочной вене в допплеровском режиме возможно определение стеноза вены/коллектора в месте впадения в правое предсердие, полые вены. ЭхоКГ проводится также и перед выпиской из стационара.
— Выполнение МРТ грудной клетки пациентам с подозрением на ЧАДЛВ рекомендуется для оценки анатомии легочных вен, характеристики потока в них, а также в том случае, если результаты ЭхоКГ неубедительны [2, 3].
— Пациентам с неясной перегрузкой объемом ПЖ рекомендуется госпитализация в специализированное учреждение с целью проведения дальнейших диагностических исследований и выявления ВПС [2, 3, 9].
— Катетеризация сердца с ангиографией рекомендуется пациентам для выявления сопутствующих аномалий сердца, а также у пациентов с подозрением на легочную гипертензию [2, 3, 9].
Комментарии: Безусловным признаком аномального дренажа легочных вен, выявляемого при катетеризации правых отделов сердца, служит прохождение зонда в легочные вены непосредственно из полых вен или правого предсердия.
Комментарии: При обычном рентгенологическом исследовании удается выявить признаки усиления артериального сосудистого рисунка в легких и увеличение камер правого сердца и легочной артерии различной степени выраженности. При синдроме ятагана в прямой проекции визуализируется аномально дренирующаяся легочная вена.
Комментарии: Электрокардиографическая картина неспецифична и отражает гипертрофию правого предсердия и желудочка, а также перегрузку последнего. Степень этих изменений зависит от величины сброса крови и длительности существования порока.
2.5 Иная диагностика
3.1 Консервативное лечение
— Рекомендуется назначение диуретиков в возрастных дозировках пациентам, у которых течение порока сопровождается явлениями недостаточности кровообращения [2, 7, 9].
— Рекомендуется пациентам в случае фибрилляции предсердий как антиаритмическая, так и антикоагулянтная терапия с индивидуальным подбором дозировки (см. клинические рекомендации по фибрилляции предсердий) [12, 13].
3.2 Хирургическое лечение
— Оперативное лечение ЧАДЛВ рекомендуется пациентам при соотношении объемов кровотока по малому и большому кругам кровообращения (Qp:Qs) более 1,5. При изолированном ЧАДЛВ (без ДМПП) части одного легкого оперативное лечение проводится при Qp:Qs более 1,8 [2, 3, 9].
Обезболивающая терапия у детей
Комментарии: Дети до 6 месяцев в премедикации не нуждаются. Дети от 6 месяцев до 3 лет: мидазолам** или диазепам** в/м, либо в/в в возрастных дозировках. Дети старше 3 лет: тримепередин** и/или мидазолам**, либо диазепам** в/м, в/в в возрастных дозировках.
Комментарии: препараты, используемые для индукции и поддержания анестезии у детей:
Поддержание анестезии: Дети до 1 месяца: мидазолам**/натрия оксибутират** и фентанил** в/в в возрастных дозировках. Дети старше 1 месяца: мидазолам**/натрия оксибутират**/пропофол** и фентанил** в/в в возрастных дозировках. Во всех возрастных группах возможно применение галогенсодержащих газовых анестетиков в комбинации с фентанилом**. При превышении дозировок (применении дозировок, превышающих указанные в инструкции к препарату) необходимо решение врачебной комиссии.
Комментарии: препараты, используемые для обезболивания в послеоперационном периоде:
При сохранении выраженного болевого синдрома тримеперидин**/морфин** в возрастных дозировках по показаниям.
Обезболивающая терапия у взрослых
— Рекомендуется пациентам для премедикации с целью седации и обеспечения эмоциональной стабильности вечером накануне операции с целью уменьшения эмоционального стресса назначить транквилизаторы и нейролептики. Для премедикации перед подачей пациента в операционную с целью седации и обеспечения эмоциональной стабильности применяются опиаты и/или бензодиазепины [21, 22].
Комментарии: Вечером накануне операции: бензодиазепины (Бромдигидрохлорфенилбензодиазепин**, лоразепам), атипичные нейролептики (тиоридазин**, сульпирид**) в индивидуальных дозировках. Перед подачей в операционную в/м тримепередин** и/или диазепам**/мидазолам**.
Комментарии: препараты, используемые для индукции и поддержания анестезии:
Индукция: мидазолам**/диазепам**/пропофол** и фентанил** в/в в расчетных дозировках.
— Рекомендуется пациентам для обезболивания в раннем послеоперационном периоде использовать опиаты и НПВП в возрастных дозировках [21, 22].
Комментарии: препараты, используемые для обезболивания в послеоперационном периоде:
— В течение 3 месяцев после операции пациенту рекомендуется пройти восстановительное лечение в условиях санатория кардиологического профиля или реабилитационного центра [23].
— Рекомендуется ограничить физическую нагрузку пациентам в течение полугода с момента выписки из стационара [23].
Комментарии: Большинство программ кардиологической реабилитации длятся от трех до шести месяцев.
— Ранние послеоперационные симптомы, такие как повышение температуры, утомляемость, рвота, боль в груди или абдоминальная боль, могут означать посткардиотомный синдром с тампонадой сердца, в данном случае рекомендуется немедленное выполнение ЭхоКГ с целью исключения этого осложнения [2, 3, 9].
Комментарии: Посткардиотомный синдром и тампонада сердца могут возникнуть через несколько недель после хирургического коррекции ЧАДЛВ, и их необходимо оценить клинически и с помощью ЭхоКГ до выписки и в течение месяца после выписки пациента. Пациенты, их родители и врачи первичного звена должны быть проинструктированы о том, что необходимо сообщать о температуре или необычных симптомах (грудной или абдоминальной боли, рвоте, непривычной утомляемости) в первые недели после операции, так как эти симптомы могут представлять ранние признаки сердечной тампонады.
— Рекомендуется всем пациентам регулярное наблюдение врача-кардиолога [23].
— Ежегодный клинический осмотр у кардиолога рекомендуется пациентам после операции, если остались или появились следующие состояния [2, 3, 9]:
1. Легочная артериальная гипертензия.
2. Суправентрикулярная аритмия.
3. Правожелудочковая или левожелудочковая дисфункция.
4. Сопутствующие пороки или другие заболевания сердца.
Комментарии: Клиническое обследование и ЭКГ по поводу рецидивирующей или вновь появившейся аритмии является важной частью послеоперационного обследования.
6. Дополнительная информация, влияющая на течение и исход заболевания
7. Организация медицинской помощи
Показания для плановой госпитализации:
1. наличие симптомов недостаточности кровообращения;
2. наличие легочной гипертензии;
3. наличие суправентрикулярных нарушений ритма сердца;
4. плановое хирургическое вмешательство.
Показания для экстренной госпитализации:
1. ухудшение функционального статуса пациента в связи с прогрессированием симптомов недостаточности кровообращения;
2. наличие парадоксальной эмболии системных сосудов, в том числе мозга.
Показания к выписке пациента из стационара:
1. отсутствие сброса на межпредсердной перегородке, градиента на легочных венах после хирургической коррекции порока;
2. снижение давления в системе легочной артерии;
3. отсутствие симптомов недостаточности кровообращения.
Критерии оценки качества медицинской помощи
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Этап постановки диагноза
Выполнен сбор анамнеза и жалоб пациента
Выполнен физикальный осмотр пациента
Выполнена эхокардиография с применением режима цветного допплеровского картирования
Выполнена катетеризация сердца с ангиографией
Этап консервативного и хирургического лечения
Назначена диуретическая терапия
Выполнена операция по устранению частичного аномального дренажа легочных вен
Этап послеоперационного контроля
Выполнена эхокардиография перед выпиской из стационара
Пациент направлен на реабилитационное долечивание
7. Шарыкин А.С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. М.: Теремок; 2005.
8. Бураковский В.И., Бокерия Л.А.//Сердечно-сосудистая хирургия//М., 1996.
9. Зиньковский М.Ф. Врожденные пороки сердца. К.: Книга плюс; 2008.
12. Клинические рекомендации: Наджелудочковые нарушения ритма сердца у взрослых. http://cr.rosminzdrav.ru/#!/schema/242#doc_abbreviation (дата обращения 18.06.2019 г.).
13. Клинические рекомендации: Фибрилляция и трепетание предсердий у взрослых. http://cr.rosminzdrav.ru/#!/schema/888#doc_a1 (дата обращения 18.06.2019 г.).
20. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Лобачева Г.В., Ведерникова Л.В. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых у новорожденных и детей. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2014.
21. Рыбка М.М., Хинчагов Д.Я. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых при ишемической болезни сердца, патологии клапанного аппарата, нарушениях ритма, гипертрофической кардиомиопатии, аневризмах восходящего отдела аорты у пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2015.
22. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Никулкина Е.С. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения рентгенэндоваскулярных и диагностических процедур, выполняемых у кардиохирургических пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2018.
23. Подзолков В.П., Кассирский Г.И. (ред.). Реабилитация больных после хирургического лечения врожденных пороков сердца. М.: НЦССХ им. А.Н. Бакулева; 2015.
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Бокерия Л.А., академик РАН (Москва), Ассоциация сердечно-сосудистых хирургов России
2. Свободов А.А., д.м.н. (Москва)
3. Арнаутова И.В., д.м.н. (Москва)
4. Белов В.Н., д.м.н. (Калининград)
5. Борисков М.В., д.м.н. (Краснодар)
6. Волков С.С., к.м.н. (Москва)
7. Горбатиков К.В., д.м.н. (Тюмень)
8. Горбатых Ю.Н., д.м.н. (Новосибирск)
9. Горбачевский С.В., проф. (Москва)
10. Гущин Д.К. (Москва)
11. Ермоленко М.Л., д.м.н. (Москва)
12. Зеленикин М.А., проф. (Москва), Ассоциация сердечно-сосудистых хирургов России
13. Зеленикин М.М., проф. (Москва), Ассоциация сердечно-сосудистых хирургов России
14. Ким А.И., проф. (Москва)
15. Кокшенев И.В., проф. (Москва)
16. Кривощеков Е.В., д.м.н. (Томск)
17. Крупянко С.М., д.м.н. (Москва)
18. Купряшов А.А., д.м.н (Москва)
19. Мовсесян Р.Р., д.м.н. (С-Петербург), Ассоциация сердечно-сосудистых хирургов России
20. Никифоров А.Б. (Москва)
21. Петрушенко А.В., к.м.н. (Казань)
22. Плотников М.В., к.м.н. (Астрахань)
23. Подзолков В.П. академик РАН (Москва)
24. Сабиров Б.Н., д.м.н. (Москва)
25. Синельников Ю.А., д.м.н. (Пермь)
26. Сокольская Н.О. д.м.н., (Москва)
27. Туманян М.Р., проф. (Москва)
28. Шаталов К.В., д.м.н. (Москва)
29. Шмальц А.А., д.м.н. (Москва)
30. Черногривов А.Е., д.м.н. (Пенза), Ассоциация сердечно-сосудистых хирургов России
Конфликт интересов отсутствует. Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория разработанных клинических рекомендаций:
6. Врач ультразвуковой диагностики
Таблица П1. Уровни убедительности рекомендаций
Основана на клинических исследованиях хорошего качества, по своей тематике непосредственно применимых к данной специфической рекомендации, включающих по меньшей мере одно РКИ
Основана на результатах клинических исследований хорошего дизайна, но без рандомизации
Составлена при отсутствии клинических исследований хорошего качества, непосредственно применимых к данной рекомендации
Таблица П2. Уровни достоверности доказательности
Мета-анализ рандомизированных контролируемых исследований (РКИ)
Хотя бы одно хорошо выполненное контролируемое исследование без рандомизации
Хотя бы одно хорошо выполненное квазиэкспериментальное исследование
Хорошо выполненные не экспериментальные исследования: сравнительные, корреляционные или «случай-контроль»
Экспертное консенсусное мнение либо клинический опыт признанного авторитета
Порядок обновления клинических рекомендаций
1. Об основах охраны здоровья граждан в Российской Федерации (ФЗ от 21.11.2011 N 323-ФЗ)
2. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России от 15.11.2012 N 918н)
3. Приказ Министерства здравоохранения и социального развития Российской Федерации от 17 декабря 2015 г. N 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Ведение пациентов с ЧАДЛВ
Ведение пациентов с ЧАДЛВ
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Новорожденные и грудные дети, да и дети раннего возраста в подавляющем большинстве растут и развиваются абсолютно нормально. Родители могут замечать их склонность к частым простудам, иногда заканчивающихся воспалением легких, что должно насторожить. Часто эти дети растут бледными, худенькими и несколько отличаются от своих здоровых сверстников.

