Чем болел стивен хокинг и когда заболел
Как Стивену Хокингу удалось прожить больше 70 лет с болезнью Лу Герига?
В 2012 году Стивену Хокингу исполнилось 70 лет, с тех пор прошло три года. Хокинг — яркий пример того, что когда врачи предрекают скорую кончину, нужно собраться и жить дальше. Таким образом, ему удалось победить свой диагноз почти на полвека, отложив на этот же срок фатальный исход. Об этом человеке и о его знаменитом голосе мы писали много. Недавно вышел фильм про него, а за главную роль Эдди Редмейн получил Оскар.
Знаменитый физик-теоретик посвятил свои идеи о черных дырах и квантовой гравитации широкой публике. Большую часть своего времени на публике он был прикован к инвалидной коляске из-за заболевания — бокового амиотрофического склероза (БАС, ALS), известного также как болезнь Лу Герига. С 1985 года он был вынужден общаться с помощью компьютерной системы — которой он управляет с помощью щеки — и нуждается в постоянной опеке.
И хотя болезнь приковала его к креслу, она его не сломила. 30 лет Хокинг провел на посту ординарного профессора математики в Кембриджском университете. В настоящее время он — директор по исследованиям Центра теоретической космологии.
Как Хокингу удалось прожить так долго, в то время как другие люди умирают вскоре после постановки диагноза? На этот вопрос ответил Лео Маккласки, адъюнкт-профессор неврологии и медицинский директор ALS Center при Университете Пенсильвании.
Что такое БАС и сколько форм этой болезни мы знаем?
Известно, что есть несколько вариантов БАС. Один называется прогрессивной мышечной атрофией, или ПМА. Эта болезнь изолирована в нижних мотонейронах. Но патологически, если вы вскроете пациента, будут признаки повреждения верхних мотонейронов.
Есть также первичный боковой склероз — ПБС — и клинически он выглядит как изолированное расстройство верхних мотонейронов. Но патологически он демонстрирует расстройство нижних мотонейронов также.
Другой классический синдром называется бульбарный БАС, или супрануклеарный прогрессивный паралич, который ослабляет черепные мышцы вроде языковых, лицевых и глотательных мышц. Но он почти всегда распространяется и на мышцы конечностей.
Таковы четыре классических мотонейронных нарушения, которые были описаны в литературе. В течение долгого времени считалось, что эти нарушения ограничены мотонейронами. Но стало ясно, что это не так. В настоящее время хорошо известно, что у 10% пациентов с этим заболеванием развивалась дегенерация другой части мозга вроде других частей лобной доли, не содержащих мотонейроны, или височной доли. Таким образом, у некоторых из таких пациентов может на самом деле развиться фронтально-височная деменция.
Одним из заблуждений о БАС является то, что это всего лишь мотонейронное заболевание, но это не так.
Что показал случай Стивена Хокинга об этом заболевании?
Жизнь этого человека показала, что болезнь Лу Герига — невероятно переменчивое расстройство во многих отношениях. В среднем люди живут два-три года после постановки диагноза. Но это означает, что половина людей живет дольше, а значит, есть люди, которые живут очень и очень долго.
Ожидаемая продолжительность жизни зависит от двух вещей. Во-первых, мотонейроны управляют диафрагмой — дыхательной мышцей. Люди часто умирают от дыхательной недостаточности. Во-вторых, ухудшение работы глотательной мышцы может привести к недостаточности питания и обезвоживанию. Если этих двух вещей нет, потенциально можно жить в течение очень долгого времени, хотя качество этой жизни может быть сомнительным. То, что произошло с Хокингом, просто поражает.
Он прожил так долго, потому что заболел еще молодым и имел несовершеннолетний диабет?
Несовершеннолетний диабет диагностируется в подростковом возрасте, и я не знаком с ним достаточно хорошо, чтобы обсуждать. Но это наверняка диабетическое расстройство, которое прогрессирует очень и очень медленно. В моей клинике есть пациенты, которым поставили такой диагноз еще в подростковом возрасте, и они до сих пор живут до 40, 50 или 60 лет.
Я думаю, меньше нескольких процентов.
Как думаете, продолжительность жизни Хокинга обусловлена в большей мере отличной заботой о нем или же биологией его конкретной формы БАС?
Думаю, и тем и другим. Я не очень хорошо с ним знаком, поэтому не знаю, каким операциям его подвергали. Если ему не делали искусственную вентиляцию легких, дело в биологии — она определяет, как долго прогрессирует нейродегенеративное заболевание и сколько времени отводит на жизнь. При проблемах с глотанием вы можете получить питательную трубку, которая сводит на нет проблемы с питанием и обезвоживанием. Но от биологии многое зависит.
Хокинг, очевидно, обладает довольно активным умом, и его предыдущие заявления показывают, что его настрой довольно позитивный, несмотря на его состояние. Нет ли доказательств того, что образ жизни и психологическое состояние влияют на срок жизни пациентов?
Не думаю, что долголетие зависит от этого.
БАС до сих пор не имеет лечения. Что мы узнали о болезни совсем недавно, что могло бы помочь разработать лучшие способы лечения?
Еще в 2006 году стало понятно, что, как и многие другие нейродегенеративные заболевания, БАС определяется по накоплению аномальных белков в мозге. На 10% БАС генетически обусловлен и зависит от мутации гена. Есть определенные гены, которые приводят к определенным видами БАС. Зная особенности этих генов, мы знали бы механизмы их действия на мозг, а значит потенциально имели бы цель для терапии. Но пока таких терапий нет.
«Он исключительный, — сообщил Найджел Ли, профессор клинической неврологии в Королевском колледже Лондона, в 2002 году. — Я не знаю никого, кто жил бы с ALS так долго. Необычно не только прошедшее время, но и то, что болезнь, похоже, сгорела. Он, кажется, относительно стабилен. Такого рода стабилизация крайне редка».
Впрочем, спустя десять лет, когда Хокингу исполнилось 70 в 2012 году, такая реакция появилась у многих других ученых. Анмар аль-Чалаби из Королевского колледжа Лондона назвал Хокинга «экстраординарным. Я не знаю никого, кто выжил бы в течение такого времени».
Что же делает Хокинга отличным от других? Просто удача? Или трансцендентная природа его интеллекта каким-то образом остановила неминуемую судьбу? Никто не знает наверняка. Даже сам Хокинг, который хорошо разбирается в механике, стоящей за Вселенной, не может объяснить. «Возможно, моя разновидность БАС сложилась из-за плохой абсорбции витаминов», — говорил он.
Сам Хокинг утверждает, что сосредоточенность на работе вкупе с его инвалидностью подарили ему годы, которые не были доступны для других. Любой другой в более физическом поле — скажем, сам Лу Гериг — не мог бы функционировать на столь высоком уровне. «Мне, безусловно, помогло то, что у меня есть работа и что обо мне хорошо заботились, — говорил Хокинг в 2011 году. — Мне повезло работать в области теоретической физики, одной из немногих областей, в которых инвалидность не является серьезным препятствием».
В любом случае Хокинг демонстрирует невероятное: с боковым амиотрофическим склерозом можно и нужно бороться и жить.
Наперегонки со смертью Как Стивену Хокингу удалось дожить до старости
Боковой амиотрофический склероз (БАС), или мотонейронная болезнь, также известная в США как болезнь Лу Герига, — редкое заболевание центральной нервной системы, приводящее к параличам конечностей и атрофии мышц. Оно стало широко известно в 1939 году, когда установивший несколько рекордов американский бейсболист Генри Луи Гериг ушел из спорта в возрасте 36 лет. Оказалось, что он страдал от быстро прогрессировавших неизлечимых нарушений двигательных функций. Спортсмен скончался через два года после постановки диагноза.
Большинство пациентов живут не дольше пяти лет после того, как болезнь обнаружена. Физику-теоретику Стивену Хокингу был двадцать один год, когда ему диагностировали БАС, однако он дожил до 75-летнего возраста, хотя и был на грани смерти в 1985 году из-за воспаления легких.
Каждая мышца управляется мотонейронами, расположенными в двигательной коре в задней части лобной доли мозга или в мозговом стволе. Они передают сигналы мотонейронам, которые находятся в спинном мозге. Первые называют верхними мотонейронами, а вторые — нижними. В ряде стран выделяют различные формы мотонейронных заболеваний, затрагивающий одну или обе группы нервных клеток. Например, первичный боковой склероз (ПБС) поражает верхние моторные нейроны, прогрессирующая мышечная атрофия (ПМА) — нижние, а при БАС нарушаются функции всех мотонейронов. Тем не менее, по словам специалистов, вскрытие умерших пациентов показывало, что при ПБС и ПМА наблюдаются также патологические изменения в нижних и верхних нейронах соответственно.
Лео Маккласки (Leo McCluskey), профессор неврологии Пенсильванского университета, в своем интервью изданию Scientific American назвал заблуждением представление о том, что БАС затрагивает только моторные нейроны. Примерно у 10 процентов пациентов с мотонейронными заболеваниями наблюдались нарушения функций в других частях мозга, например, в лобных и височных долях, где не содержатся мотонейроны. Хотя считается, что болезнь Лу Герига не влияет на умственные способности, у некоторых больных все же отмечалось развитие лобно-височной деменции.
Фото: Public Domain / Wikimedia
Продолжительность жизни пациентов с БАС часто зависит от того, как долго работают нейроны, отвечающие за движение диафрагмы и, соответственно, вентиляцию легких. Когда они отказывают, возникает дыхательная недостаточность, которая является основной причиной смерти. Если нарушается функция глотательных мышц, больные умирают от голода и обезвоживания. Если ничего из этого не происходит, человек может жить многие годы, хотя качество его жизни сильно ухудшается. Так, Стивен Хокинг передвигается только с помощью компьютеризированного инвалидного кресла, снабженного синтезатором речи и инфракрасным датчиком движения. Эти устройства позволяют ему писать статьи и общаться с другими людьми.
Одной из причин того, что болезнь Хокинга не затронула работу диафрагмы и глотательных мышц, может быть ранняя форма БАС. По словам Маккласки, в его практике встречались пациенты, у которых заболевание было диагностировано в подростковом возрасте, и они дожили до 60 лет. Однако точные причины долгожительства нескольких процентов пациентов пока не ясны.
БАС до сих пор неизлечим, хотя выяснение его причин и механизмов являются целью активных исследований. Было выяснено, что, как и в случае многих других нейродегенеративных заболеваний, в клетках головного мозга накапливаются аномальные белки в нейронах центральной нервной системы. 5-10 процентов всех случаев бокового амиотрофического склероза вызваны наследственными факторами, однако заболеванию может способствовать не один, а множество генов. Для того чтобы вылечить БАС или хотя бы замедлить его прогрессирование, необходимо найти соединения, которые регулируют активность этих генов.
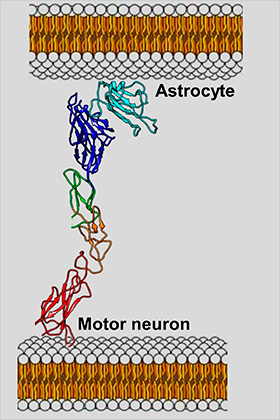
Американские ученые из Калифорнийского университета в Риверсайде выяснили, какие молекулы подавляют активность рецепторного белка EphA4, который связывают с быстрым развитием БАС. В своих исследованиях биологи использовали мышиную модель бокового амиотрофического склероза — мыши, которые страдали от заболевания, аналогичного болезни Лу Герига у человека. Статья исследователей опубликована в журнале Cell Biology.
EphA4 опосредует взаимодействие между моторными нейронами и астроцитами, которое, по мнению авторов работы, является одной из причин быстрой гибели первых.. Фото: Pellecchia lab / UC Riverside
Синтез белка EphA4 связан не только с прогрессирующим нарушением функций мотонейронов, но и с заболеваниями крови, при которых нарушается свертываемость, болезнью Альцгеймера, а также язвами желудка и поджелудочной железы. Однако нельзя точно сказать, каким образом можно подавить активность белка и как это повлияет на состояние пациента, поскольку исследователи не знали, какие соединения могут быть ингибиторами EphA4. Однако было точно известно, что мутации в гене, кодирующем белок, увеличивают продолжительность жизни больных животных.
Чтобы выявить подходящее соединение, ученые проанализировали молекулярное строение более ста тысяч химических веществ, применяя спектроскопию ядерного магнитного резонанса. Они искали молекулу, которая могла бы связаться с EphA4, используя подходы по оценке белок-белковых взаимодействий. Исследователи обнаружили, что таким соединением является 123C4.
Это вещество не подавляет рецептор EphA4, однако вызывает его интернализацию. Иными словами, белок после связывания с 123C4 уходит с поверхности клетки внутрь через процесс, называемый эндоцитозом. По словам ученых, 123C4 эффективно удаляет EphA4 с поверхности моторных нейронов.
Чтобы подтвердить способность препаратов на основе 123C4 продлевать жизнь, необходимо провести клинические исследования. Пока больным ряда стран (в США и Европе) доступен рилузол — единственное одобренное средство, которое продлевает жизнь пациентов на несколько месяцев.
Ученые рассказали, когда появится лекарство от «болезни Стивена Хокинга»
МОСКВА, 15 апр – РИА Новости, Мария Зуева. Ведущие международные и российские специалисты по боковому амиотрофическому склерозу (БАС), которым болел знаменитый британский ученый Стивен Хокинг, на Четвертой ежегодной общероссийской пациентской конференции по БАС в субботу рассказали, как продвинулась медицина в этом направлении. Участники конференции представили новейшие исследования в данной области, уточнив, что о победе над БАС речи пока не идет, но появления лекарства, возможно, ждать уже не так долго.
55 лет вместо трех
Боковым (латеральным) амиотрофическим склерозом называется болезнь Лу Герига. Это медленно прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних, так и нижних двигательных нейронов, что приводит к параличам и последующей атрофии мышц. В случае инфекции дыхательных путей или отказа дыхательной мускулатуры болезнь приводит к смерти.
Проблема БАС привлекла к себе всеобщее внимание после смерти в марте всемирно известного английского физика-теоретика Стивена Уильяма Хокинга, страдавшего этой болезнью. Он скончался в марте на 77-м году жизни. Хокинг — известный популяризатор науки и автор книги «Краткая история времени», которая разошлась 10-миллионным тиражом. Он занимался изучением проблемы возникновения космологической сингулярности — первичного состояния Вселенной, из которого она, согласно теории Большого взрыва, непрерывно расширяется.
В 1963 году 22-летнему Хокингу был поставлен диагноз боковой амиотрофический склероз. Врачи тогда считали, что жить ему осталось два-три года. Однако их прогнозы не оправдались, ученый продолжил научную работу, дважды женился и стал отцом троих детей. Даже полностью парализованный, Хокинг вел активную жизнь — занимался наукой, преподавал, выступал с докладами, общаясь с миром с помощью компьютерного синтезатора речи.
Препарат для облегчения БАС
Один из ведущих специалистов по БАС испанский врач Джезус Мора в докладе на конференции в Москве, организованной по инициативе благотворительного фонда помощи людям с БАС и другими нейромышечными заболеваниями «Живи сейчас» на площадке компании Philips, рассказал, как новый препарат маситиниб влияет на состояние страдающих БАС.
«Сейчас существует новый препарат, называется маситиниб. Препарат влияет на тирозинкиназу, которая, в свою очередь, имеет разнообразное влияние на клетки. Одно из действий тирозинкиназы – это моделирование иммунного ответа. Есть такое предположение, что одна из причин заболевания, ухудшения состояния пациентов – это некоторая чрезмерная агрессивность иммунных клеток, не всех, но некоторых. В прошлом пробовали принимать препараты, которые полностью подавляли всю иммунную систему, но стало понятно, что это никак не влияет на заболевание. Дело не целиком в иммунной системе, а в каких-то ее ключевых клетках, на которые нужно влиять. Маситиниб действует на два типа клеток: на макроглию – это клетки головного мозга — и на плазматические клетки», — сообщил Мора.
По его словам, первая стадия исследования маситиниба проходила на крысах. «Животных, условно говоря, заражают БАС, и препарат начинают вводить после того, как животное становится обездвиженным. По сути, с людьми происходит та же история: препарат начинают вводить, когда БАС уже как-то проявляется, то есть когда уже есть некоторые элементы обездвиженности, нарушения подвижности. И в группах крыс, которые участвовали в этом исследовании, продолжительность жизни в той группе, которая получала препарат, была гораздо выше, чем в той группе, которая не получала», — сказал Мора.
Двойное слепое исследование
По словам Моры, когда стало понятно, что препарат «работает на крысах», было решено начать исследования с участием людей. «Мы группы пациентов разделили на три. Одна группа получила большую дозировку 4,5 миллиграмма на килограмм массы тела в день. Вторая группа получала три миллиграмма, и третья группа получала то, что называется плацебо, то есть пустышку», — сообщил ученый.
Он пояснил, что плацебо является очень важной составляющей любого исследования. Врачи, по словам Моры, при этом не знают, какой пациент получает препарат, а какой — «пустышку», что необходимо для составления объективной картины.
«Компьютер собирает эти наборы, таблетки и распределяет между пациентами, ни один врач не знает, что пациент получает. То есть пациент не знает, что получает, но и врач не знает, что получают его пациенты. Это называется двойное слепое исследование. То есть врачи оценивают всех пациентов абсолютно одинаково без каких-то своих предпочтений. И на отношение врача никаким образом не влияет знание, кто что получает, потому что врач не знает, кто что получает. В конце исследования через 48 недель компьютер, программа покажет, какая группа получала препарат, в какой дозировке получала, какая получала плацебо, и какая из этих групп показывает лучший результат», — пояснил испанский специалист.
По словам Моры, если группа пациентов, которая принимает препарат, показывает примерно такие же результаты, как группа, получающая плацебо, это означает, что препарат, по сути, не работает. Он добавил, что если группа, которая получает препарат, показывает результаты хуже, чем группа, получающая плацебо, это означает, что препарат опасен.
«Поэтому, чтобы быть уверенным, что препарат не вредит, в течение всего исследования пациенты проходят очень четкие, очень важные этапы оценки, когда оценивается их состояние. Поэтому врачи в течение всего исследования назначают массу анализов крови, анализов мочи, массу других лабораторных исследований, которые должны показать, что препарат работает и, главное, что он не вредит. По моему опыту пациенты, которые участвуют в исследованиях, всегда показывают хороший результат, то есть им как будто становится лучше, потому что они приходят в исследования с надеждой, что это поможет, и их, конечно, гораздо чаще смотрят врачи, чем в обычной жизни», — сказал Мора.
Он уточнил, что маситиниб всегда дают пациентам в сочетании с препаратом рилузол, так как его в чистом виде принимать нельзя.
Шкала оценки состояния
Мора рассказал, что участвовавшие в исследовании пациенты также были разделены на «две функциональные группы по скорости прогрессирования заболевания», которая оценивается по специальной шкале.
«Это люди (в первой группе – ред.) с достаточно медленной прогрессией и пациенты (во второй группе – ред.), у которых заболевание прогрессирует быстро. Прогрессия заболевания оценивается по специальной шкале… Биомаркером является некий анализ, который мог бы показать, с какой скоростью и как прогрессирует заболевание. В БАС такого маркера нет… Единственный способ – это осматривать пациента. Поэтому мы разработали функциональную шкалу оценки состояния больных БАС. Эта шкала оценивает 12 двигательных функций: к примеру, как вы говорите, как глотаете, как пишете, поднимаетесь по ступенькам, как справляетесь с каждодневной гигиеной, как вы дышите, как вы поворачиваетесь в кровати, как вы перемещаетесь в кровати», — сказал Мора.
По его словам, каждой из перечисленных двигательных активностей можно присвоить 4 балла: четверка означает, что пациент справляется со своей ежедневной деятельностью абсолютно самостоятельно, а ноль обозначает полную зависимость от помощи постороннего человека. «Таким образом, если пациент справляется со всем самостоятельно, то у него максимальный балл 48. Эффективность препарата мы оценивали в том, с какой скоростью пациенты теряют баллы по этой шкале», — пояснил испанский специалист.
По его словам, врачи также использовали дополнительные шкалы, в том числе по оценке качества жизни пациента, по оценке форсированной жизненной емкости легких, то есть силы дыхательной мускулатуры. «Мы оценивали и время, за которое у пациента снижается состояние на 9 баллов по этой шкале. Если у пациента очень быстрая прогрессия, то, конечно, время, за которое его состояние ухудшится на 9 баллов, будет очень быстрым. Но если прогрессия медленная или препарат работает, то мы понимаем, что время будет уже гораздо медленнее», — пояснил врач.
Он уточнил, что грядет второе исследование маситиниба, участников которого будут отбирать по специальным критериям. Многие из этих критериев применялись в первом исследовании, ко второму также прибавятся новые. Так, по словам Моры, в исследовании должны принимать участие те пациенты, у которых диагностирован именно БАС. Как пояснил врач, в исследовании не могут принять участие пациенты, у которых есть и сопутствующие заболевания, проявление которых может повлиять на ход болезни или усугубить БАС. К таким заболеваниям относятся, например, деменция, нарушение сердечно-сосудистой системы, онкология.
Выбыть из исследования
По словам Моры, из 465 пациентов, желавших принять участие в исследовании, было отобрано 394 человека, часть которых выбыла из исследования в процессе его проведения. Он пояснил, что пациентам перед началом исследования разъясняется, как оно будет проходить, все его плюсы и минусы, после чего пациенты подписывают соглашение и могут выбыть из исследования добровольно в любой момент. Мора указал, что следует помнить о возможности побочных эффектов приема препарата: в одном случае у пациента развилась печеночная недостаточность, в связи с чем он выбыл из исследования. Но в течение исследования не было зафиксировано летальных случаев от приема препарата, а у пациентов предусмотрена медицинская страховка, подчеркнул докладчик.
«Если много пациентов выходят из исследования, трудно провести в конце правильный статистический анализ. Очень важно, чтобы пациенты продолжали участвовать в исследовании, даже если не чувствуют никаких улучшений. Причин, почему нет улучшений, может быть две – они в группе плацебо или они получают исследуемый препарат, он влияет на заболевание, он его замедляет, но пациенты этого не ощущают, не чувствуют. И я настаиваю, мое личное мнение, что пациенты в обязательном порядке должны максимально оставаться в исследовании, потому что это социальная ответственность перед всеми пациентами БАС во всем мире, перед тысячами людей, которые смотрят на это исследование, ждут результатов», — сказал Мора.