Чем больше металличность тем электроотрицательность
Зависимость свойств элементов от строения их атомов
Теория строения атомов объясняет периодическое изменение свойств элементов при увеличении порядкового номера.
Важнейшими свойствами элементов являются металличность (металлические свойства) и неметалличность (неметаллические свойства).
Металличность — это способность атомов элемента отдавать электроны. Количественной характеристикой металличности элемента является энергия ионизации (I).
Энергия ионизации атома — это количество энергии, которое необходимо для отрыва электрона от атома элемента (Э), т. е. для превращения атома в положительно заряженный ион:
Э 0 + I = Э + + ē
Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента.
Неметалличность — это способность атомов элемента присоединять электроны.
Количественной характеристикой неметалличности элемента является сродство к электрону (Еср). Сродство к электрону — это энергия, которая выделяется при присоединении электрона к нейтральному атому, т. е. при превращении атома в отрицательно заряженный ион:
Э 0 + ē = Э — + Еср
Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства элемента.
Универсальной характеристикой металличности и неметалличности элементов является электроотрицательность элемента (ЭО).
Электроотрицательность элемента характеризует способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
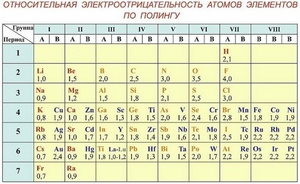
При определении значений относительной электроотрицательности различных элементов за единицу принята ЭО лития.
Относительная электроотрицательность элементов I – IV периодов
Рассмотрим, как изменяются некоторые характеристики элементов в малых периодах слева направо:
— Заряд ядер атомов увеличивается.
— Число электронных слоев атомов не изменяется.
— Число электронов на внешнем слое атомов увеличивается от до 8.
— Радиус атомов уменьшается.
— Прочность связи электронов внешнего слоя с ядром увеличивается.
— Энергия ионизации увеличивается.
— Сродство к электрону увеличивается.
— Металличность элементов уменьшается.
— Неметалличность элементов увеличивается.
В больших периодах с увеличением заряда ядер электронное строение атомов изменяется сложнее, чем в малых периодах. Поэтому и изменение свойств элементов в больших периодах более сложное.
Рассмотрим это изменение свойств на примере четвертого периода. Он начинается, как и малые периоды, двумя s-элементами — K и Са, в атомах которых на внешнем слое находится соответственно 1 и 2 электрона. Эти элементы имеют наибольшие радиусы атомов среди всех элементов IV периода, поэтому электроны внешнего слоя слабо связаны с атомами, и эти элементы являются типичными металлами. Эти элементы имеют самые низкие в IV периоде значения ЭО.
В атомах следующих десяти элементов (от Sc до Zn) происходит заполнение d-подуровня предвнешнего слоя; на внешнем слое число электронов в атомах всех этих элементов равно 2 или 1 (Cr, Сu). Радиусы атомов d-элементов мало различаются между собой. Поэтому d-элементы похожи по своим свойствам — все они являются металлами (но менее активными, чем K и Са, которые имеют меньшие заряды ядер и большие радиусы атомов). ЭО всех d-элементов IV периода изменяется в небольшом интервале от 1,3 до 1,9.
В атомах последних шести элементов IV периода (от Gа до Kr) заполняется р-подуровень внешнего слоя, поэтому количество электронов на внешнем слое увеличивается от 3 до 8. Радиусы атомов этих элементов уменьшаются слева направо. Уменьшение радиуса атомов и увеличение числа электронов на внешнем слое являются причиной уменьшения металличности и увеличения неметалличности элементов слева направо. ЭО этих элементов изменяется от 1,6 у Gа до 2,8 y Br.
Рассмотрим, как изменяются некоторые характеристики элементов в главных подгруппах сверху вниз:
В малых периодах закономерно изменяется высшая валентностъ элементов: во втором периоде от I у Li до V у N; в третьем периоде от у Na до VII у Cl. В большом четвертом периоде высшая валентность увеличивается от I у K до VII у Мn; у следующих элементов она понижается до II у Zn, а потом снова увеличивается от III у Gа до VII у Вr.
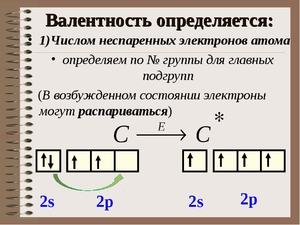
Периодическое изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
Валентные электроны — это электроны, которые могут участвовать в образовании химических связей.
В атомах s- и р-элементов валентными являются, как правило, все электроны внешнего слоя.
В атомах d-валентными являются электроны внешнего слоя (2 или 1), а также все или некоторые d-электроны предвнешнего слоя.
Число валентных электронов для большинства элементов равно номеру группы.
Значение периодического закона и периодической системы элементов Д. И. Менделеева
Ученые разных стран — У. Одлинг и Дж. Ньюлендс (Англия), Ж. Дюма и А. Шанкуртуа (Франция), И. Деберёйнер и Л. Мёйер (Германия) и другие пытались классифицировать химические элементы. Они установили существование групп, похожих по свойствам элементов, но не обнаружили взаимосвязь всех химических элементов. Эту взаимосвязь открыл великий русский ученый Д. И. Менделеев и выразил ее в периодическом законе. На основе периодического закона Д. И. Менделеев предсказал существование двенадцати элементов, которые в то время еще не были открыты и определил их положение в периодической системе. Свойства трех из этих элементов он подробно описал и условно назвал их «экабором», «экаалюминием» и «экасилицием», так как считал, что эти элементы должны быть похожи по свойствам на бор, алюминий и кремний. Через несколько лет (еще при жизни Менделеева) эти элементы были открыты и получили названия — галлий Gа, скандий Sc и германий Gе.
Физический смысл периодического закона стал понятен после создания теории строения атома. Но сама эта теория развивалась на основе периодического закона и периодической системы.
Периодический закон — один из основных законов природы и важнейший закон химии. Современный этап развития химической науки начинается с открытия периодического закона. Он помогает ученым создавать новые химические элементы и новые соединения элементов, получать вещества с нужными свойствами. Этот закон играет важную роль в развитии всего естествознания (физики, биологии и других наук).
Периодический закон имеет большое философское значение — он подтвердил наиболее общие законы развития природы.
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электроотрицательность элементов по таблице Менделеева
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
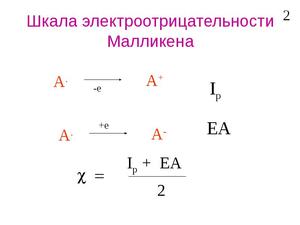
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Чем больше металличность тем электроотрицательность
§4.6. Некоторые закономерности в Периодической таблице Д.И. Менделеева.
Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Рассмотрим важнейшие из них (рис. 4-6).
Рис.4-6. Закономерности Периодической таблицы, связанные с электроотрицательностью, металлическими и окислительно-восстановительными свойствами элементов.
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
У d- и f-элементов, как мы знаем, есть «резервные» электроны из «предпоследних» оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: это H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Рис. 4-7. Полуметаллы расположены примерно вдоль диагонали, проходящей от левого верхнего к правому нижнему углу блока р-элементов в Периодической таблице.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У «тяжелых» благородных газов криптона и ксенона, которые находятся в нижней части группы, удается «отобрать» электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для «легких» гелия, неона и аргона это осуществить не удается.
в) Закономерности, связанные с размерами атомов.
г) Закономерности, связанные с валентностью элементов.
8. Элементы одной и той же подгруппы (в короткой форме таблицы) или группы (в длинной) имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
9. s-Элементы имеют валентности, совпадающие с номером их группы (в любой форме таблицы).
10. p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы в короткой форме Периодической таблицы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы в короткой форме таблицы (этот номер совпадает с числом электронов на внешней оболочке).
11. d-Элементы обычно обнаруживают несколько разных валентностей, которые нельзя точно предсказать по номеру группы.
Общая и неорганическая химия для студентов заочного отделения ИХТИ
Периодический закон Д.И. Менделеева и периодичность свойств атомов. Конспект
1. Современная формулировка периодического закона и структура периодической системы Д.И.Менделеева
В 1869 г. Д.И. Менделееву удалось сформулировать периодический закон – важнейший закон природы:
свойства химических элементов, а, следовательно, и свойства образуемых ими простых и сложных веществ состоят в периодической зависимости от их атомного веса.
Согласно этой формулировке наблюдалось несоответствие положения некоторых элементов в периодической системе Менделеева:
В начале 20 века закон Менделеева и его система были обоснованы на квантово-механическом уровне. Существо этого закона было полностью сохранено, а в качестве фундаментальной константы атома стал использоваться
заряд ядра атома
(соответствующий порядковому номеру элемента),
что позволило устранить наблюдавшиеся несоответствия.
Исходя из структуры электронной оболочки атомов число элементов
в III периоде – должно было бы быть 18;
в IV периоде – должно было бы быть 32;
в V периоде – должно было бы быть 50.
Это обусловлено тем, что заполнение d-состояний электронами запаздывает на один период, а заполнение f-состояний – на два периода.
Отличие реальной системы от теоретически возможной заключается в том, что в первой не учитывалось электрон-электронное взаимодействие. Теоретический учет этого взаимодействия – чрезвычайно сложная задача. На качественном уровне приходится учитывать три эффекта –
эффект экранирования электронами ядра атома,
эффект проникновения электронов к ядру,
взаимное отталкивание электронов, принадлежащих одному и тому же энергетическому слою
Эффект экранирования ядра связан с тем, что внутренние электроны атома частично заслоняют ядро, в результате чего уменьшается его воздействие на внешний электрон. Эффект экранирования учитывается некоторой постоянной Sэкр, называемой константой экранирования. Заряд ядра с учетом экранирования называется эффективным зарядом и определяется соотношением Zэфф. = Z – Sэкр. Экранирование внешнего электрона возрастает с увеличением общего числа электронов в атоме.
Эффект проникновения электронов к ядру обусловлен тем, что электрон, согласно положениям квантовой механики, может находиться в любой точке атома. Это означает, что внешний электрон часть времени находится вблизи ядра, проникая через слои внутренних электронов, и не испытывает при этом их экранирующего действия.
Распределение электронной плотности относительно ядра изображают кривой распределения вероятности нахождения электрона в шаровом слое радиуса r толщиной dr, объем которого dV = 4pr 2 dr.
Для одного и того же энергетического слоя наибольшую проникающую способность проявляют s-электроны, меньшую – p-электроны, еще меньшую – d-электроны (рис.1). Число максимумов на кривой определяется числом n. Для 3s-электрона Nmax = n, для р-электрона Nmax = (n – 1), для d-электрона Nmax = (n – 2). Эффект проникновения увеличивает прочность связи электрона с ядром.
Взаимное отталкивание электронов, принадлежащих одному и тому же энергетическому слою, оказывает большое влияние на прочность связи электрона с ядром. Это отталкивание особенно сильно проявляется между двумя электронами с противоположными спинами, находящимися на одной орбитали.
Эти эффекты приводят к изменению эффективного заряда ядра атома, что позволяет объяснить реальную структуру электронной оболочки атома.
В настоящее время система Д.И. Менделеева представляет собой предельно краткую и четкую физико-химическую энциклопедию. В современной формулировке периодический закон Д.И.Менделеева звучит следующим образом: свойства элементов, а также свойства и формы образуемых ими соединений находятся в периодической зависимости от заряда ядра атомов элементов.
На основе периодического закона разработаны графические системы Д.И. Менделеева. В настоящее время их насчитывается более 3 тысяч.
Наиболее распространены два варианта таблицы – короткопериодный и длиннопериодный.
Периоды – горизонтальные ряды, объединяющие элементы с одинаковым значением главного квантового числа n. Номер периода соответствует числу заполненных электронами энергетических уровней атома каждого конкретного элемента.
Группы – вертикальные ряды, объединяющие элементы с одинаковым числом валентных электронов.
Современная периодическая таблица состоит из 7 периодов: первый содержит всего два элемента, второй и третий – по 8 элементов (малые периоды), четвертый и пятый – по 18 элементов, шестой – 32 элемента, седьмой период не завершен, но должен содержать также 32 элемента (большие периоды).
Каждый период начинается с двух s-элементов, в атомах которых впервые появляется электрон со значением n, соответствующим номеру заполняемого периода, и заканчивается шестью p-элементами. В больших периодах между s- и р-элементами размещается по десять d- элементов. Все f-элементы условно помещаются в ячейки лантана (лантаноиды) и актиния (актиноиды), а их символы обычно выносятся за пределы периодической таблицы в виде рядов.