Чем больше температура тем больше скорость
Скорость химической реакции
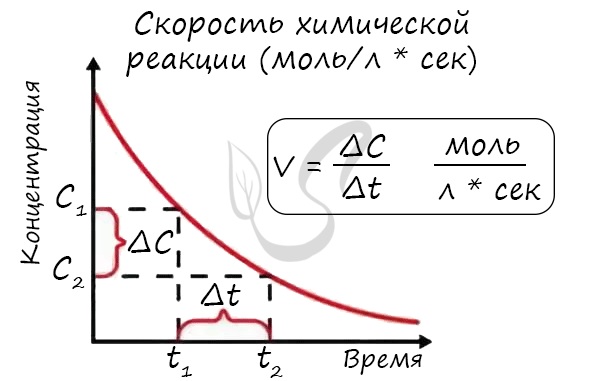
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
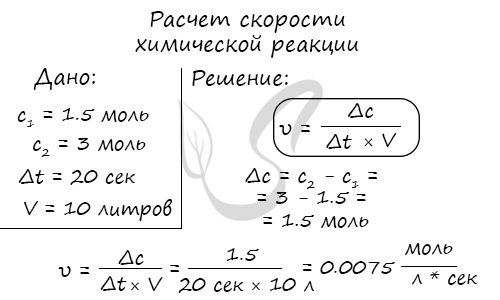
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
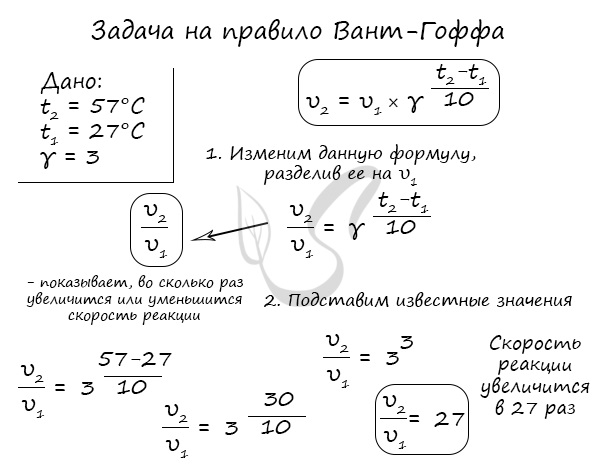
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
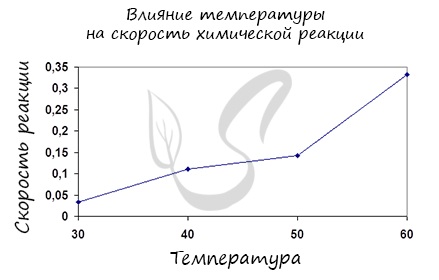
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
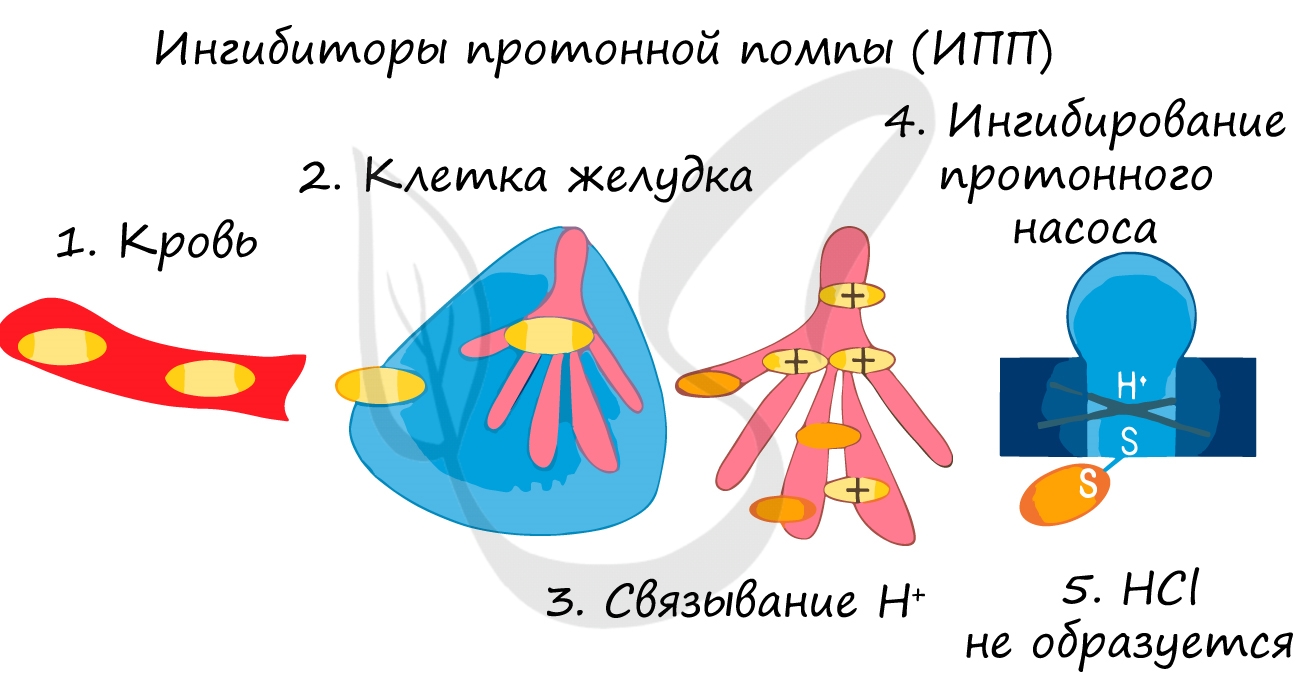
Катализаторы и ингибиторы
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.
Тепловое движение атомов и молекул. Связь температуры вещества со скоростью хаотического движения частиц. Броуновское движение. Диффузия. Тепловое равновесие
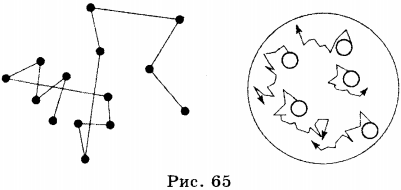
1. В 1827 г. английский ботаник Р. Броун, изучая с помощью микроскопа частички цветочной пыльцы, взвешенные в воде, заметил, что эти частички совершают беспорядочное движение; они как бы дрожат в воде.
Причину движения частиц пыльцы долго не могли объяснить. Сам Броун предположил вначале, что они движутся, потому что они живые. Движение частиц пытались объяснить неодинаковым нагреванием разных частей сосуда, происходящими химическими реакциями и т.д. Лишь значительно позже поняли истинную причину движения частиц, взвешенных в воде. Эта причина — движение молекул.
Молекулы воды, в которой находится частица пыльцы, движутся и ударяются о неё. При этом с разных сторон о частицу ударяется неодинаковое число молекул, что и приводит к её перемещению.
Пусть в момент времени \( t_1 \) под действием ударов молекул воды частица переместилась из т. А в т. В. В следующий момент времени большее число молекул ударяется о частицу с другой стороны, и направление её движения изменяется, она перемещается из т. В в т. С. Таким образом, движение частицы пыльцы является следствием движения и ударов о неё молекул воды, в которой пыльца находится (рис. 65). Подобное явление можно наблюдать, если поместить в воду частицы краски или сажи.
На рисунке 65 показана траектория движения частицы пыльцы. Видно, что нельзя говорить о каком-то определённом направлении её движения; оно всё время меняется.
Поскольку движение частицы — следствие движения молекул, то можно заключить, что молекулы движутся беспорядочно (хаотически). Иными словами, нельзя выделить какое-то определённое направление, в котором движутся все молекулы.
Движение молекул никогда не прекращается. Можно сказать, что оно непрерывно. Непрерывное хаотическое движение атомов и молекул называют тепловым движением. Такое название определяется тем, что скорость движения молекул зависит от температуры тела.
Поскольку тела состоят из большого числа молекул и движение молекул беспорядочно, то нельзя точно сказать, сколько ударов будет испытывать та или иная молекула со стороны других. Поэтому говорят, что положение молекулы, её скорость в каждый момент времени случайны. Однако это не означает, что движение молекул не подчиняется определённым законам. В частности, хотя скорости молекул в некоторый момент времени различны, у большинства из них значения скорости близки к некоторому определённому значению. Обычно, говоря о скорости движения молекул, имеют в виду среднюю скорость \( (v_<ср>) \) .
2. С точки зрения движения молекул можно объяснить такое явление, как диффузия.
Диффузией называется явление проникновения молекул одного вещества в промежутки между молекулами другого вещества.
Мы ощущаем запах духов на некотором расстоянии от флакона. Это объясняется тем, что молекулы духов, так же как и молекулы воздуха, движутся. Между молекулами существуют промежутки. Молекулы духов проникают в промежутки между молекулами воздуха, а молекулы воздуха — в промежутки между молекулами духов.
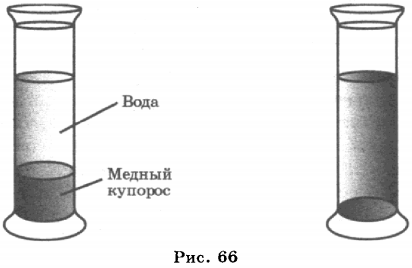
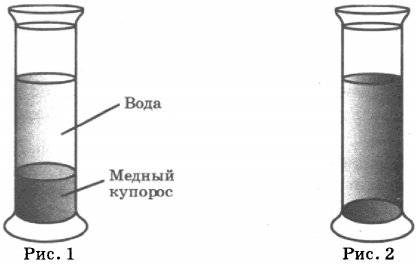
Диффузию жидкостей можно наблюдать, если в мензурку налить раствор медного купороса, а сверху — воду так, чтобы между этими жидкостями была резкая граница. Через два-три дня можно заметить, что граница уже не будет такой резкой; через неделю она совсем размоется. Спустя месяц жидкость станет однородной и во всем сосуде будет окрашена одинаково (рис. 66).
В этом опыте молекулы медного купороса проникают в промежутки между молекулами воды, а молекулы воды — в промежутки между молекулами медного купороса. При этом следует иметь в виду, что плотность медного купороса больше, чем плотность воды.
Опыты показывают, что диффузия в газах происходит быстрее, чем в жидкостях. Это объясняется тем, что газы имеют меньшую плотность, чем жидкости, т.е. молекулы газов расположены на больших расстояниях друг от друга. Ещё медленнее происходит диффузия в твёрдых телах, поскольку молекулы твёрдых тел находятся ещё ближе друг к другу, чем молекулы жидкостей.
В природе, технике, быту можно обнаружить множество явлений, в которых проявляется диффузия: окрашивание, склеивание и др. Диффузия имеет большое значение в жизни человека. В частности, благодаря диффузии кислород в организм человека поступает не только через лёгкие, но и через кожу. По этой же причине питательные вещества проникают из кишечника в кровь.
Скорость диффузии зависит не только от агрегатного состояния вещества, но и от температуры.
Если приготовить два сосуда с водой и медным купоросом для проведения опыта по диффузии и один из них поставить в холодильник, а другой оставить в комнате, то можно обнаружить, что при более высокой температуре диффузия будет происходить быстрее. Это происходит потому, что при повышении температуры быстрее движутся молекулы. Таким образом, скорость движения молекул
и температура тела связаны между собой.
Чем больше средняя скорость движения молекул тела, тем выше его температура.
3. Молекулярная физика в отличие от механики изучает системы (тела), состоящие из большого числа частиц. Эти тела могут находиться в различных состояниях.
Величины, характеризующие состояние системы (тела), называются параметрами состояния. К параметрам состояния относят давление, объём, температуру.
Возможно такое состояние системы, при котором параметры, характеризующие его, остаются неизменными сколь угодно долго при отсутствии внешних воздействий. Это состояние называется тепловым равновесием.
Так, объём, температура, давление жидкости в сосуде, находящейся в тепловом равновесии с воздухом в комнате, не изменяются, если для этого не будет каких-либо внешних причин.
4. Состояние теплового равновесия системы характеризует такой параметр, как температура. Особенностью его является то, что значение температуры во всех частях системы, находящейся в состоянии теплового равновесия, одинаково. Если опустить в стакан с горячей водой серебряную ложку (или ложку из любого другого металла), то ложка будет нагреваться, а вода — остывать. Это будет происходить до тех пор, пока не наступит тепловое равновесие, при котором ложка и вода будут иметь одинаковую температуру. В любом случае, если взять два различно нагретых тела и привести их в соприкосновение, то более нагретое тело будет остывать, а более холодное — нагреваться. Через некоторое время система, состоящая из этих двух тел, придёт в тепловое равновесие, и температура этих тел станет одинаковой.
Так, одинаковой станет температура ложки и воды, когда они придут в тепловое равновесие.
Температура — это физическая величина, которая характеризует тепловое состояние тела.
Так, температура горячей воды выше, чем холодной; зимой температура воздуха на улице ниже, чем летом.
Единицей температуры является градус Цельсия (°С). Температуру измеряют термометром.
В основе устройства термометра и соответственно способа измерения температуры лежит зависимость свойств тел от температуры, в частности свойство тела расширяться при нагревании. В термометрах могут быть использованы разные тела: и жидкие (спирт, ртуть), и твёрдые (металлы) и газообразные. Их называют термометрическими телами. Термометрическое тело (жидкость или газ) помещают в трубку, снабжённую шкалой, её приводят в соприкосновение с телом, температуру которого хотят измерить.
При построении шкалы выбирают две основные (реперные, опорные) точки, которым приписывают определённые значения температуры, и интервал между ними делят на несколько частей. Значение каждой части соответствует единице температуры по данной шкале.
Температуру по абсолютной шкале обозначают буквой \( T \) . Связь между температурой по абсолютной шкале \( (T) \) и температурой по шкале Цельсия \( (
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Броуновское движение частиц краски в воде является следствием
1) притяжения между атомами и молекулами
2) отталкивания между атомами и молекулами
3) хаотического и непрерывного движения молекул
4) перемещения слоёв воды из-за разности температуры нижних и верхних слоёв
2. В какой из приведённых ниже ситуаций речь идёт о броуновском движении?
1) беспорядочное движение пылинок в воздухе
2) распространение запахов
3) колебательное движение частиц в узлах кристаллической решётки
4) поступательное движение молекул газа
А. Отсутствует выделенное направление движения молекул.
Б. Движение молекул не подчиняется никаким законам.
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
4. Положение молекулярно-кинетической теории строения вещества о том, что частицы вещества участвуют в непрерывном хаотическом движении, относится
1) только к газам
2) только жидкостям
3) только к газам и жидкостям
4) к газам, жидкостям и твёрдым телам
5. Какое (-ие) положение (-я) молекулярно-кинетической теории строения вещества подтверждает явление диффузии?
А. Молекулы находятся в непрерывном хаотическом движении
Б. Между молекулами существуют промежутки
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
6. При одинаковой температуре диффузия в жидкостях происходит
1) быстрее, чем в твёрдых телах
2) быстрее, чем в газах
3) медленнее, чем в твёрдых телах
4) с той же скоростью, что и в газах
7. Укажите пару веществ, скорость диффузии которых наименьшая при прочих равных условиях
1) раствор медного купороса и вода
2) пары эфира и воздух
3) железная и алюминиевая пластины
4) вода и спирт
8. Вода кипит и превращается в пар при температуре 100 °С. Средняя скорость движения молекул пара
1) равна средней скорости движения молекул воды
2) больше средней скорости движения молекул воды
3) меньше средней скорости движения молекул воды
4) зависит от атмосферного давления
9. Тепловое движение молекул
1) прекращается при 0 °С
2) прекращается при 100 °С
3) непрерывно
4) имеет определённое направление
10. Воду нагревают от комнатной температуры до 80 °С. Что происходит со средней скоростью движения молекул воды?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала увеличивается, а начиная с некоторого значения температуры, остаётся неизменной
11. Один стакан с водой стоит на столе в тёплом помещении, другой — в холодильнике. Средняя скорость движения молекул воды в стакане, стоящем в холодильнике
1) равна средней скорости движения молекул воды в стакане, стоящем на столе
2) больше средней скорости движения молекул воды в стакане, стоящем на столе
3) меньше средней скорости движения молекул воды в стакане, стоящем на столе
4) равна нулю
12. Из перечня приведённых ниже высказываний выберите два правильных и запишите их номера в таблицу
1) тепловое движение молекул происходит только при температуре большей 0 °С
2) диффузия в твёрдых телах невозможна
3) между молекулами одновременно действуют силы притяжения и силы отталкивания
4) молекула — это наименьшая частица вещества
5) скорость диффузии увеличивается с повышением температуры
13. В кабинет физики принесли ватку, смоченную духами, и сосуд, в который налили раствор медного купороса (раствор голубого цвета), а поверх осторожно налили воду (рис. 1). Было замечено, что запах духов распространился по объёму всего кабинета за несколько минут, тогда как граница между двумя жидкостями в сосуде исчезла только через две недели (рис. 2).
Выберите из предложенного перечня два утверждения, которые соответствуют результатам проведённых экспериментальных наблюдений. Укажите их номера.
1) Процесс диффузии можно наблюдать в газах и жидкостях.
2) Скорость диффузии зависит от температуры вещества.
3) Скорость диффузии зависит от агрегатного состояния вещества.
4) Скорость диффузии зависит от рода жидкостей.
5) В твёрдых телах скорость диффузии наименьшая.