Чем выделяется соляная кислота
Чем выделяется соляная кислота
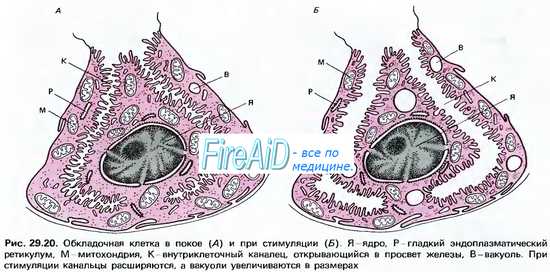
Хлористоводородная кислота вырабатывается париетальными (обкладочными) клетками желез желудка. Эти клетки характеризуются богатством митохондрий, расположенных вдоль внутриклеточных канальцев. Площадь мембраны канальцев и апикальной поверхности клеток во время стимуляции на высоте секреции резко возрастает за счет встроенных в мембрану тубовезикул (трубочек-пузырьков), что сопровождается значительным увеличением клеточных канальцев, проникающих вплоть до базальной мембраны. Это значительно увеличивает возможности синтеза гландулоцитом соляной кислоты. Вдоль канальцев располагается множество митохондрий, площадь внутренней мембраны которых возрастает в процессе биосинтеза НСl. Соответственно увеличивается площадь контакта канальцев и апикальной мембраны клетки. Таким образом, увеличение секреторной активности париетальных клеток обусловлено увеличением площади секреторной мембраны.
Секреция НСl является ярко выраженным цАМФ-зависимым процессом, активация которого протекает на фоне усиления гликогенолитиче-ской и гликолитической активности, что сопровождается продукцией пирувата. Окислительное декарбоксилирование пирувата до ацетил-КоА. С02 осуществляется пируватдегидрогеназным комплексом и сопровождается накоплением в цитоплазме НАД • Н2. Последний используется для генерирования Н+ в процессе секреции НС1. Расщепление триглицеридов в слизистой оболочке желудка под влиянием триглицеридлипазы и последующая утилизация жирных кислот создает в 3—4 раза больший приток восстановительных эквивалентов в митохондриальную цепь переноса электронов. Как аэробный гликолиз, так и окисление жирных кислот запускаются посредством цАМФ-зависимого фосфорилирования соответствующих ферментов, обеспечивающих генерирование ацетил-КоА в цикле Кребса и восстановительных эквивалентов для электронпереносящей цепи митохондрий. Са2+ является необходимым элементом секреторной системы НС1.
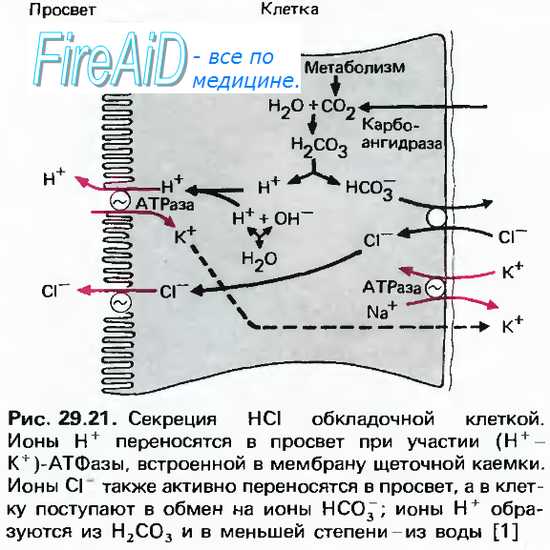
Процесс цАМФ-зависимого фосфорилирования обеспечивает активацию желудочной карбоангидразы, которая является регулятором кислотно-основного равновесия в кислотопродуцирующих клетках. Работа этих клеток сопровождается длительной и массовой потерей ионов Н+, что приводит к накоплению в клетке ОН», способных оказать повреждающее действие на клеточные структуры. Нейтрализация гидроксильных ионов и является главной функцией карбоангидразы. Образующиеся бикарбонатные ионы посредством электронейтрального механизма выводятся в кровь, а ионы СГ входят в клетку.
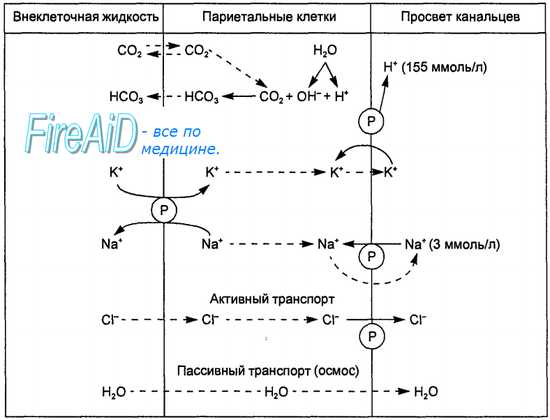
Кислотопродуцирующие клетки на наружных мембранах имеют две мембранные ферментные системы, участвующие в механизмах продукции Н+ и секреции НС1. Ими являются Na+-K+-ATФaзa и Н+-К+-АТФаза. Na+-К+-АТФаза, расположенная в базолатеральных мембранах клеток, переносит К+ из крови в обмен на Na+, а Н+-К+-АТФаза, локализованная в секреторной мембране, транспортирует калий из первичного секрета в обмен на выводимые в желудочный сок ионы Н+. Процесс образования соляной кислоты кислотопродуцирующими клетками схематически представлен на рис. 11.11.
В период секреции митохондрии всей массой охватывают в виде муфты секреторные канальцы, и их мембраны сливаются, образуя митохондриально-секреторный комплекс, где ионы Н+ непосредственно акцептируются Н+-К+-АТФазой секреторной мембраны и транспортируются из клетки.
Таким образом, кислотообразующая функция обкладочных клеток осуществляется благодаря процессу фосфорилирования — дефосфорилирования, наличию митохондриальной окислительной цепи, транспортирующей ионы Н+ из матриксного пространства, а также активности Н+-К+-АТФазы секреторной мембраны, перекачивающей протоны из клетки за счет энергии АТФ.
Вода поступает в канальцы клетки путем осмоса. Конечный секрет, поступающий в канальцы, содержит НСl в концентрации 155 ммоль/л, хлористый калий в концентрации 15 ммоль/л и очень малое количество хлористого натрия.
Чем выделяется соляная кислота
В полости желудка хлористоводородная кислота:
1) стимулирует секреторную активность желез желудка;
2) способствует превращению пепсиногена в пепсин путем отщепления ингибирующего белкового комплекса;
3) создает оптимальную кислотность для действия протеолитических ферментов желудочного сока;
4) вызывает денатурацию и набухание белков (что способствует их расщеплению ферментами);
5) обеспечивает антибактериальный эффект секрета;
6) участвует в осуществлении механизма перехода пищи из желудка в двенадцатиперстную кишку, раздражая хеморецепторы ее слизистой оболочки;
7) участвует в регуляции секреции желудочных и поджелудочных желез, стимулируя образование гастроинтестинальных гормонов (гастрина, секретина);
8) возбуждает секрецию фермента энтерокиназы энтероцитами слизистой оболочки двенадцатиперстной кишки;
9) участвует в створаживании молока;
10) стимулирует моторную активность желудка.
Ферменты желудочного сока и их роль в пищеварении.
В полости желудка под влиянием протеолитических ферментов осуществляется начальный гидролиз белков до альбумоз и пептонов. Протеолитические ферменты желудочного сока обладают активностью в широком диапазоне колебаний рН с оптимумом действия при рН 1,5—2,0 и 3,2—4,0. Это обеспечивает гидролиз белков в условиях значительных колебаний концентрации соляной кислоты в желудочном соке, в слоях пищи, прилежащих к слизистой оболочке желудка, и в глубине содержимого желудка.
В желудочном соке представлены семь видов пепсиногенов, объединенных общим названием пепсины. Образование пепсинов осуществляется из неактивных предшественников — пепсиногенов, находящихся в клетках желудочных желез в виде гранул зимогена. В просвете желудка пепсиноген активируется НС1 путем отщепления от него ингибирующего белкового комплекса. В дальнейшем в ходе секреции желудочного сока активация пепсиногена осуществляется аутокаталитически под действием уже образовавшегося пепсина.
При оптимальной величине рН среды пепсин осуществляет гидролиз белков, разрывая в белковой молекуле пептидные связи, образованные группами фениламина, тирозина, триптофана и других аминокислот. В результате этого белковая молекула распадается на пептоны и пептиды. Пепсин обеспечивает гидролиз основных белковых веществ, особенно коллагена — основного компонента волокон соединительной ткани.
К основным пепсинам желудочного сока относятся следующие.
Пепсин А — группа ферментов, гидролизирующих белки при оптимуме рН 1,5—2,0. Часть пепсиногена (около 1%) переходит в кровеносное русло, откуда вследствие небольшого размера молекулы фермента проходит через клубочковый фильтр в почках и выделяется с мочой (уропепсиноген). Определение содержания уропепсина в моче используется в лабораторной практике для характеристики протеолитической активности желудочного сока.
Гастриксин (пепсин С), гидролизирующий белки при оптимуме рН 3,2— 3,5. Пепсин В (парапепсин) расщепляет желатину и белки соединительной ткани. При рН 5,6 и выше протеолитическое действие фермента ослабляется.
Желудочный сок содержит ряд непротеолитических ферментов. Среди них — желудочная липаза, расщепляющая жиры, которые находятся в пище в эмульгированном состоянии (жиры молока), на глицерин и жирные кислоты при рН 5,9—7,9. У грудных детей желудочная липаза расщепляет до 59 % жира молока. В желудочном соке взрослых людей липазы мало. Поэтому основное количество жиров переваривается в тонком кишечнике.
Клетками поверхностного эпителия слизистой оболочки желудка вырабатывается лизоцим (муромидаза). Лизоцим обусловливает бактерицидные свойства желудочного сока.
Уреаза расщепляет мочевину в желудке при рН 8,0. Освобождающийся при этом аммиак нейтрализует соляную кислоту и предотвращает избыточную кислотность химуса, поступающего из желудка в двенадцатиперстную кишку.
Кислотность желудка
Врачи
Кислота, образующаяся в желудке, необходима для переваривания пищи, для усвоения железа, кальция, витамина В12 и некоторых лекарственных препаратов (например, тироксина и кетоконазола). Благодаря высокой кислотности желудочного сока уничтожаются проглоченные микроорганизмы, включая бактерии, вирусы. Таким образом предотвращается развитие инфекции, избыточный рост бактерий в тонкой кишке.
Однако чрезмерно высокие уровни секреции кислоты представляют опасность для целостности слизистой оболочки желудка и двенадцатиперстной кишки. Поэтому секреция желудочной кислоты должна точно регулироваться и вырабатываться в соответствии с потребностями.
Кислоту производят париетальные клетки желудка. Их работу жестко контролируют многочисленные механизмы, включая блуждающий нерв, гастрин, гистамин, грелин, соматостатин, глюкагоноподобный пептид. Благодаря всем эти механизмам (часть из которых до сих пор до конца не изучена) обеспечивается правильная секреция соляной кислоты.
Сейчас же речь пойдет о повышенной кислотности желудка.
Существует несколько причин повышения кислотности желудка:
Итак, чем же опасна повышенная кислотность желудка и зачем нам вообще эта информация?
Проявления повышенной кислотности желудка могут быть следующие:
В 1910 году была признана концепция: “Нет кислоты — нет язвы”. В 1984 году, после открытия роли H. pylori, концепция была кардинально изменена: “Нет H. pylori — нет язвы”.
Да, если секреция соляной кислоты повышена во много раз (как при гастрономе — синдроме Золингера—Эллисона), то язвы действительно образуются в желудке и двенадцатиперстной кишке, и даже могут быть в пищеводе и начальном отделе тощей кишки).
Если же образование желудочного сока повышено не так значительно как при синдроме Золингера-Эллисона, то, как правило, одной кислоты для образования язв не достаточно — необходимо наличие инфекции Хеликобактер Пилори и/или приём обезболивающих препаратов, аспирина.
При язве в стандарты входит диагностика и лечения Хеликобактера (около 90% всех язв связанно именно с ним), определение уровня гастрина (только при подозрении на гастриному) и отмена обезболивающих препаратов/аспирина, если пациент их принимал (при невозможности отмены, назначаются препараты для защиты желудка). В стандарты не входит определение уровня кислотности, так как умеренное ее повышение на тактику лечения не повлияет (исключением может быть подозрение на отсутствие или резкое снижение выработки соляной кислоты желудком — здесь определение кислотности может быть полезно и повлияет на тактику лечения).
Обобщим вышесказанное: обычно нам не слишком уж важна информация о том, что кислотность у пациента повышена (за исключением гастриномы, а это большая редкость), так как на тактику лечения это не повлияет:
В клинической практике для диагностики уровня кислотности обычно используется анализ крови «Гастропанель», в редких случаях (обычно в рамках клинических исследований) применяется рН-метрия желудка.
В большинстве случаев уровень секреции кислоты определяется если есть подозрения на снижение уровня ее продукции, причиной которой является атрофия желудка. Это действительно имеет значение для выбора тактики лечения и наблюдения пациента. Поэтому в западных странах анализ крови «Гастропанель» используется повсеместно и проводится врачами общей практики для решения вопроса о необходимости дальнейшей ФГДС и консультации гастроэнтеролога. Решающим является наличие признаков инфекции Хеликобактер Пилори (анализ входит в Гастропанель), признаков атрофии, признаков гастриномы.
Если у человека присутствуют симптомы функциональной диспепсии (боль, жжение, чувство переполнения и тяжести в эпигастрии) и изжоги, то действительно у него возникает субъективное ощущение, что «кислоты вырабатывается слишком много» и отчасти это может быть правдой (но как мы разобрали ранее — возможно дело не только в излишней кислоте или совсем даже не в ней), поэтому диета может иметь положительный эффект. Ни для кого не секрет, что определенная пища стимулирует выработку соляной кислоты сильнее. Поэтому первым делом при вышеописанных симптомах стоит пересмотреть пищевые привычки — питаться регулярно, постараться ограничить в рационе слишком кислые, острые, копченые, жаренные продукты, а также кофе, алкоголь и фаст-фуд. Но помним, что еда должна быть вкусной и питательной — питаться одной куриной грудкой с гречей тоже не выход. Слишком жесткие диеты могут принести больше вреда, чем пользы и усугубить ситуацию.
Если изменение рациона не помогает, то обязательно нужно обратиться к врачу для получения адекватного обследования и лечения.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из 
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности

При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, 
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
СОЛЯНАЯ КИСЛОТА
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Первая помощь и методы лечения
При обнаружении признаков отравления требуется вызвать бригаду скорой помощи. В домашних условиях допускается проводить мероприятия, направленные на улучшение состояния пострадавшего. Первая помощь при отравлении соляной кислотой должна проводиться быстро, чтобы уменьшить риск возникновения негативных последствий.
Лечение проводится в медицинском учреждении под контролем специалистов.
Терапия:
Лечение проводится в реанимации, а затем в стационаре. Длительность зависит от состояния пациента и степени отравления.
Ожоги и отравление
Каким бы эффективным ни было это средство, оно опасно. Соляная кислота, в зависимости от концентрации, может спровоцировать химические ожоги четырех степеней:
Если вещество каким-то образом попало в глаза, надо промыть их водой, а потом содовым раствором. Но в любом случае первым делом надо вызвать скорую.
Попадание кислоты внутрь чревато острыми болями в груди и животе, отеком гортани, рвотными кровавыми массами. Как следствие — тяжелые патологии печени и почек.
А к первым признакам отравления парами относят сухой частый кашель, удушье, повреждение зубов, жжение в слизистых оболочках и боли в животе. Первая неотложная помощь — это умывание и полоскание полости рта водой, а также доступ к свежему воздуху. Настоящую помощь может оказать лишь токсиколог.
Свойства химического спектра
Кислота взаимодействует со многими металлами, солями. Она считается довольно сильной и стоит в одном ряду с серной. Основная реакция проявляется на все группы металлов, находящихся левее от водорода (магний, железо, цинк – электротехнические потенциалы).
Хлороводородный раствор в разбавленном виде вступает в реакцию с солями, но только с теми, которые образованы менее сильными кислотами. Известные всем натрия и кальция карбонат после взаимодействия с ним распадаются на воду и угарный газ.
Азотная кислота
– качественная реакция на солевой раствор. Для ее получения необходимо добавить в этот реактив нитрат серебра, как результат – выпадет осадок белого цвета, с которого получается азотное вещество
С помощью данной смеси воды и водорода проводят множество интересных экспериментов. Например, разбавляют его аммиаком. В итоге, получится белый дым, густой, имеющий консистенцию маленьких кристаллов. Метиламин, анилин, диоксид марганца, калий карбонат – реактивы, также поддающиеся под влияние кислоты.
Как и для чего применяют
Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
Как происходит отравление
Соляная кислота – жидкое вещество без цвета, но с характерным резким запахом. Одна из самых сильных кислот, способна растворять некоторые металлы. Легко превращается в газ.
Хлористый водород используется в текстильной промышленности, кожевенном деле, металлургии драгметаллов, при производстве клея, кислот.
Вещество присутствует в желудке в минимальной концентрации. Кислота способствует нормализации пищеварительного процесса, защищает организм от вредных бактерий и микроорганизмов.
При концентрации, превышающей показатель в 24 %, соляная кислота способна нанести необратимый вред человеческому организму. Пары, образующиеся при контакте с воздухом, вызывают раздражение органов зрительной и дыхательной системы.
Выделяют несколько факторов, способных спровоцировать развитие отравления.
Интоксикация парами возможна при работе в помещениях с плохой вентиляцией,
Употребление внутрь по неосторожности, чаще происходит у детей,
Попадание соляной кислоты на эпидермис, слизистую оболочку при несоблюдении правил использования реагента.
Отравление веществом в домашних условиях у взрослых людей происходит в результате применения без средств защиты кожного покрова, глаз, органов дыхательной системы. Интоксикация способна произойти при неаккуратном переливании кислоты из одной емкости в другую.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН
. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl
. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы
. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН
. Активирует пепсиноген
, переводит его в активный фермент пепсин
. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Другое применение кислоты в быту
Кислотным составом можно легко очистить сантехнику из фаянса от известкового налета и ржавчины, удалить мочевой камень и другие загрязнения. Для большего эффекта к средству добавляют ингибитор (например, уротропин), замедляющий химическую реакцию.
Процедуру проводят следующим образом: кислоту разбавляют водой до достижения 5 %-ной концентрации и добавляют ингибитор из расчета 0,5 г на 1 л жидкости. Полученным составом обрабатывают поверхность и оставляют на 30-40 минут (в зависимости от степени загрязнения), после чего промывают водой.
Слабый кислотный раствор также используется для удаления пятен от ягод, чернил или ржавчины с тканей. Для этого материал замачивают в составе на некоторое время, после чего тщательно ополаскивают и стирают в обычном режиме.
Избавление от накипи в чайнике
Для этой цели используют 3-5 %-ный раствор соляной кислоты, который наливают в чайник и нагревают до 60-80°
С в течение 1-2 часов или до тех пор, пока накипные отложения не распадутся. После этого накипь становится рыхлой и легко удаляется деревянной лопаточкой.
Эффективность метода обусловлена тем, что реагент вступает в реакцию с карбонатами магния и кальция и превращает их в растворимые соли. Выделяющийся при этом углекислый газ разрушает слой накипи и придает ему рыхлость. После удаления солевых отложений посуду тщательно моют чистой водой.
Важный момент!
Этот способ не подходит для удаления накипи в эмалированных или алюминиевых чайниках со сколами и трещинами: это приведет к коррозии металла и его сильному повреждению.
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент — газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это — химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.
Использование на производстве
Она имеет широкое применение в металлургической, пищевой и медицинской промышленности.
Входит в состав синтетических красителей. Используется при производстве чистящих и моющих средств. Но в жидкостях, предназначенных для бытового использования, концентрация серной кислоты незначительна.
Как добывают соляную кислоту в лабораторных условиях
Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl
в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H
. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота
слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. и карбонат натрия
будут образовывать после реакции с HCl
хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца
, перманганатом калия
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Вещество реагирует с аммиаком
, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца
: MnO2+4HCl=Cl2+MnO2+2H2O
(реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра
выпадает белый осадок хлорида серебра
и образуется азотная к-та
. Уравнение реакции взаимодействия метиламина
с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl
.
Вещество реагирует со слабым основанием анилином
. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин
(хлорид фениламмония
): (С6Н5NH3)Cl
. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3
. Уравнение реакции карбоната калия
с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Применение
в металлургии для извлечения руд, удаления ржавчины, окалин, грязи и окислов, паянии и лужении;
при изготовлении синтетических каучуков и смол;
в качестве регулятора кислотности в пищевой промышленности;
для получения хлоридов металлов;
для получения хлора;
в медицине для лечения недостаточной кислотности желудочного сока;
в качестве чистящего и дезинфицирующего средства.
— (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь
Соляная кислота
— – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА
— (Acidum muriaticum, Acid, hydrochloricum), раствор хлористого водорода (НС1) в воде. В природе встречается в воде нек рых источников вулканического происхождения, а также находится в желудочном соке (до 0,5%). Хлористый водород может быть получен … Большая медицинская энциклопедия
СОЛЯНАЯ КИСЛОТА
— (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
СОЛЯНАЯ КИСЛОТА
— (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия
соляная кислота
— сущ., кол во синонимов: 1 кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
СОЛЯНАЯ КИСЛОТА
Современная энциклопедия
Соляная кислота
— СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Иллюстрированный энциклопедический словарь
соляная кислота
— (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
Чем опасно интоксикация
Соляная кислота представляет особую опасность для человеческого организма. При отравлении подобным веществом возможно развитие серьезных осложнений и нарушений функциональности организма.
Подобные последствия развиваются постепенно в зависимости от степени отравления.
Вывод
При соблюдении мер предосторожности и правил безопасности соляная кислота станет незаменимым помощником в быту. А приобрести ее по самым доступным ценам можно в нашей компании
Как кислоты. Программа образования предусматривает запоминание учениками названий и формул шести представителей этой группы. И, просматривая предоставленную учебником таблицу, вы замечаете в списке кислот ту, которая стоит первой и заинтересовала вас в первую очередь, — соляную. Увы, на занятиях в школе ни свойства, ни любая другая информация о ней не изучается. Поэтому жаждущие получить знания вне школьной программы ищут дополнительные сведения во всяческих источниках. Но частенько многие не находят нужную информацию. И поэтому тема сегодняшней статьи посвящается именно данной кислоте.
Соляная кислота является сильной одноосновной кислотой. В некоторых источниках ее могут называть хлоро- и хлористоводородной, а также хлористым водородом.
Все металлы, которые стоят до водорода в электрохимическом ряду их напряжения, могут взаимодействовать с этим соединением, образуя соли и выделяя газообразный водород. Если их заменить оксидами металлов, то продуктами реакции станут растворимая соль и вода. Такой же эффект будет и при взаимодействии соляной кислоты с гидроксидами. Если же к ней добавить любую соль металлов (например, карбонат натрия), остаток которой был взят из более слабой кислоты (угольной), то образуются хлорид этого металла (натрия), вода и газ, соответствующий кислотному остатку (в данном случае — углекислый).
Обсуждаемое сейчас соединение образуется, когда в воде растворяют газообразный хлороводород, который можно получить, сжигая водород в хлоре. Соляная кислота, которую получили при помощи такого способа, носит название синтетической. Также источником для добывания этого вещества могут служить абгазы. И такую соляную кислоту будут называть абгазной. В последнее время уровень производства соляной кислоты с помощью этого метода гораздо выше, чем ее получение синтетическим способом, хотя последний дает соединение в более чистом виде. Это все пути его добывания в промышленности. Однако в лабораториях соляную кислоту получают тремя способами (первые два отличаются только температурой и продуктами реакции) при помощи различных видов взаимодействия химических веществ, таких как:
Гидрометаллургия и гальванопластика не могут обойтись без использования соляной кислоты, где она нужна, чтобы очищать поверхность металлов при лужении и паянии и получать хлориды марганца, железа, цинка и других металлов. В пищевой промышленности это соединение знают как пищевую добавку E507 — там это регулятор кислотности, необходимый для того, чтобы изготовить сельтерскую (содовую) воду. Концентрированная соляная кислота также находится в желудочном соке любого человека и помогает переваривать пищу. Во время данного процесса ее степень насыщенности уменьшается, т.к. этот состав разбавляется едой. Однако при продолжительном голодании концентрация соляной кислоты в желудке понемногу увеличивается. А так как данное соединение очень едкое, это может привести к язве желудка.
Соляная кислота может быть как полезной, так и вредной для человека. Ее попадание на кожу приводит к появлению сильных химических ожогов, а пары данного соединения раздражают дыхательные пути и глаза
Но если обращаться с этим веществом осторожно, оно может не раз пригодиться в