Чем заменить нпвс при язве желудка
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
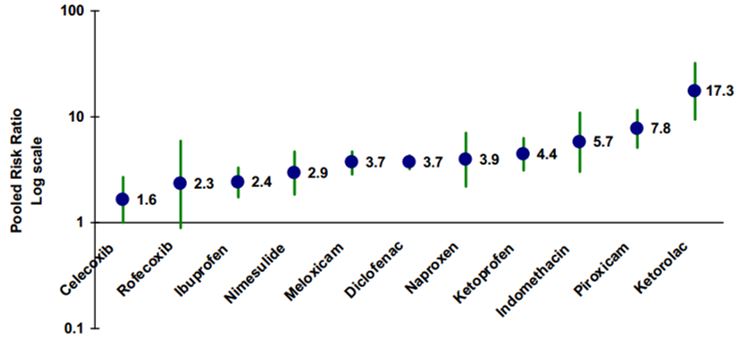
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Профилактика НПВС-гастропатий у больных с факторами риска желудочно-кишечных повреждений
Нестероидные противовоспалительные средства (НПВС) представляют собой одну из наиболее востребованных групп препаратов. По данным Американской ассоциации ревматологов, более 5% населения планеты используют НПВС. Однако частота повреждений верхних отделов
Нестероидные противовоспалительные средства (НПВС) представляют собой одну из наиболее востребованных групп препаратов. По данным Американской ассоциации ревматологов, более 5% населения планеты используют НПВС. Однако частота повреждений верхних отделов желудочно-кишечного тракта (ЖКТ) — эрозивно-язвенные поражения, перфорации, кровотечения — при регулярном применении этих препаратов может достигать 40% [1]. Серьезную проблему представляет применение НПВС у больных с факторами риска повреждения верхних отделов ЖКТ. Обострение язвенной болезни, эрозивный гастродуоденит или рефлюкс-эзофагит, а также указания на них в анамнезе являются противопоказаниями к применению НПВС. Однако выраженность болевого синдрома нередко заставляет проводить противовоспалительную терапию и у таких больных.
К факторам риска относят наличие эрозивно-язвенных поражений желудка и двенадцатиперстной кишки и кровотечений из верхних отделов ЖКТ в анамнезе, возраст старше 65 лет, тяжелый ревматоидный артрит, использование больших доз или одновременный прием разных НПВС, комбинацию НПВС с глюкокортикоидами, сопутствующую антикоагулянтную терапию, женский пол, наличие Нelicobacter pylori, курение [2, 3].
При наличии факторов риска предлагаются различные подходы для определения тактики ведения больных.
При наличии двух и более факторов риска частота осложнений терапии НПВС возрастает, что оправдывает выбор двух профилактических тактик одновременно, например применение селективных ингибиторов ЦОГ-2 и ИПП. Количество больных с патологией верхнего отдела ЖКТ, нуждающихся в терапии НПВС, достаточно велико, что и явилось причиной для проведения настоящего исследования.
Целью работы явилась оценка эффективности, переносимости и безопасности применения препарата найз (нимесулид) в дозировке 100 мг 2 раза в день в течение 4 нед для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ в стадии ремиссии/умеренного обострения на фоне профилактической терапии препаратом омез (омепразол) в дозировке 20 мг 2 раза в сутки.
Задачи исследования сводились к следующему:
Критериями включения в исследование служили:
В исследование не включались пациенты:
Найз (таблетки по 100 мг) назначался в дозе 100 мг 2 раза в день. Продолжительность лечения составляла 28–35 дней — в зависимости от выраженности обострения патологии суставов. В период исследования не допускался прием других НПВС, анальгетиков и глюкокортикостероидов. Одновременно с найзом назначался омез в дозе 20 мг 2 раза в день на весь период приема препарата.
Перед назначением комбинированной терапии диагноз неврологической, ревматологической патологии был верифицирован невропатологом, ревматологом с применением достаточных диагностических процедур. С учетом гастроэнтерологического анамнеза, проводили эзофагогастродуоденоскопию (ЭГДС) до и после курса лечения. До и после окончания терапии проводилось изучение общего и биохимического (билирубин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), гамма-глютаматтранспептидаза (гамма-ГТ), щелочная фосфатаза) анализов крови.
Субъективная оценка эффективности лечения состояла в выборе пациентом одного из следующих показателей: значительное улучшение; улучшение; отсутствие эффекта; ухудшение.
Субъективная оценка переносимости — выбор одного из следующих показателей: хорошая, удовлетворительная, плохая.
Объективная оценка проводилась врачом на основании динамики клинических, лабораторных и инструментальных показателей. Позитивная динамика двух-трех показателей считалась значительным улучшением, одного-двух — улучшением. Неэффективным лечение признавалось при отсутствии динамики показателей. Преобладание отрицательной динамики расценивалось как ухудшение.
Оценка безопасности применения основывалась на сопоставлении результатов: общего и биохимического анализов крови до и после лечения; ЭГДС до и после лечения. Появление эрозивно-язвенных повреждений слизистой или ухудшение исходного состояния слизистой расценивались как побочный эффект, связанный с приемом найза.
Всего в исследовании приняли участие 30 больных (14 мужчин, 16 женщин) в возрасте от 22 до 70 лет (средний возраст составил 53,7 ± 3,0 года). Болевой синдром был вызван остеохондрозом различных отделов позвоночника у 18 из них, остеоартрозом различных суставов — у 10, ревматоидным полиартритом — у 2 пациентов.
Для оценки симптоматики заболеваний суставов и позвоночника использовался ряд показателей, частота и характеристики которых представлены в таблице 1.
Что касается функциональной недостаточности, у 4 пациентов отмечена нулевая степень, у 13 — I степень, у 11 — II степень, у 2 — III степень.
Все пациенты имели отягощенный гастроэнтерологический анамнез.
В связи с необходимостью назначения противовоспалительной терапии всем больным до лечения проводилась ЭГДС.
Cреди пациентов с язвенной болезнью двенадцатиперстной кишки в анамнезе (9 больных) к моменту начала противовоспалительной терапии более 2/3 имели эрозивно-язвенные поражения. У 4 больных с обострением язвенной болезни двенадцатиперстной кишки и 1 больного с обострением язвенной болезни желудка лечение найзом было начато на фоне рубцующихся язвенных дефектов. При эрозивных гастритах и бульбитах, в связи с болями в позвоночнике или суставах, терапию найзом проводили, не дожидаясь заживления эрозий. Кроме того, у 5 больных при эндоскопическом исследовании был обнаружен рефлюкс-эзофагит (у 4 — катаральный, у 1 — эрозивный I степени).
Результаты исследования
Динамика клинических проявлений. Основной причиной назначения противовоспалительной терапии являлся болевой синдром, связанный с патологией позвоночника и суставов. Динамика основной симптоматики под влиянием терапии найзом представлена в таблице 2.
Функциональная недостаточность на фоне проводимой терапии характеризовалась следующим образом: 0 степень отмечалась до лечения у 4 пациентов, после лечения — у 19; I степень — у 13 до лечения и у 9 — после терапии; II степень — у 11 до и у 2 — после, III степень — у 2 до и ни у одного — после лечения.
Таким образом, курсовое лечение найзом приводило к достоверному уменьшению интенсивности болей при движении и пальпации, сокращению длительности утренней скованности и степени функциональной недостаточности.
Динамика лабораторных данных. В рамках оценки безопасности применения лекарственного средства проводилось исследование общего и биохимического анализов крови до и после лечения. Результаты представлены в таблице 3.
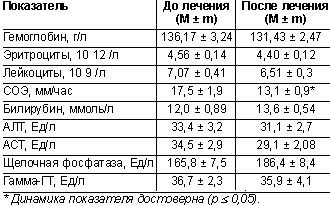 |
| Таблица 3. Результаты изучения лабораторных данных до и после лечения |
Приведенные данные демонстрируют отсутствие динамики лабораторных показателей, что свидетельствует о безопасности применения найза в использованных дозах в течение 28 дней. Достоверное снижение СОЭ отражает уменьшение воспалительной реакции после терапии.
Динамика эндоскопической картины. Из 4 пациентов с язвенной болезнью двенадцатиперстной кишки, принятых в исследование с остаточными язвами, заживление наблюдалось у 3 человек. В одном случае появилась острая язва луковицы двенадцатиперстной кишки и эрозивный эзофагит III степени. У 3 пациентов с язвенной болезнью двенадцатиперстной кишки в анамнезе, исходно имевших эрозивный бульбит и эрозивный гастрит, отмечалось заживление эрозий на фоне лечения. У 1 из 2 больных, к началу исследования имевшего рубцово-язвенную деформацию луковицы двенадцатиперстной кишки и поверхностный гастрит, появился эрозивный эзофагит II степени, состояние слизистой оболочки желудка и двенадцатиперстной кишки не изменилось. Обращает на себя внимание тот факт, что появление эрозивного эзофагита манифестировало появлением изжоги и отмечалось у больных в возрасте 70 лет.
У пациентов с язвенной болезнью желудка в анамнезе наблюдали заживление остаточного язвенного дефекта (1 больной) и эрозивного гастрита (1 больной).
В группе больных с эрозивным антральным гастритом в анамнезе, заживление эрозий наблюдали у 8 из 10 человек, однако у одного из них на фоне заживления эрозий возник эрозивный эзофагит I степени. У оставшихся 2 пациентов ухудшения состояния слизистой оболочки желудка отмечено не было. Ни у одного из 7 больных с эрозивным антральным гастритом в анамнезе, имевших на момент включения в исследование очаговый антральный гастрит, ухудшения состоянии слизистой оболочки не отмечено.
У 2 больных с резекцией 2/3 желудка (по поводу язвенной болезни двенадцатиперстной кишки) повреждений слизистой оболочки верхних отделов ЖКТ после терапии найзом обнаружено не было, более того, у пациентки с исходным эрозивным эзофагитом I степени при контрольном исследовании отмечена эпителизация эрозии пищевода.
Таким образом, отрицательная эндоскопическая динамика при использовании комбинированной терапии наблюдалась у 3 больных (10%) в виде эрозивного эзофагита I–III степени, и в одном случае сочеталась с появлением острых язв луковицы двенадцатиперстной кишки. При этом все эти пациенты отметили появление изжоги.
Оценка эффективности, безопасности и переносимости терапии. Субъективная оценка эффективности состояла в выборе пациентом одного из следующих показателей: значительное улучшение, улучшение, отсутствие эффекта, ухудшение. Субъективная оценка переносимости предполагала выбор больным одного из следующих показателей: хорошая, удовлетворительная, плохая. Значительное улучшение отметили 8 больных, улучшение — 22; хорошая переносимость наблюдалась у 26 пациентов, удовлетворительная — у 4.
Эффективность комбинированной терапии получила высокую оценку: улучшение отметили 73,3% больных, значительное улучшение — 26,7%. Переносимость была охарактеризована пациентами как хорошая в 86,6% и как удовлетворительная в 13,3% случаев. Удовлетворительную оценку лечению дали 3 человека в связи с появлением рефлюкс-эзофагита, которые отметили появление изжоги и тошноты, у одного пациента отмечались сухость во рту и тошнота. Следует отметить, что наблюдаемые побочные эффекты были выражены слабо, возникали на 2–4-й день лечения и не привели к отмене препарата.
Объективная оценка результатов лечения проводилась врачом на основании динамики клинических, лабораторных и инструментальных показателей. Позитивная динамика двух-трех показателей считалась значительным улучшением, одного-двух — улучшением. Неэффективным лечение признавалось при отсутствии динамики показателей. Преобладание отрицательной динамики расценивалось как ухудшение. Значительное улучшение отмечено у 8 больных, улучшение — у 22.
Врачебная оценка эффективности противовоспалительного действия найза совпадала с оценкой эффективности по данным пациентов.
Оценка безопасности применения основывалась на сопоставлении результатов общего и биохимического анализов крови до и после лечения; ЭГДС до и после лечения. Появление эрозивно-язвенных повреждений или ухудшение исходного состояния слизистой оболочки желудка и двенадцатиперстной кишки расценивалось как побочный эффект, связанный с приемом найза.
Динамика общего и биохимического анализов крови у всех пациентов отсутствовала. Исключение составило уменьшение СОЭ после лечения, что свидетельствовало о снижении воспаления.
Появление эрозивных повреждений слизистой оболочки пищевода наблюдали у 3 больных, в одном случае — в сочетании с появлением острой язвы двенадцатиперстной кишки. Таким образом, применение комбинированной терапии для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ было безопасным в 90% случаев.
Основным повреждающим фактором НПВС является снижение локального синтеза простагландинов. Последние клинические и экспериментальные данные указывают на то, что традиционные НПВС замедляют заживление пептических язв, влияя на действие ростовых факторов, снижая пролиферацию эпителиальных клеток и ангиогенез в крае язвы, замедляя созревание грануляционной ткани [10]. Применение селективных ингибиторов ЦОГ-2 также приводит к замедлению заживления желудочных язв, сравнимому с таковым при использовании традиционных НПВС [10]. Появляются сообщения о гастроинтестинальных кровотечениях, об эзофагитах, возникших при использовании селективных ингибиторов ЦОГ-2 [5, 6].
По результатам наших собственных исследований были выявлены три случая появления эрозивного эзофагита I–III степени, и в одном случае он развивался в сочетании с острыми язвами двенадцатиперстной кишки. Причины неэффективности препарата омез у этих больных могут быть следующими: больные резистентны к действию омеза, т. е. являются non-responders; подавление кислотной продукции было адекватным, но сопровождалось нарушениями моторики верхних отделов ЖКТ, как при гастроэзофагеальной рефлюксной болезни, видимо, с рефлюксом желчи в пищевод и развитием эрозивного эзофагита. Вторая причина представляется более вероятной у 2 больных в возрасте 70 лет, первая причина — у пациента 53 лет.
При появлении жалоб на изжогу, тошноту необходимо провести эндоскопическое исследование верхних отделов ЖКТ и суточной рН-метрии на фоне терапии омезом. Сохранение кислотной продукции в этой ситуации должно привести к пересмотру кислотосупрессивной терапии. При адекватном подавлении желудочной секреции будет оправданным добавление к терапии прокинетиков, сукральфата или магалфила в обычных дозах.
В заключение хотелось бы отметить, что лечение найзом в сочетании с омезом у больных с поражением опорно-двигательного аппарата и сопутствующей патологией желудка и двенадцатиперстной кишки в стадии обострения приводило к улучшению основной (в 100% случаев) и сопутствующей (в 90% случаев) патологии ЖКТ. 10% больных имели осложнения (эрозивный эзофагит, острая язва луковицы двенадцатиперстной кишки).
При появлении или усугублении изжоги, боли в эпигастральной области, тошноты больным, принимающим НПВС, показана ЭГДС для решения вопроса о дальнейшей тактике ведения пациента, возможности дальнейшей терапии НПВС. Следует также учитывать, что соответствия между клиническими проявлениями НПВС-гастропатии и эндоскопическими «находками» не существует, поэтому эндоскопический контроль, особенно в ранние сроки лечения (первые 1–2 мес), является обязательным и адекватным методом профилактики тяжелых осложнений.
Использование комбинированной терапии найз + омез для лечения заболеваний суставов и позвоночника (остеоартрита, остеоартроза и остеохондроза) возможно у больных с сопутствующими эрозивно-язвенными поражениями верхних отделов ЖКТ и множественными факторами риска развития гастроинтестинальных побочных эффектов НПВС. При этом НПВС-гастропатия развивается в 3 раза реже, чем при использовании неселективных НПВС.
По вопросам литературы обращайтесь в редакцию.
О. Н. Минушкин, доктор медицинских наук, профессор
Л. В. Масловский, кандидат медицинских наук, доцент
В. М. Леонов
МЦ УД Президента РФ, Москва
Выбор нестероидных противовоспалительных препаратов у больных ревматологического профиля с сопутствующими сердечно-сосудистыми заболеваниями
В статье рассматриваются вопросы выбора нестероидных противовоспалительных препаратов (НПВП), особенности отдельных представителей данного класса препаратов, а также обсуждаются факторы, определяющие индивидуальный ответ пациентов на препараты, такие как
The article deals with the issues of choosing nonsteroidal anti-inflammatory drugs (NSAID), especially some representatives of this class of drugs, and describes the factors that determine an individual patient’s response to drugs such as pharmacogenetic particular, the presence of certain diseases of the liver, which can disrupt the processes of transformation of drugs, which are metabolized in liver.
Современную клиническую практику трудно представить без нестероидных противовоспалительных лекарственных препаратов (НПВП), сочетающих в себе противовоспалительный, анальгезирующий и жаропонижающий эффекты. Этот класс препаратов широко используется при различных ревматологических заболеваниях (РЗ), которые имеют высокую распространенность в Российской Федерации, — ими страдают более 16 млн человек. В структуре РЗ лидирующую позицию занимает остеоартрит (ОА) (более 4 млн человек), далее следуют ревматоидный артрит (РА) (около 280 тысяч больных), остеопороз (более 150 тысяч больных) и спондилопатии (около 90 тысяч больных) [1, 2].
Большая распространенность различных РЗ во всех возрастных группах, в том числе у лиц пожилого и старческого возраста, тенденция к прогрессированию и хронизации течения, ранняя инвалидизация больных, негативное влияние заболеваний на качество жизни пациентов делают РЗ серьезной медико-социальной проблемой, требующей особого внимания со стороны практикующих врачей [3].
Коморбидность в ревматологии
Особенностью течения РЗ в старших возрастных группах является частое наличие различных коморбидных заболеваний и состояний, которые оказывают дополнительное негативное влияние на течение заболевания, на качество жизни, на прогноз и, что не менее важно, зачастую затрудняют проведение эффективной и безопасной фармакотерапии. Последнее напрямую связано с часто встречающейся у этих больных необоснованной полипрагмазией, потенциально опасными межлекарственными взаимодействиями и, как следствие, высоким риском развития нежелательных лекарственных реакций (НЛР).
У больных старшего возраста наиболее частым коморбидным фоном при РЗ, прежде всего при остеоартрите, являются сердечно-сосудистые заболевания (ССЗ), такие как артериальная гипертензия (АГ) и ишемическая болезнь сердца (ИБС), а также ожирение и сахарный диабет 2-го типа (СД 2-го типа) [4]. Так, при ОА ожирение встречается в 2,25 раза чаще, а ИБС в 1,73 раза чаще, чем у больных без ОА [5]. У больных с РА часто встречаются АГ, дислипидемия, переломы костей различной локализации, ИБС и СД 2-го типа [6].
Следует отметить, что и АГ, и дислипидемия, и ожирение, часто встречающиеся у больных с различными РЗ, по сути являются компонентами метаболического синдрома (МС) — совокупности факторов риска ССЗ и СД 2-го типа, имеющих общие патогененетические механизмы, в основе которых лежат инсулинорезистентность и гиперинсулинемия [7]. Клинические проявления МС чрезвычайно многообразны, и к ним относятся, помимо вышеперечисленных, также жировая дистрофия печени, нарушения пуринового обмена, синдром поликистозных яичников, заболевания периферических сосудов, цереброваскулярные заболевания, эректильная дисфункция и хронические заболевания почек [8].
Высокая распространенность МС среди пациентов с РЗ по сравнению с общей популяцией объясняется общностью патогенеза отдельных компонентов МС и РЗ. Так, доказано, что жировая ткань способна вырабатывать огромное количество биологически активных веществ — адипокинов, оказывающих влияние напрямую или через различные нейроэндокринные механизмы на различные процессы в организме человека. В частности, изучение таких адипокинов, как лептин, адипонектин, висфатин и резистин, показало их роль в патогенезе как сердечно-сосудистых (СС), так и ревматологических заболеваний [9].
Общая характеристика НПВП
НПВП — большая гетерогенная группа лекарственных средств (ЛС), обладающих обезболивающими, противовоспалительными и жаропонижающими свойствами.
В настоящее время в клинической практике известно более 20 различных представителей этой группы, имеющих различия по химической структуре, особенностям механизма действия, показаниям к применению и переносимости.
Механизм действия всех НПВП основывается на ингибировании фермента циклооксигеназы (ЦОГ), и тем самым нарушается образование синтеза простагландинов, которые являются важными физиологическими и патологическими медиаторами. Простагландины принимают участие в таких процессах, как боль, воспаление, гипертермия, онкогенез, остеопороз, регуляция работы почек и т. д. Из арахидоновой кислоты с участием ЦОГ образуется простагландин H2, который является предшественником таких простагландинов, как тромбоксан (TxA2), простациклин (PGI2), D2, E2 и F2 (рис. 1).
Известно две основные изоформы ЦОГ — ЦОГ-1 и ЦОГ-2. Выделение в экспериментальных условиях третьей изоформы ЦОГ-3 как варианта ЦОГ-1 остается дискутабельным [12, 13]. Первая изоформа ЦОГ-1 синтезируется постоянно и работает по универсальному механизму, т. е. независимо от того, в каком органе или ткани идет синтез. Синтез второй изоформы ЦОГ-2 стимулируется различными факторами воспаления (липополисахариды, интерлейкины, ФНО-α) в различных клетках организма человека, таких как эндотелий, остеокласты, синовиоциты, моноциты и макрофаги [10].
Основные фармакодинамические свойства НПВП — это противовоспалительный, жаропонижающий и обезболивающие эффекты, обеспечиваются посредством ингибирования ЦОГ-1 и ЦОГ-2 [14, 15]. И именно ингибированием ЦОГ-1 и ЦОГ-2 обусловлены основные нежелательные реакции на фоне применения НПВП. Простагландины PGE2 и PGI2, которые синтезируются с участием ЦОГ-1 в желудочно-кишечном тракте (ЖКТ), являются цитопротекторами слизистой оболочки за счет снижения секреции париетальными клетками желудка соляной кислоты, улучшения кровотока и стимуляции выработки слизи. Кроме того, с участием ЦОГ-1 происходит синтез тромбоксана TxA2 в тромбоцитах, обладающего вазоконстриктивными и проагрегантными свойствами. НПВП, блокируя синтез ЦОГ-1, могут приводить к повреждению слизистой оболочки желудка и кишечника и нарушению агрегации тромбоцитов. Таким образом, НПВП увеличивают риск развития таких серьезных желудочно-кишечных заболеваний, как воспаление, кровотечение и пенетрация желудка или кишечника. Риск развития таких осложнений выше у людей пожилого возраста и не зависит от длительности применения ЛС [16].
НПВП принято разделять на три группы (табл. 1):
Селективность НПВП в отношении изоформ ЦОГ принято оценивать по отношению степени ингибирования ЦОГ-1 к ЦОГ-2 (коэффициент селективности). Селективными ингибиторами ЦОГ-2 являются те НПВП, у которых данный коэффициент более 5, высокоселективными ингибиторами — если данный коэффициент более 50. НПВП, которые имеют высокую селективность в отношении ЦОГ-2, получили название коксибов (от англ. сyclo-oxygenase, сокращенный вариант COX).
В настоящее время на рынке лекарственных средств по статистике продаж самыми популярными из НПВП являются препараты первых двух групп — ибупрофен, кеторолак, диклофенак, нимесулид, мелоксикам, кетопрофен, индометацин [17].
Несмотря на значимость фармакологических эффектов НПВП и их широкое применение в клинической практике, следует помнить о потенциальном риске развития НЛР, в том числе и серьезных, таких как желудочно-кишечные кровотечения, острый инфаркт миокарда, острая почечная недостаточность и др. Чаще всего встречающиеся НЛР при приеме НПВП развиваются со стороны ЖКТ — 10–50%, со стороны сердечно-сосудистой системы (ССС) — до 5%, мочевыделительной системы — до 5% и др. [18].
Кардиоваскулярные осложнения при приеме НПВП
Учитывая высокую распространенность коморбидности сердечно-сосудистых и ревматических заболеваний, особую актуальность имеют вопросы кардиоваскулярной токсичности НПВП, а также безопасности сопутствующей фармакотерапии. Следует вспомнить, что первоначально разработка селективных ингибиторов ЦОГ-2 была направлена на преодоление ограничений применения НПВП из-за риска развития нежелательных реакций со стороны ЖКТ, однако внедрение в клиническую практику коксибов столкнулось с другой проблемой безопасности при длительном применении — увеличением риска сердечно-сосудистых тромботических осложнений, инфаркта миокарда и инсульта [19].
В основе повышения риска тромботических осложнений на фоне селективных ингибиторов ЦОГ-2 лежит нарушение баланса между тромбоксаном и простациклином, регулирующими эндотелиальную функцию и агрегацию тромбоцитов. Селективные коксибы за счет избирательной блокады ЦОГ-2 нарушают баланс между уровнем тромбоксана и простациклина, что является основой для развития тромботических осложнений, однако результаты последующих клинических наблюдений показали, что и на фоне применения неселективных НПВП также повышается риск сердечно-сосудистых осложнений [20, 21].
Возрос интерес к влиянию НПВП на ССС после изъятия с рынка высокоселективного ингибитора ЦОГ-2 рофекоксиба в связи с увеличением риска фатальных СС-событий. Встал вопрос о безопасности других НПВП, как традиционных, так и селективных ингибиторов ЦОГ-2.
Многолетний опыт применения различных НПВП во всем мире показал, что они оказывают неблагоприятное влияние на артериальное давление (АД), повышают риск развития тромботических осложнений и фибрилляции предсердий (ФП).
Современные международные рекомендации, основанные на результатах долгосрочных клинических исследований, ограничивают применение и коксибов, и неселективных НПВП у больных ИБС, инсультом или наличием высокого риска развития ИБС [22, 23].
Адекватный контроль АД один из важнейших факторов, влияющих на прогноз ССЗ. Было доказано, что НПВП способствуют повышению АД и снижают эффективность антигипертензивной терапии [24].
Другой нежелательной реакцией на фоне длительного применения НПВП является нарушение почечной функции, поскольку обе изоформы ЦОГ играют значимую роль в регуляции работы почек. Простагландины регулируют тонус сосудов, поддерживают нормальный кровоток, что является необходимым для поддержания нормальной функции почек. В настоящее время известно, что ингибирование ЦОГ-1 приводит к снижению клубочковой фильтрации, а ингибирование ЦОГ-2 замедляет реабсорбцию натрия у здоровых добровольцев и у людей пожилого возраста. Все это приводит к НПВП-индуцированному электролитному дисбалансу, который встречается почти у четверти больных, в сочетании со снижением уровня сосудорасширяющего простациклина приводит к увеличению АД и, следовательно, увеличивает риск осложнений со стороны ССС. Снижением уровня простациклина, участвующего в регуляции ренин-ангионтензин-альдестероновой системы, объясняется и развитие гиперкалиемии [25, 45].
По данным метаанализа селективные ингибиторы ЦОГ-2 увеличивают риск развития почечной недостаточности и аритмии [26].
Еще один механизм действия НПВП на ССС был продемонстрирован в экспериментальных исследованиях: ингибирование сосудистой ЦОГ-2 НПВП приводило к более низкому содержанию PG М-I (основного метаболита простациклина) в моче и ассоциировалось с повышением риска гипертонии и тромбозов. Именно дисбаланс между TxA2 и простагландинами с антитромботической активностью приводит к увеличению риска тромботических осложнений. К тому же снижение уровня простагландинов, участвующих в активации NO-синтетазы, и как следствие снижение биосинтеза оксида азота также способствуют дестабилизации АД.
Также одним из механизмов повышения АД может быть повышение периферического сопротивления, вследствие НПВП-ассоциированного склерозирования артерий [27].
Влияние НПВП на кальций-активируемые калиевые каналы также может способствовать развитию кардиоваскулярных осложнений [28].
Многочисленные исследования указывают на повышенный риск развития ФП, связанный с применением НПВП [29]. Механизм развития данного феномена до конца не изучен. Отмечено, что риск развития ФП выше у пациентов, принимающих НПВП более одного года [30].
И хотя все вышеописанные механизмы воздействия на ССС характерны для всех НПВП, независимо от ЦОГ-селективности, есть некоторые препараты, которые проявляют большую токсичность, чем другие. По наблюдениям, среди популярных НПВП диклофенак демонстрирует самый высокий риск развития осложнений со стороны ССС [31]. Однако считается, что низкие терапевтические дозы НПВП безопасны для назначения больным, не имеющим в анамнезе серьезных заболеваний почек и ССС. Более того, низкие дозы некоторых НПВП, таких как ибупрофен и напроксен, обладают антитромботической активностью. В свою очередь, высокие дозы НПВП, за исключением напроксена, ассоциируются с риском развития острого инфаркта миокарда.
По имеющимся на сегодняшний день данным наиболее безопасными НПВП являются амтолметин гуацил, напроксен и целекоксиб [32, 33, 46].
Особый интерес среди них представляет неселективный ингибитор ЦОГ — амтолметин гуацил, имеющий сопоставимую с другими НПВП эффективность, при этом не имеющий серьезных побочных эффектов со стороны ССС и ЖКТ [33–36]. На нашем фармацевтическом рынке он представлен препаратом Найзилат. Найзилат обладает всеми характерными для НПВП свойствами: противовоспалительное, жаропонижающее, обезболивающее, а также хорошим профилем безопасности, принципиально отличающим его от других НПВП. Главное отличие состоит в том, что препарат обладает защитным действием на слизистую ЖКТ, и реализуется оно за счет стимуляции рецепторов капсакаина и последующего высвобождения оксида азота.
По данным ряда клинических исследований и проведенного на их основе метаанализа амтолметин гуацила не уступает другим НПВП (диклофенак, пироксикам, напроксен, индометацин, ибупрофен и др.), однако по эффективности превосходит их по параметрам безопасности и профилю переносимости. Так, при приеме амтолметин гуацила ниже частота развития НЛР, особенно со стороны ЖКТ (подтверждено при эндоскопических исследованиях) [37], нет значимого влияния на уровень АД [38]. Чрезвычайно важным представляется и тот факт, что, в отличие от селективных ЦОГ-2 НПВП, которые не влияют на агрегацию тромбоцитов [39], амтолметин гуацила обладает сравнимой с действием АСК антитромбоцитарной активностью [40]. Благодаря наличию этого фармакологического эффекта препарат может являться препаратом выбора для пациентов.
Наличие антитромбоцитарной активности и уникальный механизм защиты желудка, а также хорошая переносимость при длительных курсах терапии позволяют рассматривать амтолметин гуацила в качестве препарата выбора из группы НПВП у больных ревматологического профиля с сопутствующими сердечно-сосудистыми заболеваниями, с наличием факторов сердечно-сосудистого риска и другой соматической патологией (в частности, желудочно-кишечного тракта).
Фармакогенетические аспекты выбора НПВП
Главным принципом рациональной фармакотерапии является максимальная ее эффективность в сочетании с безопасностью. Эти параметры зависят от множества факторов, среди которых большое значение имеет функциональное состояние печени. Особенно важно это в отношении тех ЛС, которые метаболизируются в печени с участием целого ряда различных ферментов биотрансформации. Большое количество ЛС метаболизируются через систему цитохрома Р450, в том числе и НПВП. Генетические особенности пациентов также имеют важное значение в первую очередь для лекарственных препаратов, метаболизм которых происходит с участием изоферментов цитохрома Р450, различными аллельными вариантами которых и объясняется разнообразие фармакологических ответов у разных пациентов [41]. Знание генетических особенностей организма позволит практикующему врачу индивидуализировать фармакотерапию и персонализированно подходить к выбору ЛС и режима дозирования у каждого конкретного пациента, обеспечивая максимально эффективную и безопасную фармакотерапию. Такой подход позволит снизить частоту развития НЛР на лекарства, что напрямую связано с показателями приверженности пациентов к лечению. Для разных групп ЛС существуют свои гены-кандидаты, полиморфизмы в которых определяют фармакологический ответ и, следовательно, эффективность и безопасность фармакотерапии. Гены-кандидаты могут определять фармакокинетику (ферменты биотрансформации, транспортеры) и фармакодинамику (рецепторы, ферменты, ионные каналы, липопротеины, белки клеточного цикла, сигнальные белки, факторы свертывания) ЛС [41].
Для оценки эффективности и безопасности НПВП наиболее клинически значимо изучение гена-кандидата CYP2C9 [42].
Большинство НПВП являются субстратами CYP2C9, т. е. они метаболизируются с участием данного изофермента, и многие препараты, влияющие на активность CYP2C9 (индукторы или ингибиторы), могут менять фармакологический ответ на НПВП (рис. 2).
Имеет значение также полиморфизм гена CYP2C9. Так, у пациентов с аллельными вариантами CYP2C9*2 и CYP2C9*3 отмечаются более высокие значения максимальной концентрации НПВП в крови и увеличение периода полувыведения по сравнению с носителями CYP2C9*1/1 и, как следствие, выше риск развития НЛР [43] (рис. 3).
Наличие поражений печени различной этиологии, в том числе имеющих место у больных с МС, также может нарушать процессы трансформации лекарственных препаратов, метаболизм которых происходит в печени, изменять активность изоферментов цитохрома Р450 и, как следствие, изменять фармакологический ответ на НПВП [44], т. е. у больных с МС выше риск развития НЛР или низкой эффективности терапии.
Межлекарственные взаимодействия НПВП
Еще один важный аспект фармакотерапии — это анализ межлекарственных взаимодействий НПВП с другими классами ЛС, также широко используемых у больных с сердечно-сосудистыми заболеваниями. Из антигипертензивных препаратов НПВП взаимодействуют практически со всеми, кроме антагонистов кальция (табл. 2).
Гиполипидемические препараты (ингибиторы ГМГ-КоА редуктазы или статины, секвестранты желчных кислот, эзетимиб, фибраты, никотиновая кислота, омега-3 полиненасыщенные жирные кислоты) не взаимодействуют с НПВП.
Из препаратов, используемых для лечения ишемической болезни сердца, клиническую значимость могут иметь межлекарственные взаимодействия с антитромботическими препаратами (клопидогрелом, АСК) (табл. 3).
При ФП и других видах аритмий могут быть назначены антиаритмики различных классов, а также антикоагулянты, такие как варфарин и новые оральные антикоагулянты (НОАК). Потенциально возможные результаты взаимодействия НПВП с данными ЛС представлены в табл. 4.
Сахарный диабет 2-го типа — одно из самых серьезных проявлений метаболического синдрома, требующих обязательной и постоянной фармакотерапии. Из всех сахароснижающих препаратов неблагоприятные лекарственные взаимодействия возможны только с производными сульфонилмочевины (усиление гипогликемического эффекта) (табл. 5).
Заключение
Таким образом, широкое распространение в клинической практике коморбидных состояний и заболеваний, среди которых большую распространенность имеют ревматические заболевания и метаболический синдром, определяют необходимость выбора оптимальной фармакотерапии. В вопросах рационального выбора НПВП у ревматологических больных с коморбидными заболеваниями остается еще много нерешенных вопросов.
Наличие антитромбоцитарной активности и уникальный механизм защиты желудка, а также хорошая переносимость при длительных курсах терапии позволяют рассматривать амтолметин гуацила в качестве препарата выбора из группы НПВП у больных ревматологического профиля с сопутствующими сердечно-сосудистыми заболеваниями, с наличием факторов сердечно-сосудистого риска и другой соматической патологией (в частности, желудочно-кишечного тракта).
Перспективным также представляется поиск новых подходов к прогнозированию и профилактике возможных НЛР при применении различных НПВП в зависимости от функциональных показателей печеночного метаболизма.
Литература
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва



.gif)
.gif)
.gif)
_575.gif)
.gif)
.gif)