Форсига или джардинс в чем разница
Форсига или джардинс в чем разница
Ингибиторы натрий-глюкозного контранспортера (SGLT2) – сахароснижающие препараты, существенно снижающие риск сердечно-сосудистых осложнений, особенно у пациентов с сердечной недостаточностью. Как следствие, число принимающих данные препараты пациентов будет расти, что делает актуальной информацию о безопасности терапии в рамках реальной клинической практики. Рандомизированные исследования показали, что одним из серьезных, но относительно нечастых побочных эффектов препаратов обсуждаемой группы является развитие диабетического кетоацидоза. Как часто он развивается у пациентов вне рафинированных условий РКИ – вопрос, которому было посвящено крупное когортное исследование Douros и соавторов.
Применение инсулина (в том числе, в анамнезе) пациентами основной группы увеличивало риск развития кетоацидоза (3,52 против 1,43 случаев на 1000 человеко-лет). Напомним, что препараты группы ингибиторов SGLT2 не рекомендованы для лечения сахарного диабета 1 типа, а у многих пациентов с диабетом 2 типа при длительном течении развивается дефицит инсулина, что приближает их к пациентам с диабетом 1 типа. Вероятно, у таких пациентов следует назначать ингибиторы SGLT2 с осторожностью. Кроме того, риск кетоацидоза увеличивается при пропусках приема пищи (в том числе, в стационаре в связи с инвазивными вмешательствами). Вероятно, оптимальной стратегией является временная замена ингибиторов SGLT2 на период времени, когда пациент не принимает пищу в обычном режиме.
Douros A, Lix LM, Fralick M, et al. Sodium-Glucose Cotransporter-2 Inhibitors and the Risk for Diabetic Ketoacidosis: A Multicenter Cohort Study [published online ahead of print, 2020 Jul 28]. Ann Intern Med. 2020;10.7326/M20-0289. doi:10.7326/M20-0289
Форсига
Инструкция по применению
Фармакологические свойства
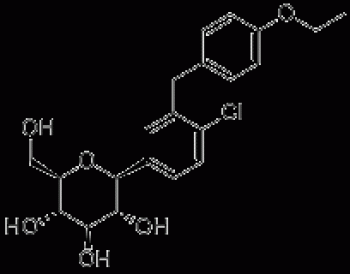
Форсига представляет собой гипогликемическое средство. Вещество относится к мощным замедлителям натрий-глюкозного котранспортера 2-го вида, обратимым селективным. Продукт приостанавливает почечный перевод глюкозы. После введения лекарства происходит необходимое понижение количества глюкозы утром до первого приема пищи и после ее употребления. Полученный результат сохраняется на протяжении суток. Основное вещество не отражается на продуктах глюкозы эндогенного типа и не вызывает реакцию в виде ответа на гипогликемию. Качества дапаглифлозина не зависят от выделения инсулинового материала и сенситивности к нему.
По некоторым данным, полученным в ходе экспериментов, препарат положительно влияет на работу β-клеточных организаций. При удалении глюкозы происходит понижение числа калорий, что соответственно приводит к уменьшению веса тела. Во время использования препарата увеличивается количество выводимой глюкозы почечной организацией.
Известно, что Форсига вызывает диурез осмотического типа и повышает концентрацию урины. Такое состояние способно спровоцировать выведение элемента натрия почечной структурой. Однако, в кровяной субстанции никаких изменений этого показателя не отмечается. Исследования показали, что возможно понижение параметров систолического и диастолического кровяного давления.
Состав и форма выпуска
Изделие продается в форме таблеток желтоватого оттенка. Основной химкомпонент средства – дапаглифлозин. В структуру медикамента входят дополнительные продукты в виде специальной целлюлозы, кремния диоксида, лактозы безводной и других материалов, повышающих действенность препарата.
Показания к применению
Таблетки выписывают при диагностированном 2-м типе сахарного диабета. Их можно принимать в комплексе с диетой и физкультурой. В некоторых случаях вещество совмещают с метформином, инсулиновым соединением, тиазолидиндионами и иными фармизделиями. Назначение вправе проводить высококвалифицированный медспециалист. Самолечение способно привести к тяжелым осложнениям и даже вызвать летальный исход.
Международная классификация болезней (МКБ-10)
E11 Инсулиннезависимый сахарный диабет (сахарный диабет 2 типа).
Побочные эффекты
После введения препарата Форсига возможно распротранение акцидентных реакций в виде инфицирования мочевыводящих проходов, накожных высыпаний, кружения головы, тошноты, гипогликемии. Также отмечается запор, дизурия, баланит, никтурия, дислипидемия, болезненный синдром в спине, кандидоз генитального типа, вагинит бактериального типа, гиповолемия, повышение кровяного давления, обезвоживание, поллакиурия, диурез, грибковое заражение репродуктивной системы, аллергические реакции. При возникновении подобных или других симптомов необходимо прекратить прием препарата и обратиться к доктору. Он изменит схему лечения и выпишет подходящие медикаменты.
Противопоказания
Запрещено вводить средство Форсига при наличии таких патологий, как сахарный диабет 1 типа, недостаточной деятельности почечных структур, проявляющейся в средней или тяжелой форме, генетическое непринятие лактозы, нехватка лактазы, кетоацидоз диабетического вида. Не желательно проводить терапию во время беременности, лактообразования, несовершеннолетним лицам. Опасно принимать таблетки вместе с так называемыми «петлевыми» диуретиками или незначительным ОЦК. Запрет касается людей, которым исполнилось 75 лет и больше, пациентов с повышенной сенсетивностью к некоторым компонентам материала. С особой внимательностью выписывают продукт Форсига при недостаточном функционировании печени, заражении мочевыделительного аппарата, недостаточной работе сердца, которая протекает в затяжной форме, сильном увеличении параметра гематокрита.
Использование при беременности
Как воздействует вещество дапаглифлозина на организм плода во время его вынашивания женщиной, неизвестно. Исследования в этой области не проводились. Поэтому назначать изделие в таком состоянии не желательно. При обнаружении беременности следует немедленно прекратить прием средства. Медспециалисты не проводили эксперименты, связанные с проникновением лекарства в грудное молоко. Таким образом, таблетки не выписывают во время грудного вскармливания.
Способ и особенности использования
Препарат Форсига вводят в середину. Время приема еды не имеет значения. Если средство назначается как основной медикамент, то дозировка должна составлять 10 мг 1 раз в 24 часа. В случае комбинирования нескольких лекарств норма не может превышать 10 мг 1 раз в 24 часа вместе с метформином, некоторыми ингибиторами, инсулином. После медицинского обследования врач определит количество вещества. Чтобы предотвратить развитие гипогликемии рекомендуется уменьшить объемы инсулина или продуктов, увеличивающих его выделение, если они вводятся вместе с продуктом. При лечении с метформином применяют 10 мг соединение дапаглифлозин 1 раз в 24 часа, и 500 мг метформина 1 раз в 24 часа. В некоторых случаях дозировку последнего увеличивают. При обнаружении деструкции печеночного органа, проявляющихся в легкой и средней степени, количество медикамента целесообразно корректировать в зависимости от индивидуальной чувствительности организма, тяжести заболевания и медицинских показаний. Иногда норма изделия не должна превышать 5 мг. Форсига влияет на работоспособность почечной структуры. Если патология протекает в легкой или средней форме, то эффективность лекарства значительно понижается. Тяжелая степень ведет к полному аннулированию действия вещества. Поэтому средство не желательно назначать при наличии сложных патологий почек, недостаточной работе органа на терминальной стадии. Если больному еще не исполнилось 75 лет, то вещество возможно принимать без корректировки дозировки.
Взаимодействие с другими лекарствами
Перед началом терапии больной должен сообщить доктору о фармизделиях, которые он принимает. Ведь вещество, входящую в Форсигу может вступать в реакцию с некоторыми медикаментами. Она повышает риск развития обезвоживания и понижения показателей кровяного давления, если используется вместе с «петлевыми» и тиазидными диуретиками. В случае введения изделия вместе с инсулином проявляется гипогликемия. Доктор уменьшает дозировку последних. Химкомпоненты в виде валсартана, метформина, ситаглиптина, буметанида не способны воздействовать на фармакологическую кинетику соединения дапаглифлозина. Если принимать продукт вместе с рифампицином, происходит понижение экспозиции системной на 22 %. В таком случае не советуют изменять норму лекарства. Таблетки не воздействует на фармакологическую кинетику глимепирида, пиоглитаноза, буметанида, варфарина. Как реагирует организм на никотин, диету и фитопродукты, неизвестно. Адекватные исследования в данной области не проводились.
Передозировка
Лекарство в виде препарата Форсига очень хорошо переносится здоровым организмом при однократном приеме в количестве 500 мг продукта. При этом в урине находится глюкоза. Обезвоживание не возникает, как и понижение показателей кровяного давления. Если проявлялась гипогликемия, то она было достаточно похожа на реакцию систем при употреблении плацебо. Если пациент принял количество таблеток, превышающих установленную норму, то ему надо как можно быстрее обратиться в больницу. Медперсонал проведет соответствующие поддерживающие мероприятия. Специального противоядия не существует. Устранение лишнего вещества из организма с помощью процедуры гемодиализа не проводилось. При необходимости врач изменит схему лечения и проведет повторное обследование.
Аналоги
Известны средства, которые в своем составе содержат практически такие же компоненты, как и те, что включены в Форсигу. К ним относят – Комбоглиз Пролонг, Баету, Онглиз. Выписывать эти материалы может только высококвалифицированный врач. Самостоятельная замена приводит к развитию аллергических реакций, осложнениям заболевания и возникновению новых патологий.
Условия продажи
Препарат продается только при наличии рецепта, выписанного доктором.
Условия хранения
Инструкция содержит описание условий содержания медикамента. Температурный. режим, при котором разрешается хранить лекарство Форсига, не может превышать 30°С. Место должно быть защищенным от прямого попадания солнечных лучей, несовершеннолетних лиц, повышенной влажности. Срок годности – не больше 3 лет с момента выпуска. При обнаружении на упаковке повреждений или дефектов средство необходимо немедленно утилизировать.
Ведущие эндокринологи обсудили место нового препарата Форсига™ в лечении сахарного диабета 2 типа
В рамках Форума была представлена научная программа с участием ведущих специалистов по проблемам СД 2 типа. Проф. М.В. Шестакова рассказала об истории создания нового класса сахароснижающих препаратов – ингибиторов натрий-глюкозных ко-транспортеров 2 типа (SGLT2). Проф. А.С. Аметов представил данные о роли почек в регуляции гомеостаза глюкозы и их вкладе в поддержании высокого уровня гликемии у пациентов с СД 2 типа. Проф. А.М. Мкртумян осветил результаты международных клинических исследований препарата Форсига™.
После пленарной части все участники Форума были приглашены на постерную сессию. Д.м.н., проф. Г.Р. Галстян, д.м.н., проф. Ю.Ш. Халимов, к.м.н. О.Ю. Сухарева, к.м.н. Е.Н. Остроухова и к.м.н. О.Ф. Малыгина представили данные клинических исследований по онкологической и сердечно-сосудистой безопасности препарата Форсига™, частоте возникновения урогенитальных инфекций, а также влиянию дапаглифлозина на качество жизни и динамику массы тела у пациентов с СД 2 типа.
В ходе интерактивной дискуссии участники смогли задать экспертам различные вопросы, касающиеся первого зарегистрированного в России ингибитора SGLT 2 и его места в современных подходах к управлению этим заболеванием.
Очень серьезной проблемой являются сложности, с которыми сталкиваются врачи и пациенты во всем мире при лечении СД 2 типа. К сожалению, СД 2 типа характеризуется прогрессирующим течением заболевания, что связано в первую очередь с нарастанием дисфункции β-клеток, и, как следствие, необходимостью интенсификации терапии в связи с невозможностью удержать гликемический контроль. Другой проблемой современной фармакотерапии являются такие нежелательные явления, наблюдаемые на фоне применения целого ряда сахароснижающих препаратов, как гипогликемия и увеличение массы тела, которые значительно ухудшают качество жизни пациентов, влияют на их приверженность к лечению и уменьшают значимость результатов снижения уровня гликемии.
Форсига™- это первый препарат из нового класса ингибиторов натрий-глюкозных ко-транспортеров 2 типа, зарегистрированный в России в августе 2014 года.1 Препарат обладает уникальным механизмом действия, не зависящим от функции β-клеток и инсулина. У пациентов с СД 2 типа серьезный вклад в поддержание гипергликемии вносит повышенная реабсорбция глюкозы в почках. Препарат Форсига™ блокирует реабсорбцию глюкозы в почках, способствуя выведению в среднем 70 грамм глюкозы в сутки, что позволяет снизить уровень глюкозы крови у пациентов с СД 2 типа.1 Дополнительными преимуществами применения препарата Форсига™ являются низкий риск развития гипогликемии и снижение массы тела. В клинических исследованиях лечение препаратом Форсига™ не только приводило к снижению массы тела за счет потери, в первую очередь, жировой ткани, но и позволяло сохранить пациентам достигнутый результат на протяжении 4 лет.4
Препарат Форсига™ показан пациентам с СД 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
Препарат принимается независимо от приема пищи, 1 раз в день, и что важно, не требует подбора дозы.1
Препарат Форсига™ разрешен к применению и в Европе и в США, где успешно применяется уже на протяжении 1,5 лет.5,6 В ближайшее время препарат Форсига™ станет доступен и для российских врачей и пациентов, чтобы помочь им в нелегкой борьбе с СД 2.
О сахарном диабете 2 типа
СД 2 типа является серьезной медицинской, социальной и экономической проблемой. Рост распространенности СД 2 типа в настоящее время носит характер всемирной эпидемии, охватившей не только государства с высоким уровнем жизни, но и развивающиеся страны.
По данным Всемирной Диабетической Федерации (IDF) 382 миллиона человек страдают СД, 85-90% из них – это пациенты с СД 2 типа. Учитывая темпы распространения этого заболевания, эксперты Всемирной Диабетической Федерации прогнозируют, что количество больных СД к 2035 увеличится в 1,5 раза и достигнет 592 миллионов человек!
СД 2 типа связан со значительным риском развития ишемической болезни сердца (ИБС), инсульта, артериальной гипертензии, хронической болезни почек, ампутаций нижних конечностей, слепоты.2 У пациентов с диагнозом СД 2 типа, установленным в возрасте 40 лет, ожидаемая продолжительность жизни уменьшается в среднем на 14 лет, при этом более чем в 50% случаев причиной смерти у больных СД 2 типа являются именно сердечно-сосудистые заболевания.
О компании «АстраЗенека»
«АстраЗенека» является международной инновационной биофармацевтической компанией, нацеленной на исследование, развитие и коммерческое использование рецептурных препаратов в таких терапевтических областях, как кардиология, онкология, респираторные заболевания и воспалительные процессы, инфекции и психиатрия. Компания представлена более чем в 100 странах мира, а её инновационными препаратами пользуются миллионы пациентов.
Джардинс : инструкция по применению
Состав
В 1 таблетке, покрытой пленочной оболочкой, содержится:
активное вещество: эмпаглифлозин 10 мг или 25 мг;
ядро таблетки: лактозы моногидрат, целлюлоза микрокристаллическая, гидроксипропилцеллюлоза, натрия кроскармеллоза, кремния диоксид коллоидный безводный, магния стеарат;
пленочная оболочка таблетки: Опадрай® желтый 02В38190 (гипромеллоза, титана диоксид (Е171), тальк, макрогол 400, оксид железа желтый (Е172)).
Описание
Бледно-желтые, круглые, двояковыпуклые, со скошенными краями таблетки, покрытые пленочной оболочкой. На одной стороне таблетки гравировка символа компании «Берингер Ингельхайм», на другой – «S10».
Бледно-желтые, овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой. На одной стороне таблетки гравировка символа компании «Берингер Ингельхайм», на другой – «S25».
Фармакотерапевтическая группа
Лекарственные средства для лечения сахарного диабета. Препараты, снижающие уровень сахара в крови, исключая инсулины. Ингибиторы натрийзависимого транспортера глюкозы 2 типа. Код ATX: А10ВК03.
Фармакологические свойства
Эмпаглифлозин является обратимым, сильнодействующим (половина максимальной ингибиторной концентрации (IC50) 1,3 нмоль) и селективным конкурентным ингибитором натрийзависимого транспортера глюкозы 2 типа (SGLT2). Эмпаглифлозин не ингибирует другие важные переносчики глюкозы, обеспечивающие транспорт глюкозы в периферические ткани, и является в 5000 раз более селективным по отношению к SGLT2 по сравнению с SGLT1, основным переносчиком, обеспечивающим абсорбцию глюкозы из кишечника. SGLT2 экспрессируется преимущественно в почках, тогда как экспрессия в других тканях отсутствует или является незначительной. SGLT2 отвечает, как основной транспортер, за реабсорбцию глюкозы из почечных клубочков обратно в кровоток. У пациентов с сахарным диабетом 2 типа и гипергликемией фильтруется и реабсорбируется более высокое количество глюкозы.
Эмпаглифлозин улучшает гликемический контроль у пациентов с сахарным диабетом 2 типа за счет уменьшения почечной реабсорбции глюкозы. Количество глюкозы, выводимой почками с помощью этого механизма, зависит от концентрации глюкозы в крови и скорости клубочковой фильтрации (СКФ). Ингибирование SGLT2 у пациентов с сахарным диабетом 2 типа и гипергликемией приводит к выведению избытка глюкозы с мочой. Кроме того, начало терапии эмпаглифлозином повышает выведение натрия, что приводит к осмотическому диурезу и снижению внутрисосудистого объема.
У пациентов с сахарным диабетом 2 типа выведение глюкозы почками увеличилось сразу же после применения первой дозы эмпаглифлозина и продолжалось на протяжении 24 часов между приемом доз. Увеличение выведения глюкозы почками сохранялось до конца 4 недельного периода лечения, составляя в среднем примерно 78 г/день. У пациентов с сахарным диабетом 2 типа увеличение выведения глюкозы почками приводило к немедленному снижению концентрации глюкозы в плазме крови.
Эмпаглифлозин уменьшает как тощаковую, так и постпрандиальную гипергликемию. Механизм действия эмпаглифлозина не зависит от функции бета- клеток и пути выведения инсулина, что способствует низкому риску возможного развития гипогликемии. Было отмечено положительное влияние эмпаглифлозина на суррогатные маркеры функции бета-клеток, включая индекс НОМА-β (модель для оценки гомеостаза-β). Кроме того, выведение глюкозы почками вызывает потерю калорий, что приводит к уменьшению объема жировой ткани и снижению массы тела. Глюкозурия, наблюдаемая при приеме эмпаглифлозина, сопровождается увеличением диуреза, который может способствовать устойчивому и умеренному снижению артериального давления. Глюкозурия, натрийурез и осмотический диурез на фоне приема эмпаглифлозина могут улучшать сердечно-сосудистые исходы.
Клиническая эффективность и безопасность
Целью терапии сахарного диабета 2 типа является как улучшение гликемического контроля, так и снижение уровня смертности от сердечно-сосудистых заболеваний.
Гипогликемическая эффективность и сердечно-сосудистые исходы оценивались у 14663 пациентов с сахарным диабетом 2 типа, включенных в 12 двойных слепых плацебо- и активно-контролируемых клинических исследований, в которых 9295 пациентов получали эмпаглифлозин (эмпаглифлозин 10 мг: 4165 пациентов; эмпаглифлозин 25 мг: 5130 пациентов). В пяти исследованиях продолжительность лечения составила 24 недели; продолжительность приема эмпаглифлозина пациентами в расширениях данных исследований и в других исследованиях составила до 102 недель.
Лечение эмпаглифлозином в качестве монотерапии и в комбинации с метформином, пиоглитазоном, производным сульфонилмочевины, ингибиторами дипептидилпептидазы-4 (ДПП-4) и инсулином приводит к клинически значимому снижению гликозилированного гемоглобина НbА1с и уменьшению концентрации глюкозы плазмы натощак, массы тела и систолического и диастолического артериального давления. Прием эмпаглифлозина 25 мг приводил к более высокой доле пациентов, достигших целевого НbА1с (менее 7%), и уменьшению количества пациентов, нуждающихся в экстренной помощи, по сравнению с эмпаглифлозином 10 мг и плацебо. Большее снижение уровня НbА1с наблюдалось при более высоком исходном уровне НbА1с. Кроме того, прием эмпаглифлозина дополнительно к стандартному лечению снижал уровень смертности от сердечно-сосудистых заболеваний у пациентов с сахарным диабетом 2 типа и установленным сердечно-сосудистым заболеванием.
На 12 неделе скорректированное среднее (стандартная погрешность) улучшение значения НbА1с по сравнению с исходным составляло 0,11% (0,02) в группе плацебо, 0,65% (0,02) и 0,71% (0,02) в группах эмпаглифлозина 10 и 25 мг. После первых 12 недель гликемический контроль был оптимизирован независимо от исследуемого режима лечения. Таким образом, эффект уменьшался на 94 неделе со скорректированным средним (стандартная погрешность) улучшением значения НbА1с 0,08% (0,02) в группе плацебо, 0,50% (0,02) и 0,55% (0,02) в группах эмпаглифлозина 10 и 25 мг.
Эмпаглифлозин превосходил плацебо в профилактике первичной комбинированной конечной точки – смертности от сердечно-сосудистого заболевания, нефатального инфаркта миокарда или нефатального инсульта. Эффект терапии был связан с достоверным снижением смертности от сердечнососудистого заболевания без существенных изменений по нефатальному инфаркту миокарда или нефатальному инсульту. Снижение смертности от сердечно-сосудистого заболевания было сопоставимо при применении эмпаглифлозина 10 мг и 25 мг и подтверждено повышением общей выживаемости.
Эффективность для профилактики смертности от сердечно-сосудистого заболевания не была достоверно установлена у пациентов, принимавших эмпаглифлозин совместно с ингибиторами ДПП-4, или у пациентов негроидной расы в связи с тем, что данные группы были представлены в исследовании ЕМРА-REG OUTCOME недостаточно.
Сердечная недостаточность, требующая госпитализации
В исследовании EMPA-REG OUTCOME эмпаглифлозин снижал риск сердечной недостаточности, требующей госпитализации, по сравнению с плацебо (эмпаглифлозин 2,7%; плацебо 4,1%; ОР (отношение рисков) 0,65, 95% ДИ 0,50, 0,85).
В исследовании EMPA-REG OUTCOME за время до первого эпизода нефропатии ОР составило 0,61 (95% ДИ 0,53, 0,70) для эмпаглифлозина (12,7%) по сравнению с плацебо (18,8%).
Кроме того, при приеме эмпаглифлозина чаще наблюдалось (ОР 1,82, 95% ДИ 1,40, 2,37) развитие устойчивой норма- или микро-альбуминурии (49,7%) у пациентов с первоначальной макро-альбуминурией по сравнению с плацебо (28,8%).
Уровень глюкозы плазмы натощак
Уровень глюкозы через 2 часа после приема пищи
Пациенты с высоким исходным уровнем НbА1с >10%
При проведении объединенного анализа 3 исследований III фазы с предварительно заданными параметрами выявлено, что при лечении эмпаглифлозином 25 мг открытым методом пациентов с тяжелой гипергликемией (N=184, средний исходный уровень НbА1с 11,15%) наблюдалось клинически значимое снижение уровня НbА1с от исходных значений на 3,27% на 24 неделе; в данный анализ не включались плацебо и эмпаглифлозин 10 мг.
Эффективность и безопасность эмпаглифлозина оценивались в двойном слепом плацебо контролируемом исследовании продолжительностью 12 недель у пациентов с сахарным диабетом 2 типа и высоким артериальным давлением при применении различных антидиабетических препаратов и до 2 антигипертензивных средств. Лечение эмпаглифлозином один раз в сутки привело к статистически значимому улучшению уровня НbА1с и среднего систолического и диастолического артериального давления в течение 24 часов, как определялось при амбулаторном мониторинге артериального давления. Лечение эмпаглифлозином обеспечивало уменьшение систолического и диастолического артериального давления в положении сидя.
Фармакокинетика эмпаглифлозина была всесторонне изучена у здоровых добровольцев и у пациентов с сахарным диабетом 2 типа. После перорального применения эмпаглифлозин быстро всасывался, максимальная концентрация эмпаглифлозина в плазме крови достигалась при медианном tmax 1,5 часа после приема дозы. Затем концентрация эмпаглифлозина в плазме снижалась в две фазы, с фазой быстрого распределения и относительно медленной терминальной фазой. В период равновесной концентрации AUC и Сmax в плазме составляли 1870 нмоль·ч/л и 259 нмоль/л соответственно для эмпаглифлозина 10 мг и 4740 нмоль·ч/л и 687 нмоль/л соответственно для эмпаглифлозина 25 мг при приеме один раз в сутки. Системная экспозиция эмпаглифлозина повышалась в пропорциональной зависимости от дозы. Фармакокинетические параметры при однократном приеме и в равновесном состоянии были сходны, что позволяет предположить линейность фармакокинетики эмпаглифлозина относительно времени. Фармакокинетика эмпаглифлозина у здоровых добровольцев и у пациентов с сахарным диабетом 2 типа была в целом аналогичной.
Прием эмпаглифлозина 25 мг после приема высококалорийной пищи с высоким содержанием жира привел к незначительному снижению экспозиции; по сравнению с приемом натощак AUC сократилась примерно на 16%, а Сmax – примерно на 37%. Наблюдаемый эффект влияния пищи на фармакокинетику эмпаглифлозина не считается клинически значимым, эмпаглифлозин может назначаться независимо от приема пищи.
Кажущийся объем распределения в период равновесной концентрации в плазме крови составлял примерно 73,8 л, что основывается на популяционном анализе фармакокинетики. После перорального применения здоровыми добровольцами меченого эмпаглифлозина [ 14 С] распределение среди эритроцитов составляло примерно 37%, а связывание с белками плазмы составляло 86%.
В плазме человека не обнаружено основных метаболитов эмпаглифлозина, а наиболее распространенными метаболитами являются три конъюгата с глюкуроновой кислотой (2-, 3- и 6-О-глюкуронид). Системная экспозиция каждого метаболита составляла менее 10% от общего количества препарат-связанного материала. Исследования in vitro показали, что основной путь метаболизма эмпаглифлозина у человека – глюкуронизация с участием уридин-5’-дифосфо- глюкуронозилтрансфераз UGT2B7, UGT1A3, UGT1A8 и UGT1A9.
Согласно данным популяционного фармакокинетического анализа период полувыведения в терминальной фазе составлял примерно 12,4 часа, а клиренс после перорального применения составлял 10,6 л/час. Межсубъектная и остаточная вариабельность клиренса эмпаглифлозина при пероральном приеме составляла 39,1% и 35,8% соответственно. При применении один раз в сутки равновесная концентрация эмпаглифлозина в плазме достигалась при приеме пятой дозы. В стационарном состоянии в соответствии с периодом полураспада наблюдалось накопление эмпаглифлозина до 22% по отношению к AUC для плазмы. После перорального применения меченого эмпаглифлозина [ 14 С] у здоровых добровольцев выводилось примерно 96% дозы (через кишечник 41% и почками 54%). Через кишечник большая часть меченого препарата выводилась в неизмененном виде. Почками в неизмененном виде выводилась только половина меченого препарата.
Фармакокинетика в особых группах пациентов
Нарушение функции почек
У пациентов с нарушением функции почек легкой, средней и тяжелой степени тяжести (30> рСКФ 2 ) и у пациентов с почечной недостаточностью/терминальной стадией почечной недостаточности значения AUC эмпаглифлозина увеличивались соответственно примерно на 18%, 20%, 66% и 48% по сравнению с пациентами с нормальной функцией почек. У пациентов с нарушением функции почек средней степени тяжести и у пациентов с почечной недостаточностью/терминальной стадией почечной недостаточности максимальная концентрация эмпаглифлозина в плазме была сходна с соответствующими значениями у пациентов с нормальной функцией почек. У пациентов с нарушением функции почек легкой и тяжелой степени тяжести максимальная концентрация эмпаглифлозина в плазме была примерно на 20% выше, чем у пациентов с нормальной функцией почек. Данные популяционного фармакокинетического анализа показали, что общий клиренс эмпаглифлозина уменьшался по мере снижения рСКФ, что приводило к увеличению экспозиции препарата.
Нарушение функции печени
У пациентов с легкими, средними и тяжелыми нарушениями функции печени (согласно классификации Чайлд-Пью) значения AUC эмпаглифлозина увеличивались, соответственно, примерно на 23%, 47% и 75%, а значения Сmax, соответственно, примерно на 4%, 23% и 48% по сравнению с пациентами с нормальной функцией печени.
Популяционный фармакокинетический анализ не выявил клинически значимого влияния пола пациента на фармакокинетику эмпаглифлозина.
Популяционный фармакокинетический анализ не выявил клинически значимого влияния возраста на фармакокинетику эмпаглифлозина.
В педиатрическом исследовании I фазы изучали фармакокинетику и фармакодинамику эмпаглифлозина (5 мг, 10 мг и 25 мг) у детей и подростков в возрасте от 10 до 18 лет с сахарным диабетом 2 типа. Наблюдаемые фармакокинетические и фармакодинамические результаты соответствовали полученным у взрослых пациентов.
Показания к применению
ДЖАРДИНС показан для лечения недостаточно контролируемого сахарного диабета 2 типа у взрослых в дополнение к диете и физической нагрузке:
— в качестве монотерапии, если назначение метформина нецелесообразно в связи с его непереносимостью;
— в комбинации с другими лекарственными средствами, применяемыми для лечения сахарного диабета.
Результаты исследований по применению комбинаций лекарственных средств, эффектам на гликемический контроль и сердечно-сосудистые заболевания, а также исследуемые популяции см. в разделах «Фармакодинамика», «Меры предосторожности» и «Взаимодействие с другими лекарственными средствами».
Способ применения и дозировка
Если эмпаглифлозин применяется в комбинации с производным сульфонилмочевины или инсулином, необходимо рассмотреть необходимость уменьшения дозы препаратов сульфонилмочевины или инсулина с целью снижения риска гипогликемии.
Особые группы пациентов
Нарушение функции почек
Учитывая механизм действия, гипогликемическая эффективность эмпаглифлозина зависит от функции почек. При нарушении функции почек с рСКФ ≥60 мл/мин/1,73м 2 или КК ≥60 мл/мин коррекция дозы не требуется.
Эмпаглифлозин не следует назначать пациентам с рСКФ 2 или КК 2 или КК менее 60 мл/мин, необходимо корректировать дозу эмпаглифлозина до 10 мг один раз в сутки или дозу 10 мг один раз в сутки оставить неизменной. Применение эмпаглифлозина следует прекратить при устойчивом снижении рСКФ менее 45 мл/мин/1,73м 2 или КК менее 45 мл/мин.
Эмпаглифлозин не следует назначать пациентам с терминальной стадией почечной недостаточности или пациентам, находящимся на диализе, в связи с ожидаемой неэффективностью у данных пациентов.
Нарушение функции печени
Пациентам с нарушениями функции печени коррекция дозы не требуется.
Экспозиция эмпаглифлозина увеличивается у пациентов с тяжелым нарушением функции печени. Не рекомендуется применение препарата у пациентов с тяжелым нарушением функции печени в связи с ограниченным опытом применения.
Коррекция дозы в зависимости от возраста не требуется. У пациентов в возрасте 75 лет и старше необходимо учитывать повышенный риск развития состояния с недостаточным объемом жидкости. У пациентов в возрасте 85 лет и старше начинать впервые терапию эмпаглифлозином не рекомендуется в связи с его ограниченным опытом применения.
Безопасность и эффективность эмпаглифлозина у детей и подростков еще не установлены. Данные отсутствуют.
Таблетки можно принимать независимо от приема пищи, проглатывая целиком и запивая водой. При пропуске очередного приема пациенту следует принять лекарственное средство, как только он об этом вспомнит, однако не следует принимать двойную дозу в один день.
Противопоказания
Повышенная чувствительность к активному ингредиенту или любому из вспомогательных веществ, указанных в разделе «Состав».
Побочное действие
Всего в клинические исследования по оценке безопасности эмпаглифлозина были включены 15582 пациента с сахарным диабетом 2 типа, из них 10004 пациента получали эмпаглифлозин либо в качестве монотерапии, либо в комбинации с метформином, производным сульфонилмочевины, пиоглитазоном, ингибиторами ДПП-4 или инсулином.
В 6 плацебо-контролируемых исследований продолжительностью 18-24 недели были включены 3534 пациента, из них 1183 пациента принимали плацебо, а 2351 – эмпаглифлозин. Общая частота нежелательных явлений у пациентов, получавших эмпаглифлозин, была сходна с плацебо. Наиболее часто сообщаемой нежелательной реакцией была гипогликемия при применении с производным сульфонилмочевины или инсулином (см. описание отдельных нежелательных реакций).
Частота неизвестна: некротизирющий фасциит промежности (гангрена Фурнье)*.
Нарушения метаболизма и питания
Редко: диабетический кетоацидоз*.
Нарушения со стороны кожи и подкожных тканей
Часто: зуд (генерализованный), сыпь.
Частота неизвестна: ангионевротический отек.
Нарушения со стороны сосудов
Нарушения со стороны почек и мочевыводящих путей
Лабораторные и инструментальные данные
a См. подразделы ниже для получения дополнительной информации.
b Среднее увеличение значений (в %) от исходных при приеме эмпаглифлозина 10 мг и 25 мг в сравнении с плацебо, соответственно: общий холестерин 4,9% и 5,7% в сравнении с 3,5%; холестерин липопротеидов высокой плотности 3,3% и 3,6% в сравнении с 0,4%; холестерин липопротеидов низкой плотности 9,5% и 10,0% сравнении с 7,5%; триглицериды 9,2% и 9,9% в сравнении с 10,5%.
c Среднее изменение значений гематокрита от исходных составляло 3,4% при приеме эмпаглифлозина 10 мг и 3,6% при приеме эмпаглифлозина 25 мг по сравнению с 0,1% для плацебо. В исследовании EMPA-REG OUTCOME значения гематокрита возвращались к исходным после 30-дневного периода наблюдения после прекращения лечения.
* См. раздел «Меры предосторожности».
Описание отдельных нежелательных реакций
Частота гипогликемии зависела от применявшейся фоновой терапии в соответствующих исследованиях и была сходной у пациентов, принимавших эмпаглифлозин или плацебо в виде монотерапии, дополнительной терапии к метформину, дополнительной терапии к пиоглитазону с или без метформина, дополнительной терапии к линаглиптину и метформину, дополнительной терапии к стандартному лечению и комбинации эмпаглифлозина и метформина у пациентов, не принимавших ранее данную комбинацию, по сравнению с пациентами, принимавшими эмпаглифлозин и метформин по отдельности. Частота развития гипогликемии была выше в случае назначения эмпаглифлозина в комбинации с метформином и производным сульфонилмочевины (эмпаглифлозин 10 мг: 16,1%, эмпаглифлозин 25 мг: 11,5%, плацебо: 8,4%), а также при применении в качестве дополнительной терапии к базальному инсулину с или без метформина и с или без производного сульфонилмочевины (эмпаглифлозин 10 мг: 19,5%, эмпаглифлозин 25 мг: 28,4%, плацебо: 20,6% в течение первых 18 недель лечения на фоне применения инсулина без регулирования дозы; эмпаглифлозин 10 мг и 25 мг: 36,1%, плацебо: 35,3% в течение исследования продолжительностью 78 недель), в качестве дополнительной терапии к инсулину с введением в режиме многократных инъекций с или без метформина (эмпаглифлозин 10 мг: 39,8%, эмпаглифлозин 25 мг: 41,3%, плацебо: 37,2% в течение первых 18 недель лечения на фоне применения инсулина без регулирования дозы; эмпаглифлозин 10 мг: 51,1%, эмпаглифлозин 25 мг: 57,7%, плацебо: 58% в течение исследования продолжительностью 52 недели).
Тяжелая гипогликемия (случаи, требующие медицинской помощи)
Увеличение частоты развития тяжелой гипогликемии не наблюдалось у пациентов, принимавших эмпаглифлозин, по сравнению с пациентами, принимавшими плацебо, при приеме в виде монотерапии, дополнительной терапии к метформину, дополнительной терапии к метформину и производному сульфонилмочевины, дополнительной терапии к пиоглитазону с или без метформина, дополнительной терапии к линаглиптину и метформину, дополнительной терапии к стандартному лечению и комбинации эмпаглифлозина и метформина у пациентов, не принимавших ранее данную комбинацию, по сравнению с пациентами, принимавшими эмпаглифлозин и метформин по отдельности. Частота развития гипогликемии была выше при применении в качестве дополнительной терапии к базальному инсулину с или без метформина и с или без производного сульфонилмочевины (эмпаглифлозин 10 мг: 0%, эмпаглифлозин 25 мг: 1,3%, плацебо: 0% в течение первых 18 недель лечения на фоне применения инсулина без регулирования дозы; эмпаглифлозин 10 мг: 0%, эмпаглифлозин 25 мг: 1,3%, плацебо: 0% в течение исследования продолжительностью 78 недель), в качестве дополнительной терапии к инсулину с введением в режиме многократных инъекций с или без метформина (эмпаглифлозин 10 мг: 0,5%, эмпаглифлозин 25 мг: 0,5%, плацебо: 0,5% в течение первых 18 недель лечения на фоне применения инсулина без регулирования дозы; эмпаглифлозин 10 мг: 1,6%, эмпаглифлозин 25 мг: 0,5%, плацебо: 1,6% и в течение исследования продолжительностью 52 недели).
Вагинальный кандидоз, вульвовагинит, баланит и другие генитальные инфекции
О развитии вагинального кандидоза, вульвовагинита, баланита и других генитальных инфекциях сообщалось чаще у пациентов, принимавших эмпаглифлозин (эмпаглифлозин 10 мг: 4,0%, эмпаглифлозин 25 мг: 3,9%), по сравнению с пациентами, принимавшими плацебо (1,0%). Генитальные инфекции чаще отмечались у женщин, принимавших эмпаглифлозин по сравнению с плацебо, у мужчин разница в частоте возникновения инфекции была менее выражена. Интенсивность генитальных инфекций была слабой или умеренной.
Частота учащенного мочеиспускания (включая предварительно установленные термины поллакиурия, полиурия, никтурия) была выше в случае применения эмпаглифлозина (в дозе 10 мг: 3,5%, в дозе 25 мг: 3,3%), чем в случае применения плацебо (1,4%). Интенсивность учащенного мочеиспускания была слабой или умеренной. Частота развития никтурии была сопоставима в группе пациентов, принимавших эмпаглифлозин, и в группе пациентов, принимавших плацебо (менее 1%).
Инфекции мочевыводящих путей
Общая частота развития инфекций мочевыводящих путей, сообщенных как нежелательное явление, была сходной в случае применения эмпаглифлозина 25 мг и плацебо (7,0% и 7,2%), но выше в случае применения эмпаглифлозина 10 мг (8,8%). Так же, как и в случае применения плацебо, инфекции мочевыводящих путей на фоне приема эмпаглифлозина чаще отмечались у пациентов с хроническими и рецидивирующими инфекциями мочевыводящих путей в анамнезе. Интенсивность (легкая, умеренная, тяжелая) инфекций мочевыводящих путей была сходной у пациентов, принимавших эмпаглифлозин и плацебо. Инфекции мочевыводящих путей чаще отмечались у женщин, принимавших эмпаглифлозин, по сравнению с принимавшими плацебо, у мужчин разница в частоте не зарегистрирована.
Частота развития гиповолемии (включая предварительно установленные термины снижение артериального давления (амбулаторно), снижение систолического артериального давления, дегидратация, гипотензия, гиповолемия, ортостатическая гипотензия, обморок) была сходной в случае применения эмпаглифлозина (в дозе 10 мг: 0,6%, в дозе 25 мг: 0,4%) и плацебо (0,3%). Частота развития гиповолемии увеличивалась у пациентов в возрасте 75 лет и старше, принимавших эмпаглифлозин в дозе 10 мг (2,3%) и в дозе 25 мг (4,3%), по сравнению с плацебо (2,1%).
Повышенный креатинин в крови/уменьшенная скорость клубочковой фильтрации
Общее количество пациентов с повышенным уровнем креатинина в крови и сниженной скоростью клубочковой фильтрации было сходным при приеме эмпаглифлозина и плацебо (повышенный уровень креатинина в крови: 0,6% при приеме эмпаглифлозина 10 мг, 0,1% при приеме эмпаглифлозина 25 мг, 0,5% при приеме плацебо; сниженная скорость клубочковой фильтрации; 0,1% при приеме эмпаглифлозина 10 мг, 0% при приеме эмпаглифлозина 25 мг, 0,3% при приеме плацебо).
Первоначальное повышение креатинина и уменьшение скорости клубочковой фильтрации у пациентов, получавших эмпаглифлозин, было, как правило, преходящим при продолжающемся лечении или обратимым при прекращении приема препарата.
Соответственно в исследовании EMPA-REG OUTCOME у пациентов, получавших эмпаглифлозин, наблюдалось первоначальное снижение уровня рСКФ (среднее: 3 мл/мин/1,73 м 2 ). После этого рСКФ сохранялась во время продолжения лечения. Среднее значение рСКФ возвращалось к исходному уровню после прекращения лечения, что позволяет предположить, что острые гемодинамические изменения могут играть определенную роль в этих изменениях функции почек.
Сообщение о предполагаемых побочных реакциях
Сообщать о подозреваемых побочных реакциях после получения разрешения на лекарственный препарат очень важно. Это позволяет непрерывно контролировать соотношение польза/риск лекарственного средства. Здравоохранение профессионалов просят сообщать о любых предполагаемых побочных реакциях через национальную систему отчетности – в РУП «Центр экспертиз и испытаний в здравоохранении»: с использованием формы извещения о нежелательной реакции на сайте www.rceth.by, по электронной почте rcpl@rceth.by или по адресу: Товарищеский пер. 2а, г. Минск, 220037, Республика Беларусь, тел/факс 242-00-29.
Передозировка
В контролируемых клинических исследованиях однократные дозы эмпаглифлозина до 800 мг (в 32 раза превышающие максимальную рекомендуемую суточную дозу) у здоровых добровольцев и многократный прием в сутки доз эмпаглифлозина до 100 мг (в 4 раза превышающих максимальную рекомендуемую суточную дозу) у пациентов с сахарным диабетом 2 типа не вызывали явлений токсичности. Эмпаглифлозин вызывал повышение экскреции глюкозы с мочой, что приводило к увеличению объема мочи. Наблюдавшееся увеличение объема мочи не зависело от дозы и не является клинически значимым. Опыт применения препарата у людей в дозах выше 800 мг отсутствует.
В случае передозировки назначаемое лечение зависит от клинического состояния пациента. Возможность выведения эмпаглифлозина при гемодиализе не изучена.
Меры предосторожности
Зарегистрированы редкие случаи диабетического кетоацидоза, в том числе жизнеугрожающего и с летальным исходом, при применении пациентами ингибиторов SGLT2, в том числе эмпаглифлозина. В ряде случаев, клиническая картина состояния была атипичной, с умеренно повышенными значениями содержания глюкозы в крови – ниже 14 ммоль/л (250 мг/дл). О взаимосвязи между частотой диабетического кетоацидоза и более высокими дозами эмпаглифлозина не известно.
Риск развития диабетического кетоацидоза необходимо учитывать в случае появления неспецифических симптомов, таких как тошнота, рвота, отсутствие аппетита, боли в животе, чрезмерная жажда, затруднение дыхания, спутанность сознания, необычная усталость или сонливость. При появлении данных симптомов пациенты должны быть оценены на предмет наличия кетоацидоза немедленно, независимо от уровня глюкозы в крови.
У пациентов, у которых подозревается или диагностирован диабетический кетоацидоз, лечение эмпаглифлозином следует немедленно прекратить.
Лечение должно быть приостановлено у пациентов, госпитализированных для проведения обширных хирургических вмешательств, или в связи с острыми серьезными заболеваниями. Таким пациентам рекомендуется контроль содержания кетонов. Определение уровня кетонов в крови предпочтительнее определения уровня кетонов в моче. Лечение эмпаглифлозином может быть возобновлено после нормализации значения содержания кетонов и стабилизации состояния пациента.
До начала лечения эмпаглифлозином необходимо рассмотреть факторы в анамнезе болезни пациента, которые могут предрасположить к развитию кетоацидоза.
К пациентам, подверженным более высокому риску кетоацидоза, относятся пациенты с низким резервом функции бета-клеток (например, пациенты с сахарным диабетом 2 типа с низким уровнем С-пептида или латентным аутоиммунным сахарным диабетом у взрослых, или пациенты с панкреатитом в анамнезе), пациенты с состояниями, приводящими к ограничению приема пищи или тяжелому обезвоживанию, пациенты, у которых проводится снижение дозы инсулина, и пациенты с повышенной потребностью в инсулине из-за острого заболевания, хирургического вмешательства или злоупотребления алкоголем. У данных пациентов ингибиторы SGLT2 следует применять с осторожностью.
Повторное назначение ингибитора SGLT2 пациентам с предшествующим диабетическим кетоацидозом на фоне лечения ингибитором SGLT2 не рекомендуется, за исключением случаев, когда точно установлен и устранен другой провоцирующий фактор.
ДЖАРДИНС не следует назначать для лечения пациентов с сахарным диабетом 1 типа. Данные, полученные в ходе программы клинических исследований у пациентов с сахарным диабетом 1 типа, показывают увеличение случаев диабетического кетоацидоза с одинаковой частотой у пациентов, принимавших эмпаглифлозин 10 мг или 25 мг в качестве дополнения к инсулину, по сравнению с пациентами, получавшими плацебо.
Нарушение функции почек
ДЖАРДИНС не следует назначать пациентам с рСКФ менее 60 мл/мин/1,73м 2 или КК 2 или КК 2 или КК менее 45 мл/мин. Эмпаглифлозин не следует назначать пациентам с терминальной стадией почечной недостаточности или пациентам, находящимся на диализе, в связи с ожидаемой неэффективностью у данных пациентов.
Мониторинг функции почек
Учитывая механизм действия, гипогликемическая эффективность эмпаглифлозина зависит от функции почек. Поэтому оценку функции почек рекомендуется проводить следующим образом:
— до назначения эмпаглифлозина и периодически во время лечения, т.е. не реже 1 раза в год;
— до назначения любой сопутствующей терапии лекарственным средством, способным оказать негативное влияние на функцию почек.
Нарушение функции печени
В клинических исследованиях эмпаглифлозина зарегистрированы случаи нарушения функции печени. Причинно-следственная связь между приемом эмпаглифлозина и нарушением функции печени не установлена.
При лечении эмпаглифлозином наблюдалось повышение значения гематокрита.
Риск развития гиповолемии
Основываясь на механизме действия ингибиторов SGLT2, осмотический диурез, сопровождающий терапевтический эффект глюкозурии, может привести к умеренному снижению артериального давления. Поэтому препарат следует применять с осторожностью у пациентов, у которых снижение артериального давления на фоне приема эмпаглифлозина может представлять опасность, например, у пациентов с сердечно-сосудистыми заболеваниями, пациентов, принимающих гипотензивные препараты (со случаями артериальной гипотензии в анамнезе), а также у пациентов в возрасте 75 лет и старше.
В случае если у пациента развиваются состояния, которые могут привести к потере жидкости (например, при заболеваниях желудочно-кишечного тракта), следует тщательно мониторировать степень обезвоживания (например, физикальный осмотр, измерение артериального давления, лабораторные анализы, включая уровень гематокрита) и электролиты у пациента, принимающего эмпаглифлозин. Может потребоваться временное, вплоть до восстановления водного баланса, прекращение приема препарата.
Эффект эмпаглифлозина на экскрецию глюкозы связан с осмотическим диурезом, что может повлиять на состояние гидратации. У пациентов в возрасте 75 лет и старше существует повышенный риск обезвоживания. У таких пациентов, получавших эмпаглифлозин, чаще (по сравнению с пациентами, получавшими плацебо) отмечались нежелательные реакции, связанные с гиповолемией. В связи с этим в случае одновременного применения с лекарственными средствами, которые могут привести к развитию гиповолемии (например, диуретики, ингибиторы АПФ), следует обращать особое внимание на прием жидкости такими пациентами. Опыт применения эмпаглифлозина у пациентов в возрасте 85 лет и старше ограничен. Назначение эмпаглифлозина впервые данной группе пациентов не рекомендуется.
Инфекции мочевыводящих путей
В плацебо-контролируемых двойных слепых исследованиях продолжительностью 18-24 недели частота развития такого нежелательного явления, как инфекции мочевыводящих путей, была сопоставима у пациентов, принимавших эмпаглифлозин 25 мг и плацебо, и выше у пациентов, принимавших эмпаглифлозин 10 мг.
У пациентов, принимавших эмпаглифлозин, были зарегистрированы пострегистрационные случаи осложненных инфекций мочевыводящих путей, в том числе случаи пиелонефрита и уросепсиса. В случае развития осложненных инфекций мочевыводящих путей необходимо временное прекращение приема эмпаглифлозина.
Некротизирующий фасциит промежности (гангрена Фурнье)
У пациентов женского и мужского пола, принимающих ингибиторы SGLT2, сообщалось о пострегистрационных случаях некротизирующего фасциита промежности (также известного как гангрена Фурнье). Это редкое, но серьезное и потенциально жизнеугрожающее явление, которое требует срочного хирургического вмешательства и антибактериальной терапии.
Пациентам должно быть рекомендовано обратиться к врачу, если они наблюдают сочетание симптомов: боль, болезненная чувствительность, покраснение или припухлости в области половых органов или промежности на фоне лихорадки или недомогания. Необходимо знать, что некротизирующему фасцииту могут предшествовать урогенитальная инфекция или абсцесс промежности. При подозрении на гангрену Фурнье применение ДЖАРДИНС следует прекратить и немедленно начать лечение (включая антибактериальную терапию и хирургическое лечение).
Ампутации нижних конечностей
В долгосрочных клинических исследованиях другого ингибитора SGLT2 наблюдалось увеличение случаев ампутации нижних конечностей (главным образом пальцев стоп). Неизвестно, является ли это эффектом, характерным для всего класса лекарственных препаратов. Как и всем пациентам с сахарным диабетом, важно напоминать пациентам о необходимости регулярного профилактического ухода за ногами.
Опыт применения у пациентов с сердечной недостаточностью I-II класса по классификации Нью-Йоркской Кардиологической Ассоциации (NYHA) ограничен; опыт применения эмпаглифлозина в клинических исследованиях у пациентов с III- IV классом по NYHA отсутствует. В исследовании EMPA-REG OUTCOME на исходном уровне о сердечной недостаточности сообщалось у 10,1% пациентов. Снижение уровня смертности от сердечно-сосудистых заболеваний у таких пациентов было сопоставимо с общей популяцией пациентов.
Лабораторный анализ мочи
В связи с механизмом действия ДЖАРДИНС у пациентов, принимающих данный препарат, будет наблюдаться положительный результат теста на глюкозу в моче.
Влияние на результаты теста на 1,5-ангидроглюцитол
Мониторирование гликемического контроля с помощью теста на 1,5-ангидроглюцитол не рекомендуется в связи с тем, что определение 1,5-ангидроглюцитола является недостоверным для оценки гликемического контроля у пациентов, принимающих ингибиторы SGLT2. Рекомендуется применение альтернативных методов мониторирования гликемического контроля.
Таблетки содержат лактозу. Пациентам с редкой наследственной непереносимостью галактозы, общим дефицитом лактазы или мальабсорбцией глюкозы-галактозы не следует принимать данный лекарственный препарат.
Каждая таблетка содержит менее 1 ммоль натрия (23 мг), т.е. практически не содержит натрий.
Фертильность, беременность и кормление грудью
Данных о применении эмпаглифлозина у беременных женщин нет. Исследования на животных показали, что эмпаглифлозин проникает через плаценту на поздних сроках беременности в очень незначительном количестве, не оказывая прямого или опосредованного негативного влияния на раннее развитие эмбриона. Тем не менее, исследования на животных показали нежелательное воздействие на постнатальное развитие. В качестве меры предосторожности рекомендуется избегать применения ДЖАРДИНС во время беременности.
Период грудного вскармливания
Клинические данные, свидетельствующие об экскреции эмпаглифлозина с грудным молоком, отсутствуют. Токсикологические данные, полученные в исследованиях на животных, свидетельствуют о проникновении эмпаглифлозина в грудное молоко. Не исключается риск воздействия на новорожденных и младенцев. Не следует применять ДЖАРДИНС в период грудного вскармливания.
Исследования влияния ДЖАРДИНС на фертильность человека не проводились. В исследованиях на животных прямого или опосредованного неблагоприятного воздействия на фертильность не обнаружено.
Влияние на способность управлять транспортными средствами и работать с механизмами
ДЖАРДИНС оказывает несущественное влияние на способность управлять транспортными средствами и работать с механизмами. Пациентам рекомендуется принимать меры предосторожности, чтобы избежать гипогликемии во время управления транспортным средством и работы с механизмами, особенно при применении ДЖАРДИНС в комбинации с производным сульфонилмочевины и/или инсулином.
Взаимодействие с другими лекарственными средствами
Эмпаглифлозин может усиливать диуретический эффект тиазидных и «петлевых» диуретиков, что, в свою очередь, может увеличить риск развития дегидратации и артериальной гипотензии.
Инсулин и препараты, усиливающие его секрецию
Инсулин и препараты, усиливающие его секрецию, такие как производные сульфонилмочевины, могут повышать риск гипогликемии. Поэтому при одновременном применении эмпаглифлозина с инсулином и препаратами, усиливающими его секрецию, может потребоваться снижение их дозы для уменьшения риска развития гипогликемии.
Влияние других лекарственных препаратов на эмпаглифлозин
Исследования in vitro показали, что основным путем метаболизма эмпаглифлозина в организме человека является глюкуронизация с участием уридин-5’-дифосфо-глюкуронозилтрансфераз UGT1A3, UGT1A8, UGT1A9 и UGT2B7. Эмпаглифлозин является субстратом для органических анионных переносчиков ОАТЗ, ОАТР1В1 и ОАТР1ВЗ человека, но не является субстратом для органических анионных переносчиков 1 (ОАТ1) и органических катионных переносчиков 2 (ОСТ2). Эмпаглифлозин является субстратом для гликопротеина Р (Р-gp) и белка, определяющего резистентность рака молочной железы.
Совместное применение эмпаглифлозина с пробенецидом, ингибитором ферментов UGT и ОАТЗ, привело к увеличению максимальной концентрации эмпаглифлозина в плазме крови (Сmax) на 26% и увеличению площади под кривой концентрация-время (AUC) на 53%. Данные изменения не являются клинически значимыми.
Влияние индукции UGT (например, индукции рифампицином или фенитоином) на эмпаглифлозин не изучалось. Совместное применение с лекарственными препаратами, являющимися индукторами ферментов UGT, не рекомендуется в связи с потенциальным риском снижения эффективности. При необходимости совместного применения индуктора данных ферментов UGT следует мониторировать гликемический контроль для оценки ответной реакции на ДЖАРДИНС.
Исследование взаимодействия с гемфиброзилом, ингибитором переносчиков ОАТЗ и ОАТР1В1/1ВЗ in vitro, выявило увеличение Сmax эмпаглифлозина на 15% и AUC на 59% после совместного приема. Данные изменения не являются клинически значимыми.
Ингибирование ОАТР1В1/1ВЗ переносчиков путем совместного применения с рифампицином привело к увеличению Сmax эмпаглифлозина на 75% и увеличению AUC на 35%. Данные изменения не являются клинически значимыми.
Экспозиция эмпаглифлозина была сходной при совместном применении с верапамилом, ингибитором Р-gp, и без него, что доказывает отсутствие клинически значимого влияния ингибирования Р-gp на эмпаглифлозин.
Исследования лекарственных взаимодействий свидетельствуют о том, что фармакокинетика эмпаглифлозина не изменяется в случае его совместного применения с метформином, глимепиридом, пиоглитазоном, ситаглиптином, линаглиптином, варфарином, верапамилом, рамиприлом, симвастатином, торасемидом и гидрохлортиазидом.
Эффекты эмпаглифлозина на другие лекарственные средства
Основываясь на исследованиях in vitro эмпаглифлозин не вызывает ингибирование, инактивацию или индукцию изоферментов CYP450.
Эмпаглифлозин не ингибирует UGT1A1, UGT1A3, UGT1A8, UGT1A9 или UGT2B7. Лекарственные взаимодействия между эмпаглифлозином и совместно применяемыми субстратами основных изоформ CYP450 и UGT считаются маловероятными.
В терапевтических дозах эмпаглифлозин не ингибирует Р-gp. Основываясь на исследованиях in vitro взаимодействие эмпаглифлозина с активными веществами, являющимися Р-gp субстратами, считается маловероятным. Совместное применение дигоксина, субстрата Р-gp, с эмпаглифлозином привело к увеличению AUC дигоксина на 6% и увеличению Сmax дигоксина на 14%. Эти изменения не являются клинически значимыми.
Эмпаглифлозин не ингибирует переносчики ОАТ3, ОАТР1В1 и ОАТР1ВЗ человека in vitro в клинически значимых концентрациях в плазме, таким образом, лекарственные взаимодействия с субстратами этих транспортеров считаются маловероятными.
Исследования взаимодействий, проведенные на здоровых добровольцах, позволяют предположить, что эмпаглифлозин не оказывает клинически значимого влияния на фармакокинетику метформина, глимепирида, пиоглитазона, ситаглиптина, линаглиптина, симвастатина, варфарина, рамиприла, дигоксина, диуретиков и оральных контрацептивов.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 10 мг или 25 мг.
По 10 таблеток в блистер из алюминиевой фольги/ПВХ.
По 3 блистера с инструкцией по применению в картонной пачке.
Условия хранения
Хранить при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности
Не использовать после окончания срока годности.
Условия отпуска из аптек
Берингер Ингельхайм Фарма ГмбХ и Ко. КГ, Германия.
Бингер штрассе 173, 55216 г. Ингельхайм-на-Рейне, Германия.
г. Минск, ул. В. Хоружей, 22-1402.
Тел.:
(+375 17) 242 16 33, факс: (+375 17) 242 16 40.