Фтор в состав чего входит
Фтор (F, Fluor)
История фтора
Как и многие элементы, фтор сначала был «предсказан» теоретически, как атом плавиковой кислоты (которую открыл в 1771 году Карл Шееле) в 1810 году, и только в конце XIX столетия Анри Муассан выделил фтор в свободном виде. Своим названием фтор обязан древнегреческому слову φθόρος которое переводится как разрушение.
Общая характеристика фтора
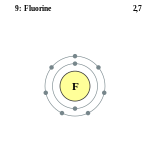
Фтор является элементом XVII группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 9. Принятое обозначение – F (от латинского Fluorum).
Нахождение в природе
Фтор в природе находится как правило в минерале под названием флюорит, который встречается в небольших количествах в почве и водах рек и океанов.
Физические и химические свойства
Фтор является химически активным неметаллом, это самый лёгкий галоген, представляет собой бледно-жёлтый газ с резким запахом, является агрессивным и ядовитым (calorizator). Температура плавления фтора – аномально низкая, поэтому элемент хранится в жидком или газообразном состоянии.
Суточная потребность во фторе
Суточная норма во фторе увеличивается по мере роста человека, от 0,5 до 0,9 мг у детей и 1,5-4 мг у взрослых женщин и мужчин.
Продукты питания богатые фтором
Полезные свойства фтора и его влияние на организм
Фтор в организме человека:
Признаки нехватки фтора
Основными признаками нехватки фтора являются заболевания зубов и дёсен – пародонтоз и кариес.
Признаки избытка фтора
Признаками переизбытка фтора в организме человека являются замедление обмена веществ, поражение эмали зубов, деформация костей скелета, тошнота и рвота.
Применение фтора в жизни
Основное применение фтор находит как сильный окислитель в производстве ракетного топлива и химических полимеров, в медицине используется как кровезаменитель и ингредиент многих лекарственных препаратов.
| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
Строение молекулы
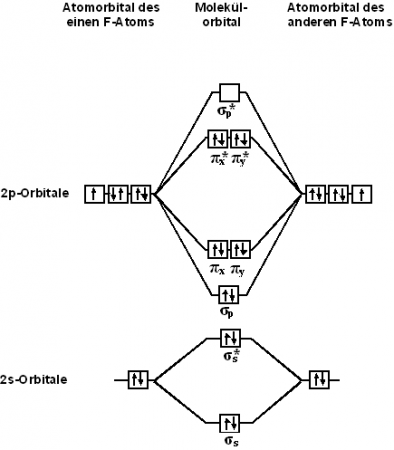
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
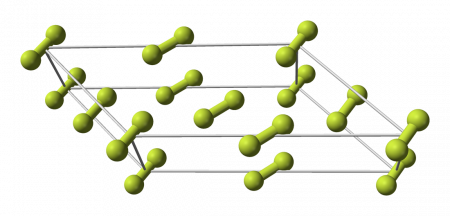
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Ядерные свойства изотопов фтора
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Продукты питания богатые фтором

Функции фтора в организме
Фтор присутствует почти во всех тканях человеческого организма, но наивысшая концентрация вещества (почти 96 %) – в составе зубов и костей. Фториды, попадающие в организм с пищей, полностью ионизируются и быстро всасываются, распределяясь между клетками.
Абсорбируется вещество в кишечнике, по телу транспортируется с током крови. Довольно быстро выводится из организма с мочой. Фтор увеличивает биодоступность кальция и снижает агрессивность кислот в ротовой полости. Необходим для нормальной минерализации костей и формирования зубной эмали. Фтор и кальций тесно взаимосвязаны в пределах человеческого организма и работают в основном в тандеме, чаще во внешних частях костей.
Дефицит и передозировка фтора
Общепринятая суточная доза F для взрослого человека составляет 1,5-2 мг (немного больше при остеопорозе). Недостаточное потребление этого микроэлемента вызывает кариес, ухудшает зрение, усиливает уязвимость организма перед инфекциями.
Последствия хронического F-дефицита:
Передозировка фтором хоть и редко, но все-таки встречается. В случае отравления минералом важно пить много воды (больше 2 литров в сутки) и принимать кальция глюконат (способствует более быстрому выведению фтора из организма). Быстрый эффект для очищения от излишков микроэлемента дают слабительные препараты, содержащие натрия сульфат. Избавиться от проявлений флюороза поможет отбеливание эмали зубов.
Пищевые источники
Фтор содержат: спаржа, авокадо, брюссельская капуста, морковь, тмин, цветная капуста, огурцы, финики лимонная трава, петрушка, репа, ботва свеклы, одуванчики, семена подсолнечника, чеснок, шпинат, помидоры, зеленые листовые овощи, орехи (особенно миндаль), репа, водоросли.
Кстати, интересно, что фтор обладает способностью «мигрировать» в воду, что особенно полезно для отваров и чаев. Например, при заваривании черного чая примерно 70-90 процентов фтора переходит из его листьев в жидкость. Из мяты «выходит» примерно 30% содержащегося минерала, из шиповника – примерно 20 процентов, а ромашка отдает только 5 % полезного микроэлемента.
| Продукт (200 г) | Фтор (мг) |
|---|---|
| Чай (черный, зеленый, белый) | 20 |
| Скумбрия | 3 |
| Тунец | 2 |
| Минеральная вода | 1,5 |
| Хек | 1,4 |
| Минтай | 1,4 |
| Треска | 1,4 |
| Путассу | 1,4 |
| Орехи грецкие | 1,3 |
| Ставрида | 1 |
| Камбала | 0,9 |
| Лещ морской | 0,86 |
| Макрель | 0,86 |
| Лосось | 0,86 |
| Форель | 0,86 |
| Рак | 0,86 |
| Гребешки морские | 0,86 |
| Устрицы | 0,86 |
| Кефаль | 0,86 |
| Баранье мясо | 0,3 |
| Свинина | 0,3 |
| Птица | 0,28 |
| Куриные яйца | 0,18 |
| Гречка | 0,1 |
| Манка | 0,1 |
| Молоко | 0,1 |
| Картошка | 0,1 |
| Макароны | 0,1 |
| Говяжье мясо | 0,032 |
| Редис | 0,012 |
| Морковь | 0,006 |
Топ-10 продуктов, необходимых для детей
О важности фтора для детей не приходится напоминать. Растущий организм, как никто другой нуждается в этом микроэлементе для формирования здоровых костей и зубов, укрепления эмали и предотвращения стоматологических болезней.
Дефицит фтора, как и кальция, чреват серьезными нарушениями в развитии детей: от искривлений в позвоночнике до потери зрения.
Но это не значит, что ребенка с ранних лет необходимо кормить биодобавками с F. Источниками нутриента для детей должны быть только натуральные продукты. Избыток минерала также не самое приятное, что может случиться с человеком. Потребление более 0,5 мг фтора на 1 кг веса ребенка вызывает флюороз (проявляется белыми и темными пятнами на зубной эмали). Большая передозировка вызывает ноющие боли в костях, пятна на зубах (белые и коричневые). Такие же признаки отравления фтором могут возникать и у взрослых. Но у них, ко всему прочему, ещё добавляются узловатость суставов, быстрое старение костной ткани, появление морщин и развитие склеродермии (образование жестких участков кожи).
Составляя список продуктов, богатых фтором, в первую очередь важно помнить о воде, которая является лучшим источником минерала. Также важно ввести в детский рацион чай, орехи, подсолнечные семена, фрукты и овощи. В частности, делая акцент на моркови, репе, ботве свеклы, чесноке, шпинате, листовой зелени.

Важное замечание. Дети, особенно в раннем возрасте (до 2 лет), часто склонны к пищевым аллергиям. Поэтому вводить в рацион любой из названных продуктов стоит медленно, осторожно и маленькими порциями. Только после того, как организм привыкнет к новой пище и порции, частоту приема того или иного продукта можно увеличивать. Не пренебрегайте этим правилом! Любой продукт должен нести пользу, а не порождать проблемы со здоровьем.
Другие гастрономические рекомендации

Все супы, приготовленные на костях, и бульоны из птицы (мясо должно быть также с костями) являются не только сытным блюдом, но и чрезвычайно концентрированным источником F. Хотя есть одно замечание. Желаете быть уверенными в пользе такого бульона – позаботьтесь о качестве мяса. И если нет возможности есть домашнюю птицу, то, по крайней мере, покупайте продукт от проверенных производителей.
Конечно, свежеприготовленная пища – это вкуснее и полезнее всего. Но и консервы не всегда плохо. Рыбные, например, (особенно с костями) являются одним из лучших продуктовых источников F. Но в этом случае также важно проверить качество и свежесть продукта.
Категорически не приемлете консервы? Не беда. Рыба, приготовленная самостоятельно, ничем не хуже. А по вкусу – лучше во много раз. Единственно правило: варить, тушить, запекать или жарить рыбу желательно с костями. Такой продукт содержит в себе в разы больше фтора, чем филе тех же сортов. Продолжая тему даров моря, стоит напомнить, что моллюски также благотворно влияют на состояние костей и зубов.
Овсянка принадлежит к списку продуктов, богатых микроэлементами, в частности фтором. Но маленькое предостережение. Все-таки лучше отдавать предпочтение обычным «геркулесовым» хлопьям, чем новомодным кашам, быстрого приготовления, напичканным усилителями вкуса и химическими «Е»-добавками. В связи с этим, повезло любителям проросших зерен – они получают от злаков больше всего пользы.
Фруктовые и овощные соки – в числе продовольствий, насыщенных фтором. Но опять-таки, полезными могут называться только свежевыжатые фреши из качественных продуктов. Выращенное «на химии» не стоит выбирать в качестве сырья для витаминного напитка. От таких соков вреда больше, чем пользы. И конечно же, лучше навсегда забыть о существовании напитков, изготовленных из концентратов.
Токсичные источники
Наверное, многие слышали о фторированной воде, попадающей в наши дома по коммунальным водопроводам. В состав жидкости из крана обычно входит неорганическая форма фтора. А это, как убеждают медики, не самый безопасный способ пополнения запасов минерала. И уж тем более, не стоит применять такую воду (даже после кипячения) для приготовления еды малышам.
Высокую концентрацию фтора нередко можно найти и в вине. Но причислить такой напиток к полезным трудно, хотя бы по той причине, что источниками фтора в нем является пестицид (криолит), которым обрабатывали виноградники. Используют криолит (содержит фторид натрия) как средство против насекомых-вредителей. Порой концентрация F в бокале такого вина может превышать содержание микроэлемента в литре специально фторированной воды.
Выбирайте только правильные продукты для поддержания витаминно-минерального баланса, и организм непременно отблагодарит вас хорошим здоровьем.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Фтор в состав чего входит
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» ( φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Ядерные свойства изотопов фтора
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной со следующими параметрами решётки:
| Параметр | и значение |
|---|---|
| a | 550 пм |
| b | 328 пм |
| c | 728 пм |
| α=β=γ | 90° |
Получение
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
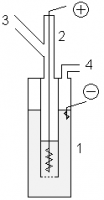
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов — химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Ракетная техника
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Дополнительная информация
Фториды
Соединения фтора в ракетной технике
Соединения фтора в медицине
Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда