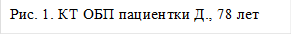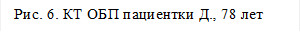Хэпа печени что это
Хэпа печени что это
Печень – паренхиматозный орган, наиболее часто поражаемый злокачественными новообразованиями. В структуре злокачественных новообразований печени выделяют две основные формы: первичный рак печени и метастатическое поражение. Метастатический рак печени встречается гораздо чаще первичного [4]. Среди всех первичных злокачественных новообразований печени частота ГЦР достигает 95%. ГЦР является существенной проблемой общественного здравоохранения, занимая 5-е место по распространенности, 3-е по числу летальных исходов среди злокачественных новообразований печени и 1-е место среди причин смерти у больных с циррозом печени [1].
Цирроз печени независимо от этиологии – основной фактор риска развития ГЦР. По статистике, ГЦР возникает у 3–5% больных циррозом печени, причем значительно чаще у мужчин. Нередки случаи гепатоцеллюлярной карциномы при алкогольном циррозе печени, гемохроматозе, аутоиммунном гепатите, наследственной недостаточности α1-антитрипсина, хронической HCV-инфекции, а также при некоторых редких наследственных заболеваниях (наследственная тирозинемия, нарушение обмена гликогена) [3].
Золотым стандартом лечения больных со злокачественными новообразованиями печени являются резекция печени и в более редких случаях трансплантация печени. Однако, к моменту диагностики радикальное удаление опухоли возможно лишь у 5-15 % больных. Вместе с тем, более чем у 70-90% пациентов после радикальной резекции в течение 3-5 лет развивается рецидив заболевания, из них повторную резекцию удается выполнить не более чем у 10% [5].
С целью улучшения отдаленных результатов лечения больных нерезектабельными опухолями печени в клиническую практику были внедрены рентгенэндоваскулярные методики. К ним относятся: химиоинфузия в печеночную артерию, химиоэмболизация и масляная ХЭПА, радиоэмболизация.
Питание опухолей печени на 90-95% осуществляется за счет артериальной крови, в то время как нормальная паренхима имеет двойное кровоснабжение: 70% из воротной вены и лишь 30% из печеночной артерии. Исходя из этого, окклюзия печеночной артерии, кровоснабжающей опухоль, приводит к ишемическому некрозу опухолевых клеток, оставляя сохранными здоровые гепатоциты [5].
ХЭПА микросферами основана на введении в артерии, питающие опухоль, эмболизата, состоящего из микросфер и адсорбированного на них химиопрепарата. Методика обладает следующими достоинствами: селективное воздействие на опухолевую ткань; время элиминации химиопрепарата с поверхности микросфер составляет от 1 недели до 2 месяцев в зависимости от размера микросфер; хемотоксичность практически отсутствует, так как концентрации химиопрепарата в системном кровотоке низкие, поэтому возможно одномоментное введение больших доз химиопрепарата; ишемия опухоли посредством микросфер, при этом можно регулировать ее глубину, подбирая размер микросфер [2].
Предлагаем вниманию читателей описание клинического случая ХЭПА микросферами у пациентки с неоперабельным ГЦР, проведенной в отделении рентгенохирургических методов диагностики и лечения Республиканского кардиологического диспансера г. Чебоксары.
У пациентки Д., 78 лет, в апреле 2017 года на ультразвуковом исследовании органов брюшной полости (УЗИ ОБП) было выявлено очаговое образование печени, с целью дообследования была направлена в Республиканский клинический онкологический диспансер г. Чебоксары.
Из сопутствующих заболеваний: хронический вирусный гепатит С, гипертоническая болезнь 2 ст., атеросклероз аорты, варикозная болезнь нижних конечностей.
Рентгенография легких: рентгенологических признаков онкопатологии легких не обнаружено.
Магнитно-резонансная томография головного мозга: МР-признаки кистозно-глиозных изменений в лобной доле справа. Очаги энцефаломаляции в лобно-теменных отделах с обеих сторон дисциркуляторного характера. Заместительная смешанная гидроцефалия на фоне атрофических изменений вещества головного мозга.
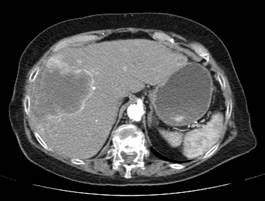
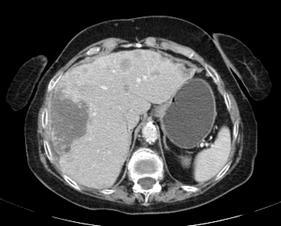
Компьютерная томография органов брюшной полости (КТ ОБП) от 19.08.2017: в правой доли печени определяется большое гиподенсное образование примерными размерами 123х57х95 мм без четких контуров, более четко выявляемое при контрастировании. Здесь же в печени определяется множество образований различных размеров до 24 мм (Рис.1).
УЗИ ОБП от 18.08.2017: Ультразвуковые признаки незначительного увеличения размеров печени на фоне диффузно-очаговых изменений (образование правой доли печени, множественные метастазы). Диффузные изменения паренхимы поджелудочной железы.
УЗИ щитовидной железы и периферических лимфатических узлов (ЛУ): Признаки очаговых образований обеих долей щитовидной железы. УЗ-патологии периферических ЛУ на момент осмотра не выявлено.
УЗИ органов малого таза: УЗ-образование в проекции левого яичника, свободная жидкость в позадиматочном пространстве.
Эзофагогастродуоденоскопия: Варикозное расширение вен пищевода 1 степени (в виде флебэктазии). Недостаточность кардии 2 степени. Дуодено-гастральный рефлюкс.
Колоноскопия: Дивертикулы сигмовидной кишики.
Эхокардиография: Атеросклеротические изменения стенок аорты с переходом на створки аортального клапана (АоК). Кальциноз АоК степени. Регургитация на АоК 0-1 степени. Увеличение массы миокарда левого желудочка.
Электрокардиография: Синусовый ритм 70 в минуту, нормальное положение электрической оси сердца.
Маммография: Сосудистые кальцинаты обеих молочных желез.
Гистологическое исследование от 21.08.2017: Гистологическая картина наиболее соответствует псевдожелезистому варианту гепатоцеллюлярной карциномы.
Биохимический анализ крови от 15.08.2017: С-реактивный белок – 25 мг/л, аланинаминотрансфераза- 12,5 ЕД/л, аспартатаминотрансфераза – 27,9 ЕД/л, щелочная фосфатаза- 156,6 Ед/л, гаммаглутамилтрансфераза – 88,8 Ед/л, билирубин прямой – 6,2 мкмоль/л, билирубин общий – 17,4 мкмоль/л, альбумин – 42,7 г/л, креатинин – 59,4 мкмоль/л, мочевина – 6,7 ммоль/л, общий белок – 77 г/л, глюкоза – 7,65 ммоль/л.
Антитела к НCV – положительные, HBsAg – не обнаружены.
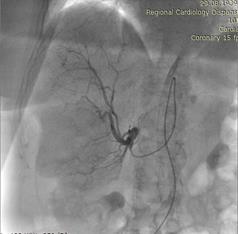
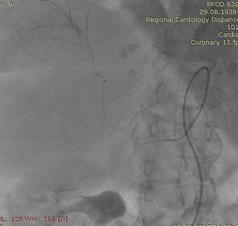
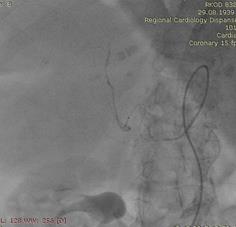
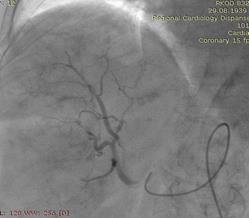
После проведенных обследований был выставлен диагноз: ГЦР печени Т3aN0M0, стадия 3а. Пациентка была направлена на оперативное лечение: ХЭПА гепасферами с доксирубицином 50 мг сначала правой, затем левой печеночной артерии.
Через 6 недель выполнена химиоэмболизация левой печеночной артерии аналогичным способом.
Выполнена контрольная КТ ОБП от 05.12.17: В структуре печени сохраняются множественные диффузные гиподенсные очаги (№15-20), более в правой доле печени – с наличием массивного узла в С5, С6, С8 сегментах размерами 102х70 мм, округлой овальной формы (Рис.6).
Рентгенэндоваскулярная химиоэмболизация артерий печени является методом выбора лечения больных с неоперабельным ГЦР и характеризуется малой инвазивностью, высокой селективностью воздействия и низкой печеночной и системной токсичностью. Данный метод позволяет добиться стабилизации или регресса опухолевого процесса, а также улучшить показатели выживаемости пациентов с нерезектабельным первичным раком печени.
Химиоэмболизация печени
Химиоэмболизация печени (называемая также трансартериальной химиоэмболизацией — ТАХЭ) — важная часть комплексного лечения рака, позволяющая приостановить рост раковой опухоли. В ходе процедуры сосуды, снабжающие кровью опухоль в печени, блокируются, в результате чего питание злокачественного образования прекращается. В результате опухоль уменьшается в размере или регрессирует. При этом химиопрепараты доставляются непосредственно к очагу патологии.
Преимущества химиоэмболизации печени
В отличие от традиционной внутривенной доставки цитостатиков, химиоэмболизация имеет ряд неоспоримых преимуществ, благодаря которым лечение оказывается более эффективным.
Методика используется не только при лечении первичного очага, активно применяется химиоэмболизация и при метастазах печени, в том числе множественных, при рецидиве после резекции печени, при больших размерах образования, когда другие методы невозможны.
В случае, если единственной возможностью избавления от опухоли является трансплантация, то химиоэмболизация позволяет продлить жизнь пациента, ожидающего процедуру. Хотя ТАХЭ относится к методам вспомогательного лечения, в сочетании с химиотерапией, облучением, радиочастотной абляцией или операцией, она позволяет увеличить продолжительность жизни пациентов. При неоперабельном раке ТАХЭ позволяет увеличить продолжительность жизни, 2/3 пациентов смогут прожить более 3-х лет.
Как проводится процедура
Для доставки препарата к очагу патологии, расположенному в печени, в бедренную артерию вводится катетер, с помощью которого в просвет сосуда, питающего опухоль, поступает химиопрепарат. Затем сосуд закрывается с помощью эмболизирующего средства, после чего начинается контролируемое высвобождение препарата непосредственно в опухоль. Длительность процедуры около 30 минут.
И выявление сосудов, питающих опухоль, и введение препарата осуществляется под контролем рентген-оборудования. Длительность процедуры около 30 минут. Манипуляции выполняются под седацией или кратковременной общей анестезией, поэтому по окончании вмешательства рекомендовано наблюдение в течение суток. Результат оценивается с помощью томографии с использованием контрастного вещества. Обследование назначается через 4 недели после химиоэмболизации. Отсутствие контраста в сосудах свидетельствует о разрушении опухоли. Через 1,5-2 месяца назначается контрольное обследование.
Виды химиоэмболизации
Противопоказания
Возможность проведения химиоэмболизации обговаривается в каждом конкретном случае, поскольку существует ряд противопоказаний. Химиоэмболизация не проводится, если диагностированы:
При имеющихся метастазах в других органах, при опухоли, размеры которой превышают 10 см, при сердечной или легочной недостаточности и других состояниях возможность химиоэмболизации решается индивидуально.
Где сделать химиоэмболизацию печени
Сегодня методика считается одной из эффективных в борьбе с раком как в качестве вспомогательного лечения, так и в виде самостоятельного метода терапии. Химиоэмболизация печени в Москве проводится в лишь в нескольких клиниках. Обращение в специализированную клинику, где используются высокотехнологичные методы лечения, имеется современное оборудование и врачи с многолетним опытом работы, прошедшие стажировку за рубежом, позволяет минимизировать риски при лечении рака, реабилитация проходит гораздо быстрее.
Хэпа печени что это
Версия для слабовидящих
Версия для слабовидящих
А.А. Серегин, зав. отделением рентгенохирургических методов диагностики и лечения
Приволжский окружной медицинский центр Федерального медико-биологического агентства России,
Н. Новгород, 603005, Нижне-Волжская набережная, 2
Обзор посвящен одной из актуальных тем современной онкологии: лечению больных нерезектабельными злокачественными опухолями печени. Подробно рассмотрены возможности и достоинства одного из самых распространенных рентгеноэндоваскулярных методов лечения — транскатетерной имиоэмболизации печеночной артерии. Описаны морфофункциональные основы химиоэмболизации, проведено сравнение свойств наиболее используемых химиоэмболизационных препаратов: Липиодола (масляного химиоэмболизата), насыщаемых микросфер (Hepasphere, Ds Bead). Рассмотрен круг заболеваний и состояний, при которых целесообразно применять химиоэмболизацию печеночной артерии, оценены возможности ее использования в качестве дополнительной терапии. Отмечены осложнения, вызываемые производимыми вмешательствами, предложена собственная классификация основных осложнений. Даны критерии для оценки результатов химиоэмболизации.
Ключевые слова: рентгеноэндоваскулярная химиоэмболизация печеночной артерии; нерезектабельные злокачественные опухоли печени; транскатетерная химиоэмболизация печеночной артерии.
Для контактов: Серегин Андрей Анатольевич, тел. моб. +7 920-061-22-92; e-mail: andreiseregin@yandex.ru
В структуре злокачественных новообразований печени выделяют две основные формы: первичный рак (гепатоцеллюлярный рак, гепатома) и метастатическое поражение. Первичный рак печени в структуре онкологической заболеваемости занимает 6-е место (5,7%) среди всех регистрируемых случаев рака [1–10]. Метастатическое поражение печени по результатам вскрытий наблюдается у 20–70% онкологических больных [1–3, 11, 12–14]. Наиболее частым (более 80%) источником метастазирования является рак ободочной и прямой кишки [4–7, 11–17]. Пятилетняя выживаемость пациентов как с первичным, так и с метастатическим раком крайне низкая и составляет 5–6% [11, 12, 16–22].
Классическая методика лечения больных со злокачественным поражением печени включает следующие этапы: хирургическое удаление первичного опухолевого очага и резекция печени с метастазами, а также системное химиотерапевтическое лечение, направленное на уничтожение или уменьшение объема патологического процесса в печени, в том числе с целью достижения операбельного состояния [11, 12, 17–19, 23–29]. Однако радикальная операция при установлении диагноза первичного рака или метастазирования возможна только у 5–15% больных [11, 12, 21, 22, 25]. Рецидив и/или прогрессирование метастатического поражения после резекции печени наблюдается у 20–60% пациентов, причем только у трети из них возможно выполнение повторной операции [11, 12, 22, 26–31].
Очевидно, что паллиативная химиотерапия требуется более чем 70% больных злокачественными опухолями печени. Однако эффективность системной химиотерапии при неоперабельном поражении не превышает 20–30% при выживаемости 3–4 мес даже при использовании комбинаций нескольких препаратов [17, 18, 22, 26, 28, 29]. По всей видимости, при внутривенном введении химиопрепаратов терапевтическая концентрация достигается лишь на короткое время и не оказывает необходимого воздействия на опухолевые клетки, а выраженные нарушения детоксикационной функции печени ограничивают применение бόльших доз противоопухолевых средств [16, 18, 22–24, 26, 32–36].
Таким образом, с целью улучшения отдаленных результатов лечения больных нерезектабельными опухолями печени необходимо решить следующие задачи: достичь оптимальной концентрации лекарственного вещества в опухолевом узле, обеспечить длительное нахождения химиопрепарата в очаге, индуцировать ишемический некроз опухоли [37–46].
Одно из решений данной проблемы — внедрение в клиническую практику методики регионарной химиотерапии: рентгеноэндоваскулярной химиоэмболизации печеночной артерии (ХЭПА). Японские ученые r. Yamada с соавт. (1979) — официальные авторы методики — вводили резаную желатиновую губку, насыщенную 10 мг Митомицина С или 20 мг Адриамицина, в питающую опухоль ветвь печеночной артерии при нерезектабельных гепатомах [43, 46]. T. Konno с соавт. (1982) впервые применили Липиодол, который обладает двумя уникальными свойствами: абсорбировать химиопрепараты и накапливаться в опухолях печени, что позволяло с помощью только одной инфузии достигать двойного эффекта — локальной доставки химиопрепарата и временной эмболизации сосудов [47, 48].
Справедливости ради отметим, что имеются более ранние публикации о применении ХЭПА. В 1973 г. французский доктор C. Regensberg с соавт. опубликовал результаты 250 выполненных рентгеноэндоваскулярных эмболизаций печеночных артерий у больных метастазами печени взвесью Кариолизина, гемостатической губки и Тромбовара [49]. Цитостатик Кариолизин оказывал локальное химиотерапевтическое действие, а эмболизация сосудов гемостатической губкой и Тромбоваром приводила к некрозу опухолевого узла. Фактически это было первое документированное клиническое использование метода двойного локального воздействия на опухоль: инфузии химиопрепарата и механической эмболизации артерий, питающих узлы.
Эффективность рентгеноэндоваскулярной ХЭПА обусловлена особенностями кровоснабжения печени и опухолевого узла. Нормальная паренхима печени имеет двойное кровоснабжение: из воротной вены — 70% от общего объема крови, поступающей в печень, из печеночной артерии — 30%. Кровоснабжение опухолевых узлов в основном (до 95%) осуществляется из ветвей печеночной артерии [47, 48, 50]. Такая сосудистая архитектоника позволяет селективно вводить высокие дозы химиопрепарата непосредственно в опухоль, предотвращая или значительно уменьшая его воздействие на здоровые клетки печени [47, 48, 51–53].
Хороший результат процедуры достигается за счет следующих механизмов: селективного введения химиопрепаратов в область поражения, что значительно снижает их системное токсическое влияние; длительного сохранения высокой концентрации и, следовательно, более сильного воздействия лекарственного средства на опухоль за счет прекращения или значительного снижения вымывания препарата из опухоли; повреждения опухоли и развития ее ишемического некроза [43–46, 51–55].
Химиопрепараты вводят с помощью веществ, которые обладают выраженной абсорбирующей способностью — их называют препараты-носители [46, 48, 52, 56–60]. Широкое применение в клинической практике, как было уже сказано выше, получил Липиодол, представляющий собой йодированный сложный эфир, получаемый из масла маковых зерен. Липиодол на длительное время абсорбирует препараты и затем медленно их выделяет, что позволяет доставлять лекарственные средства к опухолевому узлу в высокой концентрации и обеспечивать длительное воздействие непосредственно на пораженную область — так называемая масляная ХЭПА [56, 57, 60–64].
Масляный химиоэмболизат попадает как в опухолевую, так и в здоровую ткани печени. Благодаря наличию мышечного слоя артериальное русло непораженной паренхимы обеспечивает продвижение и быстрое выведение масляного контрастного препарата. Патологические опухолевые сосуды не имеют мышечного слоя, что приводит к длительной задержке химиоэмболизата в опухоли [56, 62, 65, 66]. Для более полной редукции кровотока масляную эмболизацию дополняют механической, используя гемостатическую губку. Прекращение артериального кровотока после введения эмульсии Липиодола с химиопрепаратом увеличивает время нахождения химиопрепарата в области поражения, а также вызывает некроз опухолевого узла [48, 51–53, 67–71].
Следующим этапом развития метода химиоэмболизации было открытие и внедрение в клиническую практику насыщаемых микросфер. В настоящее время известны два типа микросфер: насыщаемые непосредственно перед введением в артериальное русло — Hepasphere (Biosphere Medical Inc., Франция) и так называемые пренасыщенные, т.е. обогащенные химиопрепаратом при их производстве — DC Bead (Biocompatibles, Великобритания) [72–83].
Сверхабсорбирующие Hepasphere представляют собой биосовместимые, гидрофильные (абсорбирующие) нерезорбируемые микросферы, изготовленные из акрилового сополимера, обладают уникальным свойством впитывать жидкости в объемах, в 64 раза превышающих объем микросфер в сухом виде. Размер частиц в сухом виде варьирует от 30 до 200 мкм, в насыщенном виде — от 120 до 800 мкм [72–83].
Микросферы DC Bead изготавливают из полимерного гидрогеля, модифицированного добавлением сульфокислоты, что позволяет методом полимеризации получать сферические частицы различного размера, и насыщают химиопрепаратом доксорубицином непосредственно при производстве [77–80, 82, 83].
При введении микросфер реализуются все вышеперечисленные механизмы процедуры [77, 80–82, 84, 85].
Для монотерапии наиболее часто применяют доксорубицин, иринотекан, Гемзар, для полихимиотерапии целесообразна комбинация доксорубицина, цисплатина и Митомицина, например доксорубицин (или Адриамицин) — 50 мг, циспластин — 100 мг и Митомицин С — 10 мг, которые разводятся в 10 мг водорастворимого контраста и затем эмульгируются в эквивалентном объеме Липиодола [65, 66, 77, 80, 86–101].
К настоящему времени очерчен круг заболеваний и состояний, при которых целесообразно применять ХЭПА: нерезектабельный гепатоцеллюлярный рак, холангиокарцинома, метастазы рака молочной железы, нейроэндокринных опухолей, колоректального рака [52, 56, 61, 71, 77, 86, 90, 102–111].
Также ХЭПА в качестве дополнительной терапии может использоваться до и после радиочастотной абляции [112–117]. Проведение этой процедуры перед операцией у пациентов с резектабельным поражением печени с целью уменьшения кровопотери, предупреждения имплантационных метастазов не рекомендуется [114, 116].
Абсолютными противопоказаниями являются: резектабельная опухоль, диффузный опухолевый процесс, активная системная инфекция, продолжающееся кровотечение, класс Child-Pugh C, лейкопения (количество лейкоцитов менее 1000/мл), протромбиновое время менее 40%, сердечная недостаточность (фракция выброса левого желудочка менее 50%), почечная недостаточность (креатинин более 177 ммоль/л), некорректируемая чувствительность к контрасту, функциональный статус ECOG более 3, энцефалопатия [52, 65, 71, 77, 81, 82, 86, 96, 114, 115, 118–126].
Некоторые авторы переводят сердечную и почечную недостаточность, а также энцефалопатию в разряд относительных противопоказаний [119, 122, 125]. Относительными противопоказаниями некоторые считают и поражение более 50% объема печени, наличие метастазов других локализаций, прорастание опухоли в нижнюю полую вену и правое предсердие, асцит, выраженную тромоцитопению, операцию портокавального анастомоза в анамнезе [82, 86, 126–129].
В группу относительных противопоказаний также отнесены случаи с развитием печеночной недостаточности: повышение общего билирубина более 34,2 мкмоль/л [77, 101–103], а по другим данным, — 50–70 мкмоль/л [71, 73, 82, 84, 130, 131], лактатдегидрогеназы — более 425 ЕД/л [82, 132], пятикратное по сравнению с нормой увеличение уровня аминотрансфераз [130, 133, 134]. Тромбоз портальной вены не считается противопоказанием к выполнению ХЭПА [125, 131, 134–142].
Таким образом, в литературе серьезных противоречий в определении показаний и противопоказаний к применению ХЭПА нет. Прослеживается тенденция к расширению показаний к вмешательству. С появлением новых гепатопротекторов химиоэмболизация начинает использоваться у пациентов с выраженной печеночной недостаточностью [133, 134, 136]. Следует отметить, что показания к использованию микросфер более узкие, чем для масляной химиоэмболизации; авторы объясняют это лишь сутствием достаточной доказательной базы [73, 94, 137–139].
Имея опыт более 500 химиоэмболизаций, при определении показаний мы придерживаемся мнения J. Gates с соавт. (1999), а именно: достаточные функциональные резервы печени (билирубин — не более 70 ммоль/л), гемоглобин — более 80 г/л, отсутствие внепеченочного распространения опухоли, морфологические формы опухоли, при которых химиоэмболизация эффективна [124].
Осложнения вмешательства изучены достаточно хорошо и наблюдаются от 4–7 до 5–10% случаев [143–171]. Большинство авторов не классифицируют осложнения, лишь перечисляя их. Некоторые исследователи разделяют осложнения на сосудистые и несосудистые [143, 145, 147, 153].
Мы выделяем осложнения, связанные с нецелевым экстрапеченочным введением эмболизационного материала: в желудочные артерии (острая язва желудка), желудочно-двенадцатиперстную и поджелудочно-двенадцатиперстную артерии (острый панкреатит), пузырную артерию (острый холецистит), нижнюю диафрагмальную артерию (плеврит, ателектаз легкого), межреберные артерии [143–145, 152–154]. В нашем исследовании острый панкреатит возник у 4 больных, поверхностный некроз слизистой оболочки желудка — у 1. Консервативное лечение привело к значительному улучшению.
Следующая группа — это осложнения, обусловленные токсическим действием химиопрепаратов и контрастного вещества: анемия (2–7%), прогрессирование печеночной недостаточности (4–38%), почечная недостаточность (9%) [143, 147, 148, 150, 151, 155].
Третью группу составляют осложнения, обусловленные манипуляциями на сосудах: обширная гематома в области пункции, формирование ложной аневризмы бедренной артерии, диссекция печеночной артерии проводником или катетером [143, 147]. В нашей практике сосудистые осложнения отмечены в 5,6% случаев. Диссекция интимы печеночной артерии отмечена у 8 пациентов и только в одном случае по этой причине процедура была прекращена.
Остальные осложнения относятся к числу редких: тромбоэмболия легочной артерии при попадании эмболизата в легкие через артериовенозные шунты [156–160], эмболия артерий головного мозга [161–164], спонтанный бактериальный перитонит [143, 147, 149], кровотечение из варикозных вен пищевода вследствие повышения давления в системе портальной вены [147].
Некоторые авторы относят к осложнениям так называемый постэмболизационный синдром: повышение температуры тела, боли в эпигастрии, тошнота, рвота, некоторое усугубление печеночно-клеточной недостаточности. Постэмболизационный синдром развивается у 90–100% больных, длительность его составляет от 2 сут до 3 нед [143, 146, 147, 170–174].
Мы считаем, что это состояние не является осложнением вмешательства, а представляет собой естественное состояние после ХЭПА. Очевидно, все три механизма действия ХЭПА, а также токсическое системное действие противоопухолевого препарата служат причинами его развития. Явления постэмболизационного синдрома успешно купируются симптоматической медикаментозной терапией.
Для оценки результатов ХЭПА чаще других используют критерии RECIST (response Evaluation Criteria in Solid Tumors). Согласно этой схеме, полный или частичный эффект — уменьшение объема опухоли более чем на 25%; стабилизация — уменьшение объема опухоли менее чем на 25% или отсутствие увеличения образования и новых очагов в печени; прогрессирование — увеличение размеров опухоли или появление новых очагов в печени [26, 27, 33].
В последнее время опубликованы результаты 4 крупных рандомизированных испытаний лечения неоперабельных больных [27, 81, 128, 175]. Наиболее впечатляет работа японских ученых под руководством K. Takayasu (2006), охватывающая более 8500 пациентов [128].
В большинстве других исследований получены сопоставимые результаты [175–196]: полный или частичный ответ после третьего и более курсов составляет 43–80% (по собственным наблюдениям — 70,0%), двухлетняя выживаемость — от 31 до 78,8% (по собственным наблюдениям — 52,3%), медиана выживаемости — от 12,6 до 34 мес (по собственным наблюдениям — 22,4 мес) [175, 191–196].
В исследовании PRECISION V (n=212) сравнивались результаты эмболизации пренасыщенными микросферами (группа 1) и масляной химиоэмболизации (группа 2). Полный или частичный ответ наблюдали в группе 1 — у 52% больных, в группе 2 — у 43% [81]. Другие авторы также отмечают некоторое преимущество процедур с эмболизацией микросферами [83, 85, 197–200].
Заключение
Рентгеноэндоваскулярная химиоэмболизация артерий печени является вариантом выбора помощи больным неоперабельным раком печени и благодаря высокой эффективности и относительной безопасности позволяет достигнуть улучшения и стабилизации в 45–75% случаев.
Продолжительный эффект химиоэмболизации обусловлен реализацией трех основных механизмов лечения: создание локально высокой концентрации лекарственного вещества при его селективном введении, длительное нахождение химиопрепарата в очаге и индукция ишемического некроза опухоли.
Использование микросфер приводит к несколько лучшим результатам, чем классическая масляная химиоэмболизация, однако требуется дальнейшее накопление опыта для ответа на вопрос, в каких клинических случаях эмболизация микросферами наиболее эффективна.
Финансирование исследования и конфликт интересов
Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.