Химера что это означает в медицине
Дегенеративные процессы в суставах – простыми словами
Диагноз «артроз» подразумевает дегенеративные процессы в суставах. Что скрывается за этим термином? Какие стадии проходит сустав и что происходит на клеточном уровне? Зная ответы на эти вопросы, можно повлиять на протекание хронического заболевания и избежать осложнений.
Дегенеративные процессы в суставах характерны для каждого первого
В чем отличия между дегенеративными изменениями и поражениями?
Дегенеративные процессы в суставах не всегда опасны. Их разделяют на изменения и поражения:
Дегенеративные поражения могут иметь не одну, а несколько причин, которые накладываются и усиливают друг друга. Например, хрящ может быть генетически неполноценным, сустав может иметь анатомические дефекты или травматические повреждения. Развитию заболевания способствуют перегрузка, воспаление сустава, патология эндокринной системы. Одна или несколько причин запускают механизм разрушения сустава изнутри.
Механизм развития дегенеративных поражений суставов
Функционирование сустава зависит от состояния хрящей. В центре хрящ имеет гиалиновую основу, на периферии он волокнистый. Толщина гиалиновой части – от 1 до 6 мм. Клетки хряща, хондроциты, вырабатывают тоненькие фибриллы, нити, которые переплетаются в разных направлениях и формируют хрящ. Также клетки синтезируют хондрин, жидкость для смазки.
У новорожденного тканевая жидкость хряща включает 75-80 % воды. У взрослого человека в норме – 55-65 %. В период старения, во время дегенеративных изменений в суставах, этот показатель снижается ниже 50 %. В таких условиях развиваются первичные поражения хряща, которые, если ничего не предпринимать, распространяются сначала на суставную капсулу, а затем и дальше.
Главная причина дегенеративных изменений в суставах – дефицит влаги
Поэтапно дегенеративные поражения выглядят так:
Весь процесс отнимает годы. Человек не догадывается о том, что его суставы повреждены и деградируют. На определенных этапах еще можно приостановить разрушения, восстановить водный баланс с помощью протеза синовиальной жидкости. Иногда достаточно увеличить до нормы ежедневное потребление воды. Но, если артроз уже диагностирован, без лечения не обойтись.
Каждый бокал пива вместо стакана чистой воды – еще один шаг к артрозу
3 стадии дегенеративных поражений в суставах
В процессе потери жидкости хрящ высыхает, становится шероховатым и истончается. На его поверхности образуются эрозии и трещины. Вместо гиалиновой ткани возникает волокнистая, отдельные участки гибнут и разрушаются. На периферии формируются костные разрастания клювовидного характера. Волокнистая ткань увеличивается в объемах, стремясь компенсировать гиалиновую.
Страдает и подхрящевая костная пластина, которая на фоне разрушения хряща подвергается повышенным нагрузкам. Процесс разрушения сустава при артрозе голеностопа, плеча или колена – это сложный механизм, который затрагивает все близлежащие структуры:
Завершение дегенеративных поражений – остеофиты
К сожалению, на ранних стадиях обнаружить дегенеративные поражения невозможно, поэтому пациенты отправляются на диагностику при более выраженных симптомах. На прием к ортопеду или ревматологу приходят с жалобами на затрудненное сгибание и разгибание сустава, боль, щелчки, хронический дискомфорт. Чем раньше обнаружены дегенеративные изменения, тем легче их скорректировать и вернуть человека к полноценной жизни.
Голодные химеры: направленный протеолиз в качестве лекарства
Молекула PROTAC одновременно связывает мишень и убиквитинлигазу, которая помечает ее для деградации в протеасоме. Рисунок в полном размере.
Автор
Редакторы
Большинство таргетных препаратов направлено на предотвращение работы белка-мишени путем ингибирования. Новый класс препаратов работает совершенно по другому принципу: он использует клеточную систему деградации белка для того, чтобы уничтожить мишень. PROTAC — протеолиз-таргетированная химера — как мостик связывает белок-мишень с убиквитинлигазой, которая метит его для деградации. Этот класс препаратов открывает новые принципы работы лекарств и мишени, доселе неизвестные. В этой статье спецпроекта о современных лекарствах рассказывается история создания PROTAC’ов и их современное состояние.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
В 1970-х годах в изучении онкологических заболеваний произошел переворот. В 1970 году Питер Фогт и Питер Дюсберг обнаружили трансформирующий фактор вируса саркомы Рауса [1], позже названный v-src. В 1976 году Гарольд Вармус и Майкл Бишоп обнаружили, что в клетках человека есть аналог вирусного src, клеточный ген с-src, который, как оказалось позже, кодирует тирозинкиназу. В последующие годы были идентифицированы и другие онкогены и опухолевые супрессоры: гены, которые контролируют опухолевую трансформацию и прогрессию.
Теперь у исследователей-онкологов появились мишени для направленной терапии и надежда, что можно отойти от токсичных препаратов, которые были единственным доступным средством химиотерапии (в рамка нашего спецпроекта выходила статья о поиске мишеней [2]). В 1980-х годах были предприняты первые попытки ингибировать продукты онкогенов с помощью мышиных антител [3], но такие препараты оказались малоэффективными и вызывали иммунную реакцию. В начале 1990-х случился прорыв [4]: практически одновременно были созданы и одобрены первый киназный ингибитор — иматиниб («Гливек») [5] — и первое антитело — трастузумаб («Герцептин»).
За этим последовал бум ингибиторов киназ и терапевтических антител, в результате которого создали препараты против множества релевантных киназ и поверхностных белков. Однако многие из идентифицированных онкогенов не являются киназами, или даже не обладают ферментативной активностью. Поэтому у них просто нет активного центра, который можно заблокировать низкомолекулярным веществом. Для того чтобы на них воздействовать, приходится использовать сравнительно большие молекулы — ингибиторы белок-белковых взаимодействий (PPI inhibitors), — часто требующие многих сложных методов для подтверждения правильного связывания с мишенью (рентгеноструктурного анализа комплекса, ЯМР и других [6]). Иногда такие мишени оказывались undruggable, то есть не поддающимися воздействию лекарствами.
Жизнь белков внутри клетки сложна и сурова. Как быть, если тебе вручили «черную метку»? На «Биомолекуле» уже немало было сказано про природу этой метки (белка убиквитина): «Вездесущий убиквитин» [8], «“Вездесущий убиквитин” возвращается» [9]; а недавно вышел обзор про протеостаз, передающий весь масштаб жизни и смерти белков: «Война и мир: как устроить белковую жизнь?» [10].
Протеасома
Протеасомную систему деградации открыли в 1970-х годах в лабораториях Аврама Гершко в Хайфе и Ирвина Роуза в Филадельфии. До этих исследований считалось, что белки могут деградировать только неспецифично в лизосомах, без затрат АТФ, несмотря на ряд работ (например Симпсона в 1953-м [11]), показывающих энергозависимую деградацию белков внутри клетки. Гершко и его аспирант Аарон Чехановер обнаружили, что деградация белков осуществляется двумя белковыми комплексами, один из которых деградирует белки (протеасома), а второй помечает их специальными метками, позже идентифицированными как полимеры белка убиквитина [8], направляя их на деградацию. В результате работ этой группы, лаборатории Александра Варшавского и ряда других в 1980-х была полностью идентифицирована система протеасомной деградации.
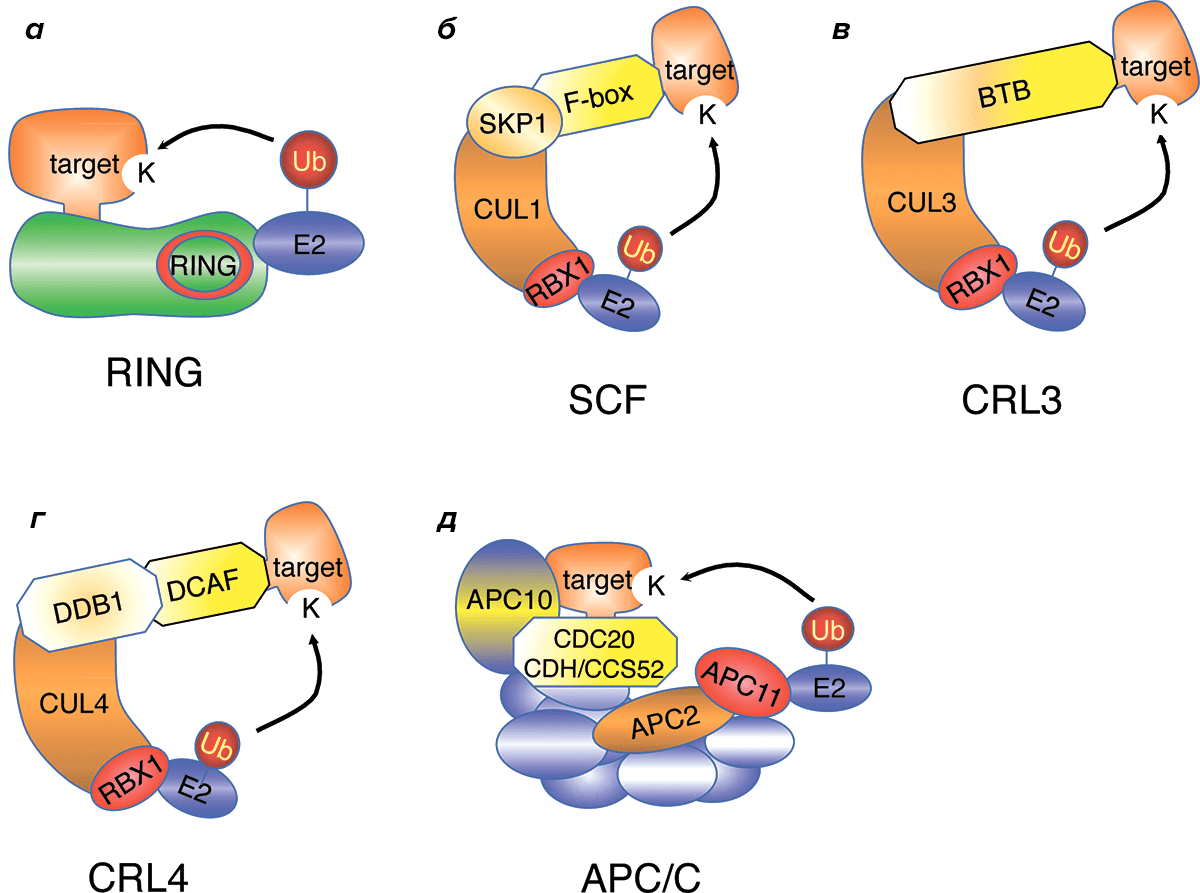
Ключевой частью системы протеасомы выступают ферменты, помечающие белки полиубиквитином. Существуют три группы ферментов, участвующие в этом процессе. E1-ферменты активируют убиквитин и переносят его на убиквитинконъюгирующий фермент E2. Наиболее многочисленны белки E3, которые обеспечивают специфичное связывание комплекса E2 с мишенью для деградации и переносят на нее убиквитиновую метку. Именно их разнообразие позволяет очень точно регулировать время полужизни каждого белка в клетке (рис. 1) [12].
Рисунок 1. Разные классы убиквитинлигаз, вовлеченные в регуляцию клеточного цикла. Мономерные RING-лигазы (а) напрямую связывают убиквитинконъюгирующий фермент E2 и мишень, в то время как SCF/CRL1, CRL3, и CRL4 (б–г) состоят из комплекса скаффолдных белков и RING-белка RBX1. APC/C (д) является огромным мультимерным комплексом, в который входят активирующие белки WD40, RING-доменный белок APC11 и другие.
История PROTAC
В 2001 году группы Реймонда Дешейза и Крейга Крюза придумали, как «натравить» систему протеасомной деградации на новые субстраты. Для этого они создали химерный пептид, состоящий из двух частей:
Получившаяся молекула работала как мостик, который связывал убиквитинлигазу E3 с ее новой мишенью. Исследователи увидели, что молекула не только физически сближает SCFβ-TRCP с новой мишенью, но и обеспечивает ее полиубиквитинилирование, а затем деградацию. Две особенности получившейся молекулы особо ценны:
Статья с описанием работы вышла в PNAS в 2001 году [7], и получившийся класс молекул окрестили PROTAC — proteolysis targeting chimera, или протеолиз-таргетированная химера. Авторы сразу предположили, что PROTAC можно использовать для терапии заболеваний, деградируя белки, участвующие в патогенезе, а также что можно деградировать белки только в определенных клетках и тканях, направляя к ним убиквитинлигазы, которые не синтезируются во всем организме. Однако они также отметили большое ограничение получившейся молекулы — пептидная конструкция не проникает в клетки сама собой.
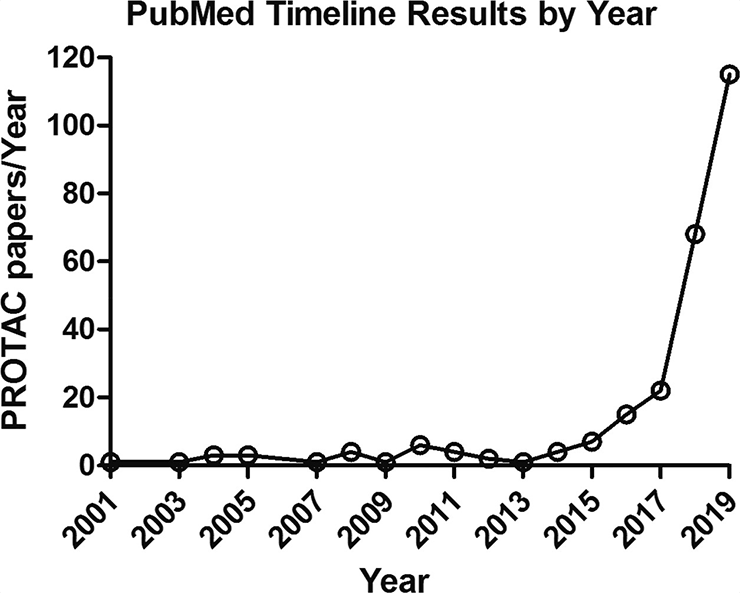
Рисунок 2. Динамика публикаций о PROTAC в Pubmed
Интерес к PROTAC был довольно скромным до 2015 года (рис. 2), однако затем область взорвалась десятками и сотнями статей [13]. Но для этого надо было решить проблему с доставкой в клетку и найти больше молекул, которые могут связывать E3-лигазы. Первый PROTAC, который мог проходить в клетку, был сделан той же парой Дешейза и Крюза, которые использовали пептид из транскрипционного фактора HIF-1α, субстрата E3-убиквитинлигазы VHL, помеченный поли-D-аргинином для проникновения в клетку. Полученный пептид мог направлять андрогеновый рецептор и белок FKBP12 на деградацию.
В лаборатории Крюза решили отойти от использования пептидов, и к 2008 году им удалось создать малую молекулу, которая позволяла деградировать андрогеновый рецептор [14]. Для этого они использовали селективный модулятор андрогеновых рецепторов (SARM), который эффективно связывался с рецептором. Второй частью молекулы был нутлин-3 — вещество, которое разрывало связь p53 c его убиквитинлигазой MDM2, связываясь с последней (рис. 3). Две части соединили ПЭГ-линкером, и получившаяся молекула работала внутри клетки, хотя и с не очень высокой активностью.
Вторым классом E3-лигаз, для которого были найдены низкомолекулярные ингибиторы, стали белки ингибиторы апоптоза IAP и XIAP, у которых также есть убиквитинлигазная активность. Ингибиторы этих белков разрабатывались как антиапоптотические белки, однако их конъюгация с мишенями позволила получить эффективные деградирующие химеры (названные SNIPER [15]).
Коммерциализация и начало клинических испытаний
Молекулы, связывающие убиквитинлигазу VHL, также находились в разработке, и в 2012 году в лаборатории Крюза создали первую малую молекулу, которая могла связывать VHL. В том же 2012 году Крюз основал Arvinas — первую компанию, которая планировала использовать PROTAC в клинике.
Вещества, привлекающие E3-лигазы VHL и CRBN, стали самыми популярными платформами для разработки низкомолекулярных PROTAC. В течение нескольких лет, начиная с 2015 года, были получены PROTAC против эстрогенового рецептора, BCR-ABL, Brd4, разнообразных рецепторных тирозинкиназ и множества других онкологических мишеней. К 2021 году количество описанных PROTAC-молекул увеличилось до 1600, а число мишеней — до 100.
В 2015 году были основаны две другие компании, решившие сделать ставку на использование PROTAC: Kymera Therapeutics и C4 Therapeutics. Рост числа, разнообразия и активности PROTAC привлек внимание крупных фармацевтических компаний: Arvinas заключил партнерские соглашения с Merck и Genentech, C4 — с Roche, а Kymera — с Sanofi.
В 2019 году Arvinas начала первые клинические испытания PROTAC-молекулы ARV110, направленной против того же андрогенового рецептора, в том числе и с мутациями, устойчивыми к имеющимся ингибиторам этого рецептора (например энзалутамиду). Для того чтобы PROTAC достигли клиники, пришлось решить множество проблем с биодоступностью, стабильностью и другими параметрами. Огромные молекулы PROTAC нарушали множество устоявшихся правил медицинской химии (такие как правило пяти Липинского), вначале вызывая ужас технологов и сомнения в том, что эти молекулы могут реально работать в организме. Однако все эти проблемы были решены, и к концу 2021 года количество клинических испытаний PROTAC должно увеличиться до 15 [18].
Среди мишеней PROTAC множество популярных онкологических мишеней: упомянутый выше эстрогеновый и андрогеновый рецепторы; эпигенетические белки BRD4 и BRD9, которые считывают гистоновые метки [19]; транскрипционный фактор STAT3 и другие. Один из клинических кандидатов — DT2216, деградирующий антиапоптотический белок Bcl-xL, — иллюстрирует сильные стороны PROTAC по сравнению с обычными ингибиторами: в свое время разработка ингибиторов Bcl-xL приостановилась из-за того, что тромбоциты гибнут при инактивации Bcl-xL. Решение, ставшее возможным с использованием подхода PROTAC, основано на том, что DT2216 таргетирует этот белок к убиквитинлигазе VHL, которая не производится в тромбоцитах.
У молекул PROTAC обнаружились и неожиданные преимущества — они оказались гораздо активнее, чем простые ингибиторы тех же молекул, работая скорее как катализаторы деградации: после того, как мишень деградировала в протеасоме, PROTAC освобождается для нового раунда связывания. Еще одно преимущество — PROTAС, убирая сам белок (а не только его активность), часто влияют на неферментативные функции своих мишеней, например, на стабилизацию комплексов, в которые они входят. Так, опухолевые линии, не чувствительные к ингибиторам BRD9, оказались очень чувствительными к его деградации.
Кроме онкологических, PROTAC разрабатываются и для других заболеваний. В Kymera сосредоточены на мишенях, важных не только для опухолей, но и для иммунной системы, таких как IRAK4 и вышеупомянутый STAT3. У Arvinas есть ряд молекул, направленных на нейродегенеративные заболевания — в разработке находятся молекулы, деградирующие хантингтин, ɑ-синуклеин и тау-белок. В 2019 году вышло несколько работ, показывающих эффективность тау-направленных PROTAC на животных моделях болезни Альцгеймера [20].
К сожалению, первые результаты клинических испытаний ARV110 немного охладили энтузиазм по поводу PROTAC: несмотря на очень впечатляющие результаты в мышиной модели, лишь у двоих из 22 пациентов наблюдалось значительное сокращение объема опухоли, и у части пациентов — отсутствие дальнейшего прогрессирования заболевания. Однако больше половины пациентов (которые прошли множество предыдущих линий терапии) продолжают получать терапию, и окончательные результаты испытания еще не представлены. Другой претензией скептиков PROTAC является то, что для большинства мишеней, против которых показана активность, уже имеются обычные ингибиторы. Пока обещания найти PROTAC для белков, недоступных для «обычных» ингибиторов, остаются невыполненными.
Другие бифункциональные молекулы
Способность молекул PROTAC привлекать к мишени белок, который ранее с ней не связывался, вызвала интерес — можно ли нацеливать другие ферменты на белки-мишени. Прежде всего были получены молекулы, направляющие мишени на другие пути деградации.
Lysosomal-targeting chimera (LYTAC) и MoDE-A являются модифицированными антителами, которые связывают мишень вне клетки и затем поглощаются эндоцитозом, связываясь с рецепторами (CI-M6PR и ASGPR) через линкерную молекулу. Поглощенный таким образом комплекс из антитела и белка-мишени направляется в лизосому.
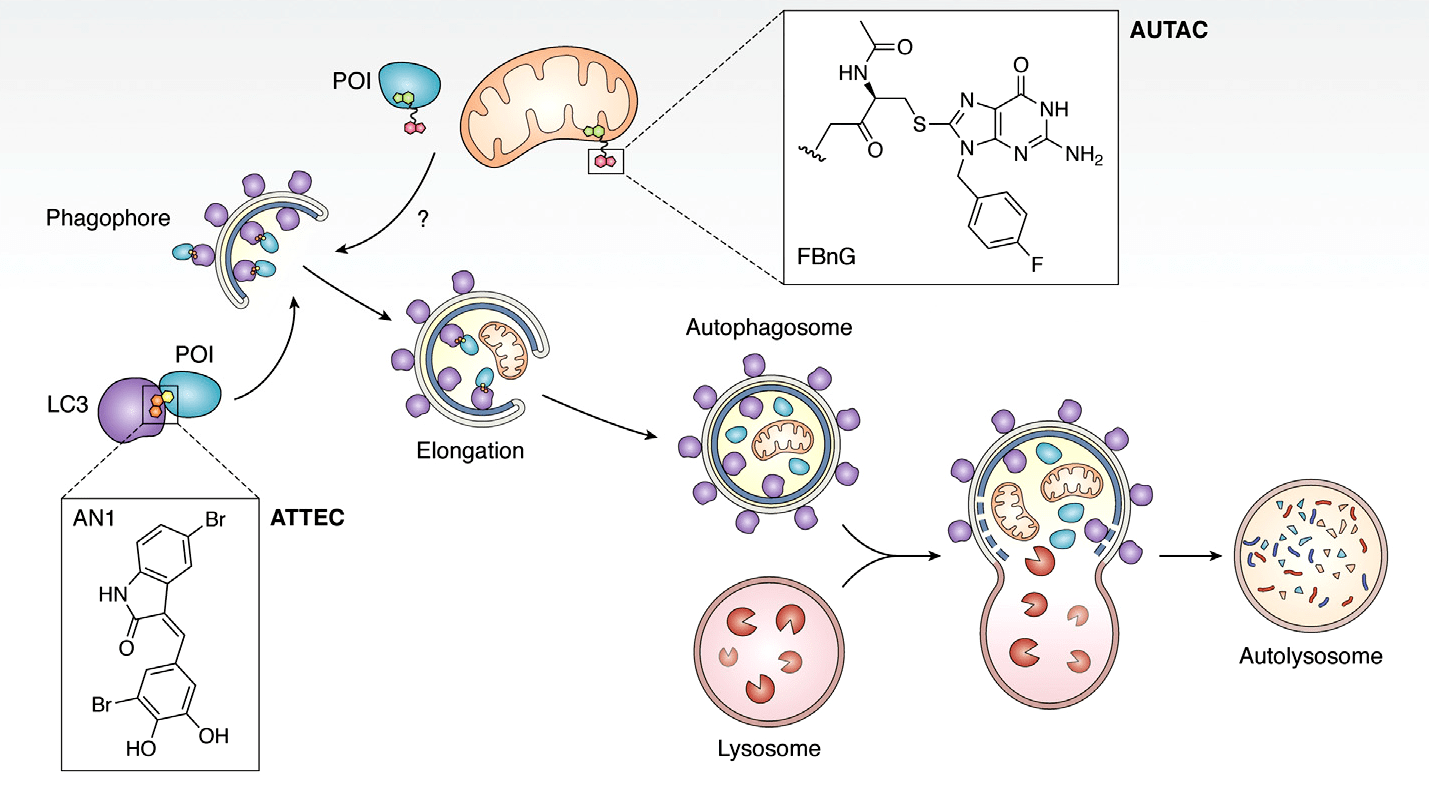
MADTAC-молекулы (macroautophagy degradation targeting chimeras, химера для направленной деградации макроаутофагией) используют еще один путь для деградации — аутофагию [21], [22]: ATTEC-молекулы (autophagosome-tethering compound, соединение, связывающее аутофагосомы) связывают мишень с LC3, компонентом мембраны аутофагосомы, в то время как AUTAC (autophagy-targeting chimera, химера для направленной аутофагии) направляют мишень в аутофагосому с помощью гуаниновой метки по неизвестному механизму [23]. AUTAC-молекулы могут помечать даже целые органеллы (например поврежденные митохондрии) для деградации (рис. 4).
Рисунок 4. Механизмы действия MADTAC (macroautophagy degradation targeting chimeras). ATTEC связывает белок-мишень и компонент аутофагосомы LC3. AUTAC-молекулы содержат гуаниновую метку, которая помечает мишень (в том числе целые органеллы) для включения в аутофагосому.
В 2019 году исследователи из Genentech сделали бифункциональную молекулу, привлекающую фосфатазу к мишени. Получившийся класс назвали PhoRC [24]. Обратный процесс позволяет направить киназы для фосфорилирования новых мишеней (эти вещества названы PHIC [25]). РНК-связывающие лиганды можно совместить с молекулой, привлекающей РНКазу L, получив RIBOTAC [26], [27]. Многие из этих молекул выглядят скорее как научные игрушки, чем клинические кандидаты, но и сами PROTAC вначале не казались похожими на реальные лекарственные молекулы.
Заключение
PROTAC представляет собой одну из удивительных историй успеха современной фармакологии. Всего за 20 лет эти вещества прошли от первоначальной идеи до множества реальных клинических кандидатов. PROTAC создал новую парадигму в медицинской химии, открыв новые принципы воздействия на мишень и существенно расширив горизонты возможного для низкомолекулярных соединений, связанные не только с ингибированием ферментов. И хотя нельзя предсказать, насколько эти молекулы будут клинически эффективны, в ближайшие годы их явно ждет большое будущее.
Партнер спецпроекта — компания Cytiva
1 апреля 2020 г. в результате приобретения подразделения GE Healthcare за 21,4 млрд долларов компанией Danaher Corporation была создана компания Cytiva. Cytiva аккумулировала в себе наследие передовых инноваций и разработок в таких областях, как очистка белка, одноразовые технологии, а также клеточная и генная терапии.
Ведущими брендами Cytiva являются: ÄKTA, Amersham, Biacore, FlexFactory, HyClone, KUBio, MabSelect, Whatman, Xuri, Xcellerex.
Компания Cytiva — номер один в очистке антител.
Cytiva оперирует в 40 странах и регионах, охватывая Европу, Азию, Северную и Латинскую Америки, а также Ближний Восток. Тысячи сотрудников занимаются развитием и ускорением разработки и производства терапевтических препаратов.
Во всем мире используется 100 000 систем компании Cytiva, а также более 60 установок технологических платформ «ФлексФактори».
Cytiva имеет 15 производственных площадок, 11 клиентоориентированных объектов, которые помогут масштабировать процесс от идеи до коммерческого производства, 7 глобальных складов, а также 6 учебных центров.
Ви́дение Cytiva — это мир, в котором доступ к жизненно важным методам лечения трансформирует здоровье человека. Являясь надежным партнером для клиентов различных масштабов и уровней, компания Cytiva повышает эффективность исследований и производственных процессов, обеспечивая разработку, производство и поставку революционных и инновационных препаратов для пациентов.
С использованием технологий Cytiva производится 75% утвержденных FDA биофармпрепаратов.
Посетите наш сайт www.cytivalifesciences.com для получения дополнительной информации.
Материал предоставлен партнёром — компанией Cytiva
Что такое УЗДГ?
УЗДГ или Ультразвуковая допплерография – это метод исследования при помощи ультразвука с использованием эффекта Допплера.
В 1842 году австрийский физик Кристиан Допплер открыл знаменитый физический эффект, названный впоследствии его именем. Эффект универсален для любых волн (звуковых, световых, радиоволн) и позволяет, путем регистрации изменений частотных характеристик волны, определить направление движения и измерить скорость движущегося объекта.
Эффект Допплера сегодня используется повсеместно, в астрономии при наблюдении движения звезд и планет, в радиолокации, сотрудниками ГАИ, нашлось ему место и в медицине.
Эффект Допплера в медицине используется для определения скорости и направления движения крови в кровеносных сосудах и полостях сердца, а также направления и скорости движения стенок сердца при его сокращениях. Эффект применяется при проведении ультразвуковых исследований с использованием ультразвуковых волн диагностического диапазона частот.
Использование эффекта допплера в медицинских ультразвуковых приборах называется УЛЬТРАЗВУКОВАЯ ДОППЛЕГРАФИЯ или УЗДГ.
Существует несколько технологий применения эффекта, это такие способы, как цветовое картирование, когда просвет сосуда окрашивается в разные цвета, в зависимости от свойств потока, и спектральный анализ, когда вычисляются скорости потока крови в разные фазы сердечного цикла, с расчётом рядя диагностических коэффициентов (индексов).
В современных приборах эти технологии объединены, и часто можно слышать термины «дуплексная» или «триплексная» допплерография сосудов, «дуплексное» или «триплексное» сканирование.
Какие существуют методы УЗДГ?
1. УЗДГ стандартно входит в ультразвуковое исследование сердца (Эхокардиография, ЭХОКГ, ЭХО с допплером — синонимы). Позволяет оценить состояние клапанов сердца и кровоток в полостях и крупных сосудах.
2. УЗДГ ветвей дуги аорты (синонимы – УЗДГ сосудов шеи, УЗДГ брахиоцефальных сосудов) — исследование основных артериальных и венозных сосудов, участвующих в кровоснабжении шеи, головы и головного мозга. Это одно из наиболее часто проводимых исследований, позволяет выявлять нарушение проходимости сонных и позвоночных артерий при атеросклерозе, аномалиях сосудов и патологии позвоночника. В качестве дополнительного метода может проводиться так называемая ТКД (транскраниальная допплерография), позволяющая непосредственно оценить кровоснабжение головного мозга.
3. УЗДГ артерий верхних или нижних конечностей. Проводится при нарушениях проходимости периферического артериального русла (атеросклероз, облитерирующий эндартериит, сахарный диабет).
4. УЗДГ вен верхних или нижних конечностей. Проводится при образовании тромбов в периферических венах, а также при варикозной болезни для оценки состоятельности венозных клапанов и определения проходимости вен.
УЗДГ внутрибрюшных и забрюшинных сосудов.
Существует 5 объектов исследования:
1. УЗДГ брюшной аорты и подвздошных артерий – как продолжение УЗДГ артерий нижних конечностей – при атеросклеротических и иных стенозах.
2. УЗДГ нижней полой вены – для диагностики ее тромбозов.
3. УЗДГ висцеральных или непарных ветвей брюшной аорты – исследование сосудов, участвующих в кровоснабжении желудка, поджелудочной железы, 12-перстной кишки, печени и селезенки, а также толстого и тонкого кишечника. Является важным дополнением к УЗИ органов пищеварения для выявления возможного их ишемического поражения.
4. УЗДГ почек – исследование почечных артерий на всем протяжении, от аорты до мельчайших сосудов паренхимы, для диагностики как возможного нарушения проходимости основных сосудов, так и распознавания заболеваний почек. Современная аппаратура позволяет частично использовать технологию при рутинном исследовании почек, для оценки внутрипочечного кровотока.
5. УЗДГ печени – исследование всех систем кровоснабжения печени (артериального и венозного русла) при хронических заболеваниях печени – гепатитах, гепатозе, фиброзе, циррозе, для оценки тяжести поражения.
Помимо перечисленных областей, УЗДГ является либо стандартным, либо важным дополнительных компонентом при исследованиях:
Допплерография также широко применяется во всех стандартных исследованиях при выявлении опухолевых процессов в органах или лимфоузлах, для оценки качества кровотока (кровоток при злокачественных и доброкачественных образованиях различен).
Эффективность и качество полученной при УЗДГ информации в большой мере зависят от уровня подготовки специалиста УЗИ или функциональной диагностики, проводящего УЗДГ и от качества ультразвукового прибора (ряд методик требуют дополнительного оснащения аппарата).
Все перечисленные методики в полном объеме проводятся в Клинике профессора Кинзерского, высококвалифицированными врачами на аппаратуре экспертного и высокого класса. Приглашаем пройти обследование и получить необходимую помощь в нашей клинике.
Статья проверена доктором медицинских наук, профессором Александром Юрьевичем Кинзерским