Химия hgo что это
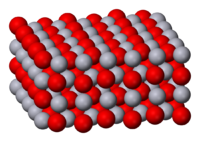
Оксид ртути(II)
| Оксид ртути(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид ртути(II) |
| Химическая формула | HgO |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдые кристаллы оранжевого/красного цвета |
| Отн. молек. масса | 216.5 а. е. м. |
| Молярная масса | 216.59 г/моль г/моль |
| Плотность | около 10 г/см³ |
| Термические свойства | |
| Температура разложения | 500 °C |
| Химические свойства | |
| Растворимость в воде | нерастворим г/100 мл |
| Классификация | |
| Рег. номер CAS | [21908-53-2] |
Оксид ртути(II) — бинарное соединение ртути и кислорода с формулой HgO. Это твёрдое непрочное при нормальных условиях вещество красного или оранжевого цвета является основным и важнейшим оксидом ртути и практически не встречается в природе, за исключением редкого минерала монтроидита.
Содержание
История
В 1774 году с помощью оксида ртути (II) Джозеф Пристли открыл новый химический элемент — кислород.
Получение
Красный оксид ртути получают нагреванием ртути до 350 °C или пиролизом нитрата ртути.

Жёлтый оксид получают осаждением солей ртути(II) щелочами, например:
Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Свойства
Жёлтый HgO является более химически активным, разлагается при температуре 332 o C, при нагревании краснеет. Красный HgO распадается при 500, а при нагревании обратимо меняет свой цвет на чёрный.
Растворяется в концентрированных растворах щелочей, при этом образуются гидроксокомплексы. Жёлтый HgO взаимодействует с NH3 с образованием основания Миллона:
Применяется для получения ртути, а также в некоторых видах гальванических элементов.
Обладает сильным токсическим действием.
Красная ртуть и HgO
В 90-е годы оксид ртути нередко выдавался за несуществующую красную ртуть, так как он действительно красного, скорее ярко-рыжего цвета и содержит ртуть. Во времена «краснортутной лихорадки» фиксировалось немало случаев хищения и продажи этого вещества под видом «красной ртути».
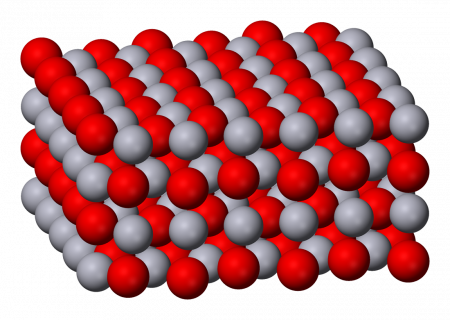
Оксид ртути II
| Оксид ртути II | |
|---|---|
 | |
| Систематическое наименование | Оксид ртути II |
| Хим. формула | HgO |
| Состояние | твёрдые кристаллы оранжевого/красного цвета |
| Молярная масса | 216.59 г/моль г/моль |
| Плотность | около 10 г/см³ |
| Температура | |
| • разложения | 500 °C |
| Энтальпия | |
| • образования | 90,458 кДж/моль |
| Растворимость | |
| • в воде | нерастворим |
| Рег. номер CAS | [21908-53-2] |
| PubChem | 30856 |
| Рег. номер EINECS | 244-654-7 |
| SMILES | |
| RTECS | OW8750000 |
| ChEBI | 81882 |
| Номер ООН | 1641 |
| Предельная концентрация | 0.0003 мг/м3 (в пересчёте на Hg) |
| ЛД50 | 18 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид ртути II — бинарное соединение ртути и кислорода с формулой HgO. Это твёрдое непрочное при нормальных условиях вещество в зависимости от дисперсности красного или оранжевого (жёлтого) цвета является основным и важнейшим оксидом ртути и практически не встречается в природе, за исключением редкого минерала монтроидита. Очень ядовит.
Содержание
История
В 1774 году с помощью оксида ртути II Джозеф Пристли открыл новый химический элемент — кислород.
Получение
Красный оксид ртути получают нагреванием ртути до 300 °C или пиролизом нитрата ртути.
Жёлтый оксид получают осаждением солей ртути II щелочами, например:
HgS + 2 NaOH → HgO ↓ + Na2S + H2O
Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Свойства
Жёлтый HgO является более химически активным, разлагается при температуре 332 o C, при нагревании краснеет. Красный HgO распадается при 500, а при нагревании обратимо меняет свой цвет на чёрный.
Растворяется в концентрированных растворах щелочей, при этом образуются гидроксокомплексы. Жёлтый HgO взаимодействует с NH3 с образованием основания Миллона:
Применяется для получения ртути, а также в некоторых видах гальванических элементов.
Обладает сильным токсическим действием.
Токсикология
Красная ртуть и HgO
В 90-е годы оксид ртути нередко выдавался за несуществующую красную ртуть, так как он действительно красного, скорее ярко-рыжего цвета и содержит ртуть. Во времена «краснортутной лихорадки» фиксировалось немало случаев хищения и продажи этого вещества под видом «красной ртути».
Свойства оксида ртути и реакция ее разложения
Получение оксида ртути на примере опыта
Оксид ртути — это бинарное соединение кислорода и ртути, формула вещества — HgO. При нормальных условиях это твердое непрочное вещество, в зависимости от дисперсности бывает красного или желтого цвета — основной и важнейший оксид ртути. В природе оксид ртути практически не встречается, исключение — редкий минерал монтроидит. В 1774 году ученый Джозеф Пристли с помощью оксида ртути открыл кислород (реакция разложения оксида ртути).
Свойства оксида ртути
HgO желтого цвета — более химически активное вещество, разлагающееся при температуре 332 градусов Цельсия, краснеющее при нагревании. Красный оксид ртути распадается при 500 °С, а при нагревании меняет свой цвет на черный (эта реакция обратимая). Оксид ртути(II) малорастворим в воде и проявляет слабые основные свойства. Растворяется в концентрированных растворах щелочей, образуя при этом гидроксокомплексы. HgO желтого цвета взаимодействует с NH₃, образуя основания Миллона:
2HgO + NH₃ → [Hg₂N]OH · H₂O + Q
Это вещество вступает в реакцию с кислотами, образуя соответствующие соли. Применяется для получения ртути, а также используется при изготовлении некоторых видов гальванических элементов. Оксид ртути очень токсичен.
Получение оксида ртути (на примере опыта)
Оксид ртути (II) — полезный реактив, из которого в лабораторных условиях можно получить разнообразные соли ртути, к примеру хлорид или ацетат ртути(II). Ацетат ртути(II) используется в органическом синтезе (например, для получения изопропилата алюминия), а с помощью HgCl₂ можно получить активированную амальгаму магния.
Для проведения опыта потребуется оборудование:
Используемые реактивы:
Техника безопасности во время проведения опыта
Оксиды азота (II) и (IV) ядовиты и канцерогенны, работать с ним необходимо очень осторожно. Соли ртути токсичны для людей и опасны для окружающей среды. Ядовитый нитрат ртути легко всасывается через кожу. Работать необходимо под тягой и с обратным холодильником, так как отходящие газы часто содержат пары ртути, опасные сами по себе.
Процесс синтеза оксида ртути
В пробирке взвешивают 30 г (0,15 моль) ртути. В колбу на 250 мл с обратным холодильником наливают 60 мл (0,9 моль) HNO₃. Пипеткой небольшими порциями ртуть добавляют в кислоту — тут же происходит реакция. Затем снова надевают обратный холодильник. Раствор нагревается и «закипает» от сильного выделения диоксида азота. По мере завершения реакции выделение бурого газа прекращается и раствор в колбе становится бесцветным. Уравнение реакции:
Hg + 4HNO₃ => Hg(NO₃)₂ + 2NO₂ + 2H₂O
Чтобы предотвратить образование нитрата ртути(I), азотную кислоту берут в избытке. Жидкость остывает, и к ней добавляют HCl или NaCl — это проба на наличие ртути(I) Hg₂²⁺. При выпадении осадка Hg₂Cl₂ в растворе присутствует ртуть (I). К раствору необходимо добавить немного азотной кислоты, затем нагреть. При отрицательной пробе на наличие ртути(I) раствор медленно выливают в 250 мл 4М раствора гидроксида натрия. При этом образуется оранжевый осадок оксида ртути(II) HgO, который нужно отфильтровать. Уравнение реакции:
Hg(NO₃)₂ + 2NaOH => HgO + 2NaNO₃ + H₂O
Продукт промывают водой на фильтре и высушивают до постоянной массы в эксикаторе над силикагелем. Выход оксида ртути (II) составляет 32,467 г.
При проведении опытов с оксидом ртути следует строго соблюдать правила техники безопасности. Здесь вы найдете безопасные опыты, которые можно проводить дома.
Обезвреживание отходов ртути
Весь фильтрат и промывные воды собирают в большой стакан, при необходимости реакцию раствора доводят до щелочной и добавляют избыток сульфида натрия. При этом образуется черный сульфид ртути HgS, который можно слить в канализацию.
Запрещено выливать в раковину растворимые соли ртути. Полученный оксид ртути хранится в плотно закрытых банках.
Реакция разложения оксида ртути
Получение кислорода в лабораторных условиях основано на разложении непрочных кислородсодержащих соединений, в частности бертолетовой соли, марганцовокислого калия, перекиси натрия и окиси ртути. При нагревании эти вещества разлагаются с выделением кислорода. Реакцию разложения оксида ртути можно продемонстрировать в опыте.
Чтобы провести такой эксперимент, необходимо взять пробирку из тугоплавкого стекла с согнутым нижним концом (длина 17 см, диаметр 1,5 см, длиной 3 см). В нижний конец насыпают 3—5 г красной окиси ртути. В укрепленную в штативе пробирку в наклонном положении вставляют резиновую пробку с отводной трубкой. По ней выделяющийся при нагревании кислород отводится в кристаллизатор с водой.
При нагревании красной окиси ртути до 500 °С из отводной трубки будет выделяться кислород, а внутренние стенки пробирки покроются капельками. Кислород плохо растворяется в воде, поэтому его собирают, вытесняя воду после полного удаления воздуха из прибора.
После завершения опыта необходимо вынуть отводную трубку из кристаллизатора с водой, погасить горелку и открыть пробку только после полного остывания пробирки (пары ртути очень ядовиты). Вместо пробирки можно использовать реторту с приемником для ртути. Из 10 г красной окиси ртути получают 500 мл кислорода. Уравнение реакции разложения оксида ртути:
Внимание! В эксперименте использованы токсичные и опасные для здоровья вещества. Не пытайтесь повторить этот опыт самостоятельно.
Оксид ртути (II) красная модификация
Товар находится в неверной категории?
Нажмите на ссылку и мы подберем для товара правильную категорию.
Оксид ртути(II) — бинарное соединение ртути и кислорода с формулой HgO. Это твёрдое непрочное при нормальных условиях вещество в зависимости от дисперсности красного или оранжевого (жёлтого) цвета является основным и важнейшим оксидом ртути и практически не встречается в природе, за исключением редкого минерала монтроидита.
Получение
Красный оксид ртути получают нагреванием ртути до 300 °C или пиролизом нитрата ртути.
Жёлтый оксид получают осаждением солей ртути(II) щелочами, например:
Разница в цвете объясняется размером частиц, обе формы имеют одинаковую структуру — цепь линейных звеньев состава O-Hg-O соединённых под углом 108°. Размеры частиц жёлтого оксида ртути составляют до 4 мкм, красной — более 8 мкм.
Свойства
Жёлтый HgO является более химически активным, разлагается при температуре 332 o C, при нагревании краснеет. Красный HgO распадается при 500, а при нагревании обратимо меняет свой цвет на чёрный.
Растворяется в концентрированных растворах щелочей, при этом образуются гидроксокомплексы. Жёлтый HgO взаимодействует с NH3 с образованием основания Миллона:
Применяется для получения ртути, а также в некоторых видах гальванических элементов.
Обладает сильным токсическим действием.
Красная ртуть и HgO
В 90-е годы оксид ртути нередко выдавался за несуществующую красную ртуть, так как он действительно красного, скорее ярко-рыжего цвета и содержитртуть. Во времена «краснортутной лихорадки» фиксировалось немало случаев хищения и продажи этого вещества под видом «красной ртути».
Общие Физические свойства Термические свойства Химические свойства Классификация

















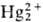 + 2Н2О (+1,065 В)
+ 2Н2О (+1,065 В)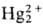 + 4Н2О (+1,279 В)
+ 4Н2О (+1,279 В)