Хирургический край резекции положительный что это значит
Симптомы рецидива рака простаты после радикальной простатэктомии
Причины рецидива рака простаты
Основная причина рецидива рака простаты после радикальной простатэктомии — оставшиеся в организме пораженные клетки, которые в активном состоянии способны к неконтролируемому размножению.
Как в организме остаются злокачественные клетки? В первую очередь, это отдалённые вторичные очаги — метастазы, которые в момент проведения оперативного вмешательства присутствуют в организме. Они распространяются как в ткани ближайших органов (семенные пузырьки, тазовые лимфоузлы, шейку мочевого пузыря, кишечник), так и в печень, легкие, кости осевого скелета, органы центральной нервной системы. Рецидив такого вида называют метастатическим.
После операции по удалению простаты может возникнуть локальный рецидив — при образовании позитивного хирургического края, который представляет собой неиссеченные раковые клетки, оставшиеся после удаления опухоли. Позитивный хирургический край может образоваться, когда рак распространяется за капсулу предстательной железы или при низком качестве оперативного вмешательства.
Факторы прогноза местного рецидива рака простаты после РПЭ
Прогрессирование рака простаты после радикальной простатэктомии происходит крайне медленно и практически бессимптомно. Риск развития рецидива определяют по совокупности биомаркеров: уровню сывороточного ПСА, плотности ПСА патологоанатомической стадии рака, сумме Глисона, характеру хирургического края, объему удаленной опухоли, лимфоваскулярной и периневральной инвазии. Общепризнанным фактором прогноза рецидива также является предоперационный уровень ПСА в сочетании со степенью распространенности рака.
Уровень простатспецифического антигена
Исследования C.R. Pound в 1999 году показали, что все без исключения случаи рецидива рака простаты сопровождаются повышением уровня простатического специфического антигена (ПСА) — протеина, вырабатываемого клетками предстательной железы. В течение 2-3 недель сразу после успешного проведения радикальной простатэктомии у подавляющего большинства пациентов уровень ПСА снижается до пороговых значений.
Любой рост уровня антигена и его отличная от нуля величина могут быть индикатором локального или отдаленного рецидива рака. Поэтому оценку уровня рекомендуется проводить через 3 и 6 месяцев после операции, затем в течение первых трех лет после РПЭ — через каждые полгода, в дальнейшем — 1 раз год.
Однако если после удаления опухоли остался позитивный хирургический край, уровень ПСА также может незначительно повышаться, при этом другие клинические признаки опухолевого процесса отсутствуют.
На сегодняшний день пороговым значением неблагоприятного прогноза, которое может свидетельствовать о наступлении рецидива рака простаты после радикальной простатэктомии, считается повышение ПСА до 0,2 нг/мл и более в двух последовательных измерениях. При этом вероятность прогрессирования болезни увеличивается, если скорость роста уровня антигена превышает в год 0,75 нг/мл, а удвоение ПСА наступает за срок менее 10 месяцев. При этом также принимают во внимание плотность ПСА — отношение дооперационного уровня антигена к объему удаленной простаты.
Сумма Глисона
Злокачественные опухоли простаты неоднородны. Для оценки структурной дифференцировки злокачественного образования используется сумма Глисона. Она определяется в результате сложения приведенных к пятибалльной шкале результатов гистологического исследования двух участков пораженной железы и позволяет оценить степень прогрессирования опухоли. Минимальный риск развития рецидива у пациентов с локализованной формой рака при показателе Глисона 6, максимальный — при значении от 8 до 10.
Характер хирургического края
При «чистых» краях резекции прогноз развития рецидива минимален, он составляет не более 16%. В то время как при позитивном хирургическом крае — 26%. Уменьшить риск образования позитивного хирургического края позволяет радикальная робот-ассистированная простатэктомия Да Винчи. Система роботической хирургии предоставляет хирургу 3D-изображение и 20-кратное увеличение оперируемой области, что позволяет полностью удалить пораженные ткани.
Совокупность вышеперечисленных факторов, а также объем удаленной опухоли более 4 куб. см, лимфоваскулярная и периневральная инвазия и стадия рака от Т2а и выше увеличивают риск возникновения местного рецидива рака простаты после радикальной простатэктомии.
Диагностические исследования
При возрастании уровня ПСА после РПЭ для уточнения диагноза на ранних стадиях развития рецидива используют современные методы визуализации.
Проведение компьютерной и магнитно-резонансной томографии рекомендуется пациентам с повышенным уровнем сывороточного ПСА, а также при жалобах на боли в костях (независимо от уровня ПСА).
Методы лечения рецидива
Локализованная форма
Пациентам с высоким риском рецидива может быть рекомендовано проведение адъювантной лучевой терапии сразу после операции. Облучению подвергают ложе удаленной предстательной железы и регионарные лимфатические узлы. Полный курс лечения длится около 7 недель, сессии облучения — ежедневно.
Метастатический рецидив
На стадии рака T3a-bN0/1M0 после РПЭ при низкой распространенности процесса для предотвращения рецидива рекомендовано применение лучевой терапии в комбинации с курсом андрогенной депривации. Пациентам с тяжелыми сопутствующими заболеваниями может быть назначена гормональная терапия или комбинация гормональной и химиотерапии.
Выбор метода лечения для каждого пациента определяется индивидуально в зависимости от стадии заболевания, группы риска, размера опухоли, значений биомаркеров.
Конференция «Опухоли половых органов у мужчин»
Часть II
Доклад был завершен демонстрацией видеосюжета, иллюстрирующего технику выполнения нервосберегающей РПЭ, с комментариями профессора В.Б.Матвеева
Затем с очередным докладом выступил профессор Б.Я.АЛЕКСЕЕВ, рассмотревший проблему радикальной простатэктомии при местнораспространенном раке предстательной железы с расширенной тазовой ЛАЭ. Борис Яковлевич заострил внимание присутствующих на особенностях проведения расширенной тазовой ЛАЭ при стадии Т3а.
В ряде исследований (Steinberg et al., 1987; Hun et al., 2001; Bader et al., 2003) было показано, что безметастатическая выживаемость после РПЭ у больных pN+ достигает: 5-летняя 83%, а 10-летняя 60%.
В 2005 году были опубликованы данные сразу двух исследований, касающихся изучения эффективности РПЭ при N+ в зависимости от числа метастазов. Так, Daneshmand et al. было показано, что 10-летняя безметастатическая выживаемость при обнаружении 15% метастатических лимфоузлов – 26,5%.
На сегодня позиция ведущих европейских клиник в отношении пациентов среднего и высокого риска сводится к необходимости выполнения расширенной лимфодиссекции. В связи с этим профессор Алексеев привел данные за и против проведения расширенной ТЛАЭ. Так, по данным Heidenreich et al., 2004; Bader et al., 2004, в пользу расширенной лимфодиссекции свидетельствуют: увеличение числа удаленных ЛУ до 21-28; увеличение частоты выявления лимфогенных метастазов до 23-26%; выявление метастазов в ЛУ за пределами границ стандартной ТЛАЭ (42-59%), а также небольшая частота осложнений (2-8,7%).
С другой стороны, Clark et al., 2003; Briganti et al., 2006, считают, что не получено различий в частоте выявления метастазов в ЛУ при стандартной и расширенной ТЛАЭ, и что расширенная ТЛАЭ приводит к большему числу осложнений (19,8% vs 8,2%).
Профессор Алексеев привел результаты ретроспективного анализа выполненных в клинике МНИОИ более 150 операций РПЭ с точки зрения числа удаленных лимфатических узлов и лимфогенных метастазов при стандартной и расширенно ТЛАЭ. Оказалось, что при проведении стандартной ТЛАЭ число удаленных ЛУ составляло 3-26 (11,6 ± 4,6), а метастазов – 14 (8,6%); при проведении расширенной ТЛАЭ эти показатели были соответственно 7-33 (17,7 ± 7) и 10 (19,6%) (р = 0,2). Локализация метастазов только внутри зон стандартной ТЛАЭ составила 20%, только вне зон стандартной ТЛАЭ – 30%, а в 50% случаев они выявлялись и внутри и вне этих зон.
Докладчик привел данные исследователей о влиянии объема ТЛАЭ на выживаемость. Так, было показано снижение риска прогрессирования РПЖ на 10,5% у больных pN0 с числом ЛУ > 15 vs Таблица: Частота осложнений после ПрРПЭ и ПлРПЭ (%)
Было подчеркнуто, что риск опухолевой прогрессии значительно выше при апикальном позитивном хирургической крае. По данным различных авторов, сравнение ПрРПЭ и ПлРПЭ по частоте позитивных хирургических краев и уровню биохимических рецидивов не показывает достоверных различий.
Докладчик привел данные об опыте клиники ВМА (2006 г.), начитывающем 15 операций ПрРПЭ+ ЛТЛАЭ, в т.ч. у 5 пациентов с ПСА > 10 нг/мл (таблица).
| Проанализированные показатели | ПрРПЭ | ПлРПЭ |
|---|---|---|
| Среднее время операции, ч. | 2.5 | 3 |
| Средний срок госпитализации, сут. | 10 | 12 |
| Повреждения прямой кишки | 1 из 15 | 3 из 332 |
| Средняя кровопотеря, мл | 580 | 670 |
Хотя по этим данным, среднее время операций ненамного отличается, в лучших европейских клиниках при РПЭ оно не превышает 1,5 часа, что делает этот метод весьма популярным и конкурирующим с лапароскопическими.
Таким образом, при выборе варианта хирургической тактики – ПрРПЭ или ПлРПЭ – следует учитывать, главным образом, объем ПЖ и опыт хирурга.
Далее слово было предоставлено доктору медицины А.БАХМАНУ из Университетской клиники Базеля, который в своем совместном с доктором медицины Ю. ЦУМБЕ из Леверкузена представил своим российским коллегам особенности выполнения лапароскопической РПЭ.
Как справедливо заметил в начале своего выступления доктор Александр Бахман, трудно поверить, что лапароскопические методы впервые были внедрены в эту области хирургии всего лишь 9 лет назад. На протяжении всего этого периода ведутся дискуссии о преимуществах и недостатках этого метода малоинвазивной техники, как и относительно преимуществ и недостатков ПрРПЭ. Тем не менее, работа ведущих клиник свидетельствует о возможности достижения стабильно высоких результатов при использовании этих техник.
Таким образом, при том, что открытая РПЭ сегодня считается стандартом лечения РПЖ, различные альтернативные методики имеют полное право на жизнь. РПЭ сегодня принято разделять на открытую, промежностную и эндоскопическую. Последняя в свою очередь подразделяется на лапароскопическую, трансперитонеальную и экстраперитонеальную. В последнее время немало разговоров о технике да Винчи, которая на самом деле представляет собой не какую-то новую технику, а комбинацию открытой и эндоскопической простатэктомии.
Подходы к использованию лапароскопических методов для РПЭ появились еще в 1992 году, однако разработчики этой техники смогли предложить ее реальные варианты только через 6 лет. До этого продолжительность операций достигала 12-13 часов, что неприемлемо для клинической практики. При этом наблюдалась значительная кровопотеря, поэтому американские хирурги пришли к выводу, что хотя теоретически выполнение таких операций возможно, практически это пока нецелесообразно.
Работа французских специалистов позволила сократить продолжительность лапароскопических операций РПЭ до 3-4 часов, что позволило приблизить этот метод к реальности. Постепенно начался переход к лапароскопическому доступу, причем основанием для продолжения дискуссии между приверженцами трансперитонеального и экстраперитонеального доступа служило то, что оба доступа обеспечивали примерное равенство результатов по большинству показателей, независимо от стадии опухолевого процесса. Большинство склонилось к тому выводу, что предпочтительным следует считать тот метод, которым лучше владеет данный хирург.
Экстраперитонеальный доступ является предпочтительным у пациентов с абдоминальным ожирением и индексом массы тела более 35, с абдоминальными операциями в анамнезе, а также с точки зрения меньшей продолжительности операции.
Докладчик указал на то, что существуют разные точки на правомерность отнесения лапароскопической техники к категории миниинвазивных, тем не менее, он показал, что по ряду параметров, характеризующих уровень хирургического стресса это отнесения является обоснованным.
Доктор А.Бахман привел ряд данных, характеризующих практику использования лапароскопической техники РПЭ восемью хирургами в клиниках Базеля (n = 550) и Леверкузена (n = 1200) за период 2001-07 гг. Он отметил, что за это время техника проведения операций непрерывно совершенствовалась, выявлялись и использовались ее новые преимущества.
Средняя продолжительность операции составляет 236 минут, проведение расширенной ЛАЭ увеличивает ее продолжительность на 40-60 мин., а выполнение нервосберегающей методики – на 10-20 мин. Средний возраст пациентов составляет 64 года, уровень ПСА 9,8 нг/мл, объем простаты – 60 мл. Объем кровопотери составлял в среднем 450 мл. ЛАЭ выполнена 54% пациентов, нервосберегающие операции – 51% пациентов.
Как правило, на 3-й день после операции проводится цистография, катетер удаляется в среднем через 5-6 дней, в 12% случаев возникает необходимость в повторном введении катетера. Средняя продолжительность госпитализации составляет 8,6 дня.
Распределение пациентов по стадиям выглядело следующим образом: рТ0 – 0,2%; рТ1 – 0,2%; рТ2 – 60%; рТ3 – 23%; прочие – 17%. Позитивный хирургический край имел место в 21% случаев, особенно при стадии рТ3, что говорит о больших перспективах для улучшения результатов.
Докладчик указал на такое важное преимущество лапароскопической техники, как уменьшение объема кровопотерь, что привело к потребности в гемотрансфузиях лишь в 1% интраоперационно и 4% постоперационно. Эти данные соответствуют приведенным в публикациях других авторов.
Число случаев конверсии не превысило 3%, низким был процент осложнений (9%), около 1% пациентов потребовалось повторное оперативное вмешательство.
Д-р А.Бахман опроверг утверждения о том, что лапароскопические операции сопровождаются большим процентом онкологических осложнений: по данным авторитетных авторов, он составляет 0,1-0,18%. При этом частота выявления метастазов была тем выше, чем выше стадия опухолевого процесса. Частота выявления «позитивного края» составляла 12,7% при стадии рТ2, при стадии рТ3а она возрастала до 36,4%, а при стадии рТ3b – 50%.
Анализ темпов рецидивирования процесса по данным ПСА показывает, что к 3 годам после операции рецидивы имеют место у 94,9% пациентов, что требует проведения соответствующей терапии.
Докладчик также прокомментировал некоторые функциональные результаты лапароскопической РПЭ, в частности инконтиненции, потенции. Практика показывает, что врачи часто дают здесь более высокую оценку результатов, чем сами пациенты. В течение первых 4-6 недель происходит значительное снижение континентности, как и при открытой РПЭ, однако в последующий период до 3 месяцев после операции наблюдается значительное улучшение. Таким образом, в срок 3-6 месяцев после операции подавляющая часть пациентов контролируют свой сфинктер, тогда как еще до операции 25% пациентов предъявляли жалобы на отсутствие такого контроля.
А.Бахман представил аудитории медицинскую карту больного, которому производится лапароскопическая РПЭ.
Доктор Бахман представил коллегам видеофрагменты, демонстрирующие технику выполнения лапароскопической РПЭ, и прокомментировал их основные позиции.
Далее состоялся разбор клинических случаев хирургического лечения локализованного рака ПЖ, который провел профессор Б.Я.АЛЕКСЕЕВ.
Клинический случай 1. Больной М., 65 лет. При обследовании выявлено повышение ПСА до 12 нг/мл. Выполнена многоточковая биопсия ПЖ. Гистологически верифицирована аденокарцинома 6 (3+3) баллов по шкале Глисона. Пациент соматически сохранен. По данным ТРУЗИ и МРТ малого таза в правой доле ПЖ определяется узловой образование размерами 1,2 х 0,9 см без признаков нарушения капсулы железы. Объем ПЖ 72 мл. По данным комплексного исследования регионарных и отдаленных метастазов другой очаговой патологии не выявлено.
Данные интерактивного голосования по дальнейшей тактике лечения: дистанционная ЛТ на область ПЖ – 0%; ДЛТ на область ПЖ и зон регионарного лимфооттока – 0%; брахитерапия ПЖ – 5%; гормональная терапия в режиме МАБ – 0%; РПЭ – 94%.
Больному предложена ДЛТ на область ПЖ или РПЭ, он предпочел РПЭ. При гистологическом исследовании препарата после позадилонной РПЭ верифицирована аденокарцинома обеих долей ПЖ 7 (3+4) баллов по шкале Глисона без выходя за пределы капсулы железы. В одном из 17 удаленных лимфатических узлов выявлен микрометастаз аденокарциномы диаметром 3 мм без выхода за пределы капсулы узла.
Данные интерактивного голосования по дальнейшей тактике лечения: гормональная терапия в режиме МАБ – 5% (кстати, это метод, подтвержденный методами доказательной медицины); гормональная терапия агонистами ЛГРГ – 0%; динамическое наблюдение, контроль ПСА – 94%; ДЛТ на зоны лимфооттока – 0%; хирургическая кастрация (билатеральная орхэктомия) – 0%.
Выбрана выжидательная тактика. В течение года уровень ПСА оставался Таблица: Адъювантная ДЛТ (рандомизированные исследования)
| Тактика | До лечения | 6 недель | 2 года | 5 лет |
|---|---|---|---|---|
| Наблюдение | 47 | 43 | 41 | 49 |
| ЛТ | 53 | 71 | 46 | 49 |
| р | 0.72 | 0.0004 | 0.45 | 0.1 |
Проводя параллели с другими заболеваниями, такими как рак молочной железы (уменьшение местных рецидивов на 47% после резекции молочной железы), рак толстой кишки, рак языка, рак слюнных желез, при которых адъювантная ДЛТ улучшает результаты лечения больных, докладчик показал, что в этом плане рак простаты не отличается от других онкологических заболеваний.
Завершая свое выступление, профессор В.Б.Матвеев еще раз привел аргументы «за» адъювантную ДЛТ у больных с «+» краем: «+» край влияет на результаты лечения; токсичность адъювантной ЛТ низкая; она создает оптимальные условия для получения максимального лечебного эффекта, что подтверждается результатами нерандомизированных и рандомизированных исследований, а также параллелями с другими заболеваниями.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Рак предстательной железы: диагностика и результаты хирургического лечения локализованных и местнораспространенных форм
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Военно-медицинская академия, Санкт-Петербург
Р ак предстательной железы (РПЖ) является большой социальной и медицинской проблемой. В 1999 г. в США было зарегистрировано более 179 тыс новых случаев РПЖ и 37 тыс человек умерло от РПЖ [2]. РПЖ является самым частым злокачественным новообразованием, встречающимся у мужчин в США, занимает второе место в списке смертей от рака и составляет 29% среди всех диагностированных новообразований. В России сведения противоречивы из–за отсутствия скрининговых программ. Введение подобных программ в США и других странах привело к повышению числа выявляемых случаев РПЖ, которые можно лечить радикально [4].
РПЖ характеризуется непредсказуемостью клинического течения. Некоторые опухоли остаются латентными многие годы, а некоторые быстро прогрессируют в некурабельные метастатические заболевания [13]. Лечение пациентов с локализованным РПЖ является центральным вопросом для практикующих урологов. В течение 10 лет увеличилась не только частота РПЖ, но и возросли возможности различных способов лечения. В настоящее время пациент и его врач могут выбирать между хирургическим лечением – радикальной простатэктомией (РПЭ), наружной лучевой терапией, брахитерапией, криоаблацией, андрогенной блокадой и комбинацией этих методов.
| Безрецидивная выживаемость после РПЭ у пациентов с негативными хирургическими краями составляет 80%. |
Наиболее частым выбором радикального лечения у мужчин с локализованным РПЖ являются РПЭ или лучевая терапия. РПЭ выбирают 30–60% пациентов с клинически локализованным РПЖ, и тем самым они получают шанс излечиться. К сожалению, от 29 до 59% клинически локализованных опухолей, удаляемых посредством РПЭ, имеют экстрапростатическое распространение при послеоперационном изучении и не могут быть излечены полностью одной лишь РПЭ. Необнаруженная экстракапсулярная опухолевая экстензия может привести к ее неполному иссечению и повышает риск рецидивирования [5].
Диагностика и стадирование РПЖ
Современные методы локального стадирования включают пальцевое ректальное исследование (ПРИ), определение простатического специфического антигена (ПСА), трансректальное УЗИ, секстантную биопсию, компьютерное аксиальное сканирование и эндоректальное ядерно–магнитнорезонансное (ЯМР) исследование. Недостаточная чувствительность этих методов приводит к недооценке стадии почти в 50% случаев.
Первое исследование, анализирующее края резекции при РПЭ, было опубликовано в 1983 г. Однако многочисленные материалы трудносопоставимы среди клиник, так как представлены бригадами с различной техникой и в разные периоды. Примерно половина мужчин, подвергшихся РПЭ при клинически локализованном РПЖ, имели экстракапсулярную экстензию при патоморфологическом изучении. При этом 5,9% имели позитивные л/узлы, 7,8% – метастазы, 15,6% вовлечение семенных пузырьков [1].
Частота позитивных краев (ПК) при РПЭ варьирует от 16 до 46%. Совершенно очевидно, что главную роль в этих вариациях играют:
• различие в хирургической технике;
• метод подготовки образцов удаленной ПЖ.
В развитых странах происходит существенное изменение структуры пациентов. С 1988 по 1992 гг. только 1,4% кандидатов для РПЭ имели Т1с (непальпируемое заболевание, выявленное при биопсии). В последний год, по данным клиники Johns Hopkins, 46% мужчин имели Т1с. Эти изменения нехарактерны для России, так как, по данным клиники урологии Военно–медицинской академии, 87% пациентов имеют пальпаторные изменения на момент выполнения биопсии простаты (стадия Т2а и более). Непальпируемая опухоль ассоциируется с низкой патологической стадией, малой частотой ПК и меньшим объемом опухоли в сравнении с пальпируемой. Это, как правило, сочетается с более благоприятными исходами.
Традиционными показаниями для РПЭ являются:
• клинически локализованные формы РПЖ Т1b; T1с; T2, в некоторых случаях Т3;
• ожидаемая продолжительность жизни более 10 лет;
• возраст не более 70–72 лет.
Технические различия в выполнении РПЭ
Снижение позитивных хирургических краев может быть обусловлено модификацией хирургической техники. Термин «анатомический подход при РПЭ», заменяется на «нервосохраняющий». Эти изменения в номенклатуре показывают, что решение сохранить или резецировать заднелатеральные сосудисто–нервные пучки (СНП) принимается индивидуально от случая к случаю и основано на пред– и интраоперационных находках. Техника широкого иссечения СНП не была частью стандартной РПЭ. С дальнейшим улучшением понимания перипростатической анатомии стала возможной более тщательная и точная диссекция апикальной части простаты, что уменьшило вероятность позитивного края на этой стороне.
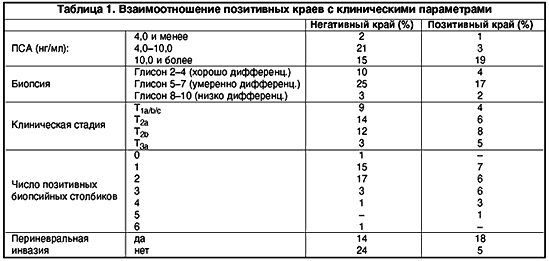
В настоящее время анатомический подход к РПЭ предлагается пациентам с пальпируемыми латеральными очагами, частично в апексе железы, выявленными в предоперационном периоде. В этих случаях прибегают к широкому иссечению одного или обоих СНП. Все мужчины, которые не были потентны до операции, также подвергаются широкой эксцизии обоих СНП. У пациентов с протяженной капсулярной пенетрацией, широкое иссечение СНП ассоциируется с низкой вероятностью позитивных краев в сравнении со случаями, когда эта процедура не выполнялась. По данным клиники Baylor, позитивный хирургический край наиболее часто встречается заднелатерально, в области СНП. Поэтому они модифицировали хирургическую технику и начали резецировать весь или часть СНП более часто. Это привело к снижению частоты ПК на протяжении 1987–90 гг. с 24% до 19%. Опасным является дополнительное иссечение и удаление тканей апикальной области, так как оно приводит к увеличению риска послеоперационного недержания мочи. В клинике урологии ВМА при выполнении 61 радикальной простатэктомии, техника операции (би– или монолатеральное сохранение СНП и пубопростатических связок, объем апикальной резекции) определялась в соответствии с предварительными биопсийными находками. При нахождении злокачественных клеток в двух биопсийных столбиках одной доли, один из которых был выполнен опухолью на всем протяжении, СНП на стороне поражения иссекался. При локализации опухолевых клеток в 3–х биопсийных столбиках производили билатеральное иссечение пучков. Материалы предоперационной биопсии сопоставляли с патологическими находками при изучении удаленной предстательной железы. Частота экстракапсулярной экстензии и позитивных хирургических краев возрастала с увеличением числа позитивных биопсийных столбиков и объема опухолевых клеток в них (табл. 1.)
Влияние ПК на прогрессию РПЖ после РПЭ
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Безрецидивная выживаемость для пациентов с негативными хирургическими краями составляет 80%. У пациентов с ПК – от 42 до 64% в течение 5 лет. Только два института имеют 10–летние наблюдения. У пациентов с негативными краями из клиники Hopkins – 74,8% в сравнении с 41,9% у пациентов с ПК. Данные из клиники Duke свидетельствуют о 10–летней безрецидивной выживаемости у 38%.
Расхождения между ПК и прогрессией
1. Негативный край и степень злокачественности низка;
2. Позитивный край или степень злокачественности высока;
3. Сочетание ПК и высокой степени злокачественности.
Биохимический и клинический рецидивы после РПЭ
Неудачное радикальное лечение определяется биохимически, как повышенный уровень сывороточного ПСА (> 0,25 нг/мл) при локальном рецидиве или дистантном метастазировании. Биохимический рецидив может быть результатом неполного иссечения опухоли или ростом микрометастазов. В серии Partin et al. вероятность рецидива была прямопропорциональна повышению клинической и биохимической стадии, предоперационному уровню ПСА и сумме Глисона. При ПСА > 10нг/мл частота рецидивирования была 44% в сравнении с 17% при ПСА от 4 до 10нг/мл. Предикторами рецидива являются истинная патологическая стадия, вовлечение ЛУ и семенных пузырьков, сумма Глисона при биопсии, сывороточный ПСА и клиническая стадия при пальцевом ректальном исследовании. Они могут быть использованы для определения вероятности рецидивирования после РПЭ или отбора пациентов для адъювантной терапии [12].
Пациентов после РПЭ можно распределить по прогнозу на 3 группы:
1. Плохой прогноз – вовлечение семенных пузырьков или лимфоузлов или обширная экстракапсулярная пенетрация с суммой Глисона >7;
2. Умеренный – орган-ограниченный рак или незначительная экстракапсулярная пенетрация с суммой Глисона 7 или обширная экстракапсулярная пенетрация с суммой Глисона 6;
Современная хирургическая техника дает возможность полностью удалять экстракапсулярные формы РПЖ у пациентов в стадии Т3N0M0, а также выделять пациентов группы риска, которым при необходимости может назначаться адъювантная терапия [9].
Низкое соотношение метастазирования в ЛУ показывает, что рост опухоли в этой стадии еще длительное время ограничен и поэтому может быть локально излечен. В литературе описывается зависимость частоты поражения ЛУ от объема опухоли и степени ее дифференцировки. При этом отмечают, что подавляющее большинство опухолей в стадии Т3 перед операцией относят к Т2.
Следует остановиться и на комбинированных методах лечения. Так, в клинике Mayo сравнивали равноценные группы пациентов после РПЭ в сочетании с орхэктомией и после одной лишь орхэктомии. С 1967 г. по 1995 г. было оценено 1110 пациентов с позитивными ЛУ. Достигнута общая выживаемость более 10 лет для комбинированной группы (66 ±6%) в сравнении с орхэктомией (28 ±6%). Раковоспецифическая выживаемость в первой группе была выше (79 ±5%), чем в группе с орхэктомией (39 ±7%). Это ретроспективное исследование пациентов в стадии рТХN+ подтверждает, что РПЭ с ранней адъювантной орхэктомией обеспечивает существенные достижения в общей и раковоспецифической выживаемости в сравнении с одной лишь орхэктомией [8].
Теоретически хирургическая циторедукция, уменьшая объем опухоли, делает системную терапию более эффективной. В комбинации РПЭ с андрогенной аблацией 5- и 10–летняя выживаемость без прогрессии составила 80 и 76% соответственно [4]. Исследования позволили сделать вывод, что первичное локальное лечение (РПЭ) приводит к существенному увеличению выживаемости пациентов в сравнении с нелеченными подобным образом.
Эти сообщения указывают на возможность и целесообразность применения активной хирургической тактики как для «традиционных» стадий РПЖ – Т1–Т2, так и в отношении местнораспространенных процессов без вовлечения лимфоузлов (Т3N0M0). Этот опыт особенно бесценен и убедителен у молодых пациентов. Наши результаты подтверждают, что РПЭ является безопасной операцией у тщательно отобранных пациентов при наличии опытной хирургической команды. Кроме того, текущие исследования, возможно, позволят рационально использовать новые методы лечения, такие как использование аутовакцин и дендритных клеток, усиливающие циторедуктивный эффект. Окончательный же ответ на вопрос, показана ли РПЖ и при Т3, может быть дан после очень длительного наблюдения.
1. Brewster S.F., Oxley J.D., Trivella M., Abbott C.D. Preoperative p53, bcl – 2, CD44 and e–cadherin immunohistochemistry as predictors of biochemical relapse after radical prostatectomy. // J.Urol. – 1999. – Vol. 161, №4. – Р.1238–1243.]
2. Сadeddu J.A. Partin A.W., Epstein J.I., Walsh P.C. Stade D1 (T1–3, N1–3, Мо) prostate cancer: a case–controlled comparison of concervative treatment versus radical prostatectomy // Urology. – 1997. – Vol. 50.– P.251–256.
3. Carter H.B. Is sextant prostate biopsy the standard of care in the PSA era. // AUA NEWS. – September/October 1999. – Vol. – 4, – Number 5.
4. Catalona W.J., Partin A.W., Slawin K.M. A multicenter clinical trial evaluation of free PSA in differentiation of prostate cancer from benign disease.// J. Urol., part 2.– 1997.– Vol.157.– P. 111, abstract 434.
5. Editorial: new methods for predicting extracapsular extension before surgery for prostate cancer // J. Urol. – 1999. – Vol. 162, №4. – Р. 1359 – 1360.
6. Epstein J.I., CarMichael M., Walsh P.S. Adenocarcinoma of the prostate invading the seminal vesicle: definition and relation of tumor volume, grade and margins of resection to prognosis// J.Urol.– 1993.– Vol. 149.– P.1040–1046.
7. Garg S., Fortling B., Chadwick D., Robinson M.C., Hamdy F.С. Staging of prostate cancer using 3–dimensional transrectal ultrasound images: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1318 – 1321
8. Ghavamian R., Bergstralh E.J., Blute M.L., Slezak J. Radical retropubic prostatectomy plus orchiectomy versus orchiectomy alone for pTxN + prostate cancer: a matched comparison. // J.Urol. – 1999. – Vol. 161, №4. – Р.1223–1228.
9. Gilliland F.D., Hoffman R.M., Hamilton A., Albertsen P., Eley J.W., Harlan L., Stanford J.L., Hunt W.C., Potosky A. Predicting extracapsular extension of prostate cancer in men treated with radical prostatectomy: results from the population based prostate cancer outcomes study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1341 – 1345.
10. Perrotti M., Han K–R., Epstein R E., Kennedy E C., Rabbani F., Badani K., Pantuck A. J., Weiss R. E., Cummings K.B. Prospective evaluation of endorectal magnetic resonance imaging to detect tumor foci in men with prior negative prostatic biopsy: a pilot study // J. Urol. – 1999. – Vol. 162, №4. – Р. 1314–1317.
11. Pound C.R., Сhristens–Barry O.W., Gurganus R.Т., Partin A.W., Walsh Р.С. Digital rectal examination and imaging studies are unnecessary in men with undetectable prostate specific antigen following radical prostatectomy // J. Urol. – 1999. – Vol. 162, №4. – Р. 1337 – 1340.
12. Richie J.P. Screening for prostate cancer. Why the controversy? // Сontemporary Urology. – 1998. – Vol. 10, №7. – P. 26 – 38.
13. Walsh P.С. Detectable PSA after surgery for prostate cancer: what I tell my patients. // AUA NEWS – September / October 1999. – Р. 25.