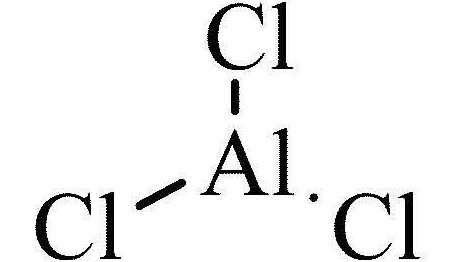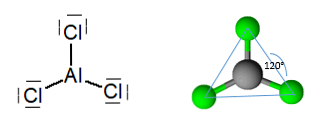Хлорид алюминия что это
Хлорид алюминия
| Хлорид алюминия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | трихлоралюмин, трихлоралюминий, алюминия трихлорид |
| Традиционные названия | хлористый алюминий |
| Химическая формула | AlCl3 |
| Физические свойства | |
| Состояние (ст. усл.) | белые или бледно-желтые гигроскопичные твердые тела |
| Молярная масса | (ангидрид) 133.34 г/моль |
(гексагидрат) 241.43 г/моль
(гексагидрат) 1.3 г/см³
(80 °C) 48.6 г/100 мл (100 °C) 49 г/100 мл
гексагидрат; крысы, орально: 3311 мг/кг
Хлорид алюминия (хлористый алюминий) — соль алюминия и соляной кислоты. Химическая формула — AlCl3.
Свойства
При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O при 25 °C); вследствие гидролиза дымит во влажном воздухе, выделяя HCl. Из водных растворов выпадает кристаллогидрат AlCl3· 6H2O — желтовато-белые расплывающиеся кристаллы. Хорошо растворим во многих органических соединениях (в этаноле — 100 г в 100 г спирта при 25 °C, в ацетоне, дихлорэтане, диэтиленгликоле, нитробензоле, тетрахлоруглероде и др.); однако практически не растворяется в бензоле и толуоле.
Получение
Важнейший способ получения хлорида алюминия в промышленности — действие смеси Cl2 и CO на обезвоженный каолин или боксит в шахтных печах:
При температуре в 900 °C трихлорид бора и фосфид алюминия дают на выходе фосфид бора и хлорид алюминия:
Также есть и другие способы получения хлорида алюминия:
Применение
Безводный хлорид алюминия образует продукты присоединения со многими неорганическими (например, NH3, H2S, SO2) и органическими (хлорангидриды кислот, эфиры и др.) веществами, с чем связано важнейшее техническое применение AlCl3 как катализатора при переработке нефти и при органических синтезах (например, реакция Фриделя — Крафтса). Гексагидрат и его растворы используются при очистке сточных вод, обработке древесины, производстве антиперспирантов и пр.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид алюминия» в других словарях:
хлорид алюминия — хлористый аллил, аллилхлорид … Cловарь химических синонимов I
Хлорид алюминия (III) — AlCl3· 6H2O Хлорид алюминия (хлористый алюминий) AlCl3 соль. Свойства Бесцветные кристаллы, плотностью 2,44 г/см³. При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O… … Википедия
Хлорид алюминия(III) — AlCl3· 6H2O Хлорид алюминия (хлористый алюминий) AlCl3 соль. Свойства Бесцветные кристаллы, плотностью 2,44 г/см³. При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O… … Википедия
безводный хлорид алюминия — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN anhydrous aluminum chloride … Справочник технического переводчика
АЛЮМИНИЯ СЕМЕЙСТВО — ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ Внешняя электронная конфигурация у всех элементов подгруппы s2p1, но наличие внутренней электронной структуры типа электронной конфигурации благородного газа у B и Al и… … Энциклопедия Кольера
Хлорид лития — Хлорид лития … Википедия
АЛЮМИНИЯ ГИДРООКИСЬ — ( Аluminii hydroxydum ). Синонимы: Аluminium hydroxydatum, А1uminium hydroxydе. Аморфный рыхлый белый порошок, в воде практически нерастворим и способен образовывать гель; растворим при нагревании в разбавленных кислотах и растворах едких щелочей … Словарь медицинских препаратов
Хлорид брома — Хлорид брома … Википедия
АЛЮМИНИЯ ХЛОРИД — AlCl3, бесцветные кристаллы. Растворяется в воде. Катализатор в органическом синтезе и при переработке нефти, реагент для очистки сточных вод, обработки древесины … Большой Энциклопедический словарь
Хлорид кальция — – CaCL2 (ХК). Самая популярная в мире противоморозная добавка. Отлично растворяется в воде даже при температуре близкой к нулю. Безвреден для человека. Не горюч, не токсичен, не взрывоопасен. Являясь побочным продуктом содового… … Энциклопедия терминов, определений и пояснений строительных материалов
Хлорид алюминия в жизни человека
В данной статье речь пойдет о хлориде алюминия – веществе, широко используемом человеком во множестве областей своей деятельности. Мы рассмотрим основные качественные характеристики данного соединения, способы его получения и другие особенности.
Ознакомление с хлоридом алюминия
Хлорид алюминия – это алюминиевые соли, а также соли масляной кислоты. Его химическая формула – AlCl3. Процесс возгонки начинается при 183 °C в условиях обычного давления. При увеличении давления процесс плавления начинается со 192.6 °C.
В водных растворах образуются кристаллогидраты белого цвета, с желтым оттенком. Хлорид алюминия хорошо растворяется в огромном количестве соединений органического типа, например этаноле, нитробензоле, этиленгликоле и т. д. Процесс растворения в растворах толуола и бензола практически не наблюдается.
Способы получения
Способов получения AlCl3 существует немало. И важнейшим из них является процесс воздействия Cl2 и CO в шахтной печи на обезвоженные бокситы или каолины:
Еще один немаловажный способ получения – это взаимодействие трихлорида бора и фосфида алюминия при температуре, равной девятистам градусам по Цельсию. На выходе этой реакции получаются хлорид алюминия и фосфид бора:
К другим способам получения относятся:
Области применения
Безводный AlCl3 используется в промышленности, чаще всего как катализатор. Он способен образовывать различные продукты в результате соединения с большим количеством неорганических и органических веществ. Собственно, на этом и базируется его основной способ применения в качестве катализатора. Например, при разложении нефти на различные фракции AlCl3 используется в качестве деструктивного катализатора.
В основе процесса алкилирования при его использовании лежит тот факт, что углеводороды ряда этилена начинают полимеризироваться и конденсироваться, образуя более сложные ряды систем. Реакция ацилирования и процесс изомеризации углеводородов парафина также могут протекать под воздействием хлорида алюминия как катализатора в химическом взаимодействии веществ.
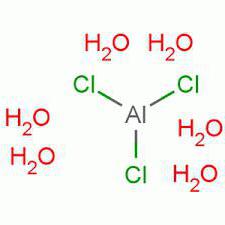
Косметика и хлорид алюминия гексагидрат
Гексагидрат – это производное вещество хлорида алюминия с химической формулой – AlCl3-6H2O. Оно широко используется в косметической промышленности, однако является довольно опасным соединением. Кстати, это один из многих чаще всего используемых компонентов при изготовлении дезодорантов-антиперспирантов. Это связано с тем, что данное вещество довольно дешевое в стоимости, и к тому же оно действительно отлично справляется с ролью борца с потливостью человека.
Хлорид алюминия гексагидрат довольно часто терпит нападки множества регуляторов, так как считается довольно токсичным компонентом. И это в действительности так, но так как он является весьма действенным, в большинстве случаев на его недостаток закрывают глаза. Немалое количество исследований и опытов подтверждают эффективность соединения в борьбе с потоотделением.
Максимальная концентрация данного вещества при изготовлении продукции все еще изучается, так как точная причина ярко выраженной способности к снижению выделения пота пока точно неясна. Если попытаться описать его свойство с точки зрения физического эффекта, то AlCl3-6H2O образует соединения металла нерастворимого типа, которые блокируют потовые протоки и тем самым помогают предотвратить потоотделение на какое-то время.
Алюминия хлорид гексагидрат является одним из компонентов большого спектра товаров для потребителя. Чаще всего он встречается в дезодорантах, а также зубных пастах, помаде и в качестве коллоидного красителя.
В зубной пасте и помадах количество AlCl3-6H2O обычно находится на минимальном уровне, в пределе от сотой процента до десяти, а в красителях доходит до 18 %.
Что такое гексагидрат etiaxil
Хлорид алюминия гексагидрат etiaxil – это одно из важнейших средств в борьбе с гипергидрозом (повышенным потоотделением) подмышек. Данная проблема может возникать у множества людей, особенно задевая чувство комфорта у наиболее чистоплотных. А связано это может быть со множеством причин:
Названное соединение отлично борется с проблемами чрезмерного выделения пота и является очень действенным веществом. Его рекомендуется наносить на сухую и нераздраженную кожу, а перед ночным сном следует смывать, используя мыло. При возникновении раздражения в месте использования необходимо применять кортикоидные мази. Достаточно дважды применить хлорид алюминия гексагидрат, и это даст очень хорошие результаты, дальше его будет достаточно применять около одного раза в неделю.
Гексагидрат хлорида алюминия представляется в виде кристаллов, не имеющих цвета, легко растворимых в растворах спирта, воды, эфиров и глицерина. Соединение является очень гигроскопичным, по этой причине должно сохраняться в сухих местах, без доступа влаги.
Заключение
Надеемся, что наша статья помогла вам разобраться в том, что такое хлорид алюминия. Теперь вы сможете дать исчерпывающую характеристику, перечислить способы получения в промышленности и сферы использования данного вещества. Используя AlCl3 и AlCl3-6H2O, важно помнить, что эти соединения относится к ряду токсичных веществ и по этой причине нужно быть аккуратными в их применении.
Хлорид алюминия(III)
Хлорид алюминия (хлористый алюминий) — AlCl3 — соль.
Свойства
Бесцветные кристаллы, плотностью 2,44 г/см³. При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O при 25 °C); вследствие гидролиза дымит во влажном воздухе, выделяя HCl. Из водных растворов выпадает кристаллогидрат AlCl3· 6H2O — желтовато-белые расплывающиеся кристаллы. Хорошо растворим во многих органических соединениях (в этаноле — 100 г в 100 г спирта при 25 °C, в ацетоне, дихлорэтане, диэтиленгликоле, нитробензоле, тетрахлоруглероде и др.); однако практически не растворяется в бензоле и толуоле.
Получение
Важнейший способ получения хлорида алюминия в промышленности — действие смеси Cl2 и CO на обезвоженный каолин или боксит в шахтных печах:
Также есть и другие способы получения хлорида алюминия(примеры химических реакций):
Применение
Безводный хлорид алюминия образует продукты присоединения со многими неорганическими (например, NH3, H2S, SO2) и органическими (хлорангидриды кислот, эфиры и др.) веществами, с чем связано важнейшее техническое применение AlCl3 как катализатора при переработке нефти и при органических синтезах (например, реакция Фриделя — Крафтса). Гексагидрат и его растворы используются при очистке сточных вод, обработке древесины и пр.
Арсенид алюминия (AlAs) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Бромид алюминия (AlBr3) • Монохлорид алюминия (AlCl) • Хлорид алюминия (AlCl3) • Монофторид алюминия (AlF) • Фторид алюминия (AlF3) • Гидрид алюминия (AlH3) • Иодид алюминия (AlI3) • Нитрид алюминия (AlN) • Нитрат алюминия (Al(NO3)3) • Монооксид алюминия (AlO) • Гидроксид алюминия (Al(OH)3) • Оксинитрид алюминия (AlON) • Фосфид алюминия (AlP) • Фосфат алюминия (AlPO4) • Антимонид алюминия (AlSb) • Молибдат алюминия (Al2(MoO4)3) • Оксид алюминия (Al2O3) • Сульфид алюминия (Al2S3) • Сульфат алюминия (Al2(SO4)3) • Селенид алюминия (Al2Se3) • Силикат алюминия (Алюмосиликаты) (Al2SiO5) • Карбид алюминия (Al4C3)
Полезное
Смотреть что такое «Хлорид алюминия(III)» в других словарях:
Хлорид алюминия (III) — AlCl3· 6H2O Хлорид алюминия (хлористый алюминий) AlCl3 соль. Свойства Бесцветные кристаллы, плотностью 2,44 г/см³. При обычном давлении возгоняется при 183 °C (под давлением плавится при 192,6 °C). В воде хорошо растворим (44,38 г в 100 г H2O… … Википедия
Оксид алюминия(III) — Оксид алюминия Общие Сокращения Корунд Химическая формула Al2O3 Молярная масса 101.96 г/моль … Википедия
Оксид алюминия (III) — Оксид алюминия Общие Сокращения Корунд Химическая формула Al2O3 Молярная масса 101.96 г/моль … Википедия
АЛЮМИНИЯ СЕМЕЙСТВО — ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ Внешняя электронная конфигурация у всех элементов подгруппы s2p1, но наличие внутренней электронной структуры типа электронной конфигурации благородного газа у B и Al и… … Энциклопедия Кольера
Хлорид брома — Хлорид брома … Википедия
Сульфат алюминия-калия — Общие Систематическое наименование Сульфат алюминия калия Традиционные названия Сернокислый алюминий калий Химическая формула KAl(SO4)2 Физические свойства Мо … Википедия
Трифторид алюминия — Трифторид алюминия … Википедия
Сульфат хрома(III)-калия — Общие … Википедия
Фторид хрома(III) — Фторид хрома(III) … Википедия
Сульфат железа(III) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(III) … Википедия
Хлорид алюминия (AlCl3) химическая структура, свойства, использование
хлорид алюминия или трихлорид алюминия (AlCl3бинарная соль, образованная алюминием и хлором. Иногда это выглядит как желтый порошок, потому что он содержит примеси из-за присутствия хлорида железа (III).
Это получается путем объединения его элементов. Алюминий, который имеет три электрона на своем последнем энергетическом уровне (семейство IIIA), имеет тенденцию давать их из-за своего металлического характера. Хлор с семью электронами на последнем энергетическом уровне (семейство VIIA) стремится получить их для завершения своего октета.
Считается, что связь, образованная между алюминием и хлором в трихлориде алюминия, является ковалентной, хотя это соединение между металлом и неметаллом..
Существует два вида хлорида алюминия:
Химическая структура
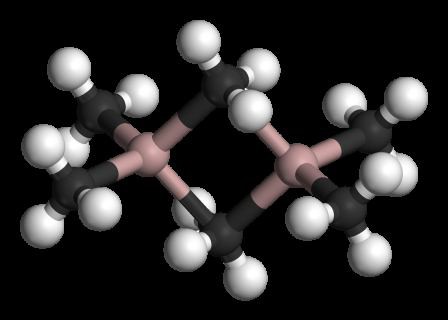
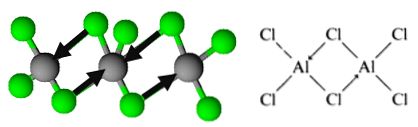
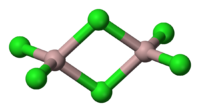
Тем не менее, молекула организована в виде димеры, в котором атом хлора жертвует пару электронов для образования связей. Они известны как скоординированные ковалентные связи.
Так определяется организация димеров трихлорида алюминия..
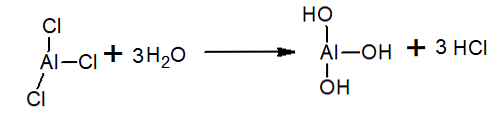
Эта организация позволяет соединению формировать сети димерных слоев. Когда вода наливается на твердый трихлорид алюминия, они не диссоциируют, как ожидается от ионных соединений, но подвергаются интенсивному гидролизу.
Напротив, в разбавленном водном растворе находятся координированные ионы [Al (H).2O)6] +3 и хлорид. Эти структуры очень похожи на диборан.
Таким образом, у вас есть формула Al2Cl6
Если измеряется разница в электроотрицательности атомов, составляющих связи в этом соединении, можно наблюдать следующее:
Согласно правилам теории связи, чтобы соединение было ионным, оно должно иметь разность электроотрицательности атомов, составляющих связь, на величину, большую или равную 1,7 С..
В случае связи Al-Cl разница в электроотрицательности составляет 1,55 ° С, что дает треххлористому алюминию структуру ковалентной связи. Это небольшое значение можно отнести к координированным ковалентным связям, представленным молекулой.
свойства
физическое
внешний вид: белое твердое вещество, иногда желтое из-за примесей, вызванных хлоридом железа
плотность: 2,48 г / мл
Молярная масса: 133,34 г / моль
сублимация: сублимируется при 178 ° C, поэтому температура его плавления и кипения очень низкая.
вождение: плохо проводит электричество.
растворимость: он не растворяется в воде, потому что это кислота Льюиса. Растворим в органических растворителях, таких как бензол, четыреххлористый углерод и хлороформ.
химическая
В воде трихлорид алюминия гидролизуется с образованием HCl, иона гидроксония и гидроксида алюминия:
Он используется в реакциях Фриделя-Крафтса в качестве катализатора (вещество, которое может быть извлечено в конце реакции, потому что оно только в нем, чтобы ускорить, замедлить или инициировать реакцию).
Это едкое вещество.
При разложении, когда он бурно реагирует с водой, образуется оксид алюминия и опасные газы, такие как хлористый водород.
приложений
Риски: возможные последствия
рекомендации
Избегайте воздействия продукта без необходимых мер безопасности. Обязательно используйте, защитные очки, перчатки, соответствующую одежду, накрытую обувь.
В случае контакта с кожей. AlCl3 Это вызывает коррозию. Это может вызвать раздражение или ожоги с покраснением и болью. Вымойте сразу после контакта с большим количеством воды в течение не менее 20 минут. Не нейтрализуйте и не добавляйте вещества, кроме воды. Снять загрязненную одежду и выстирать ее перед повторным использованием. немедленно обратиться к врачу в случае травмы.
При попадании в глаза. AlCl3 Это вызывает коррозию. Это вызывает сильную боль, помутнение зрения и повреждение тканей. Немедленно промойте глаза водой в течение не менее 20 минут и держите веки открытыми, чтобы очистить весь глаз и ткани века. Промывание глаз в считанные секунды необходимо для достижения максимальной эффективности. Если у вас есть контактные линзы, снимите их через первые 5 минут, а затем продолжайте промывать глаза. Проконсультируйтесь с врачом. Это может привести к серьезному повреждению роговицы, конъюнктивы или других частей глаза..
В случае проглатывания. AlCl3 Это вызывает коррозию. Жжение может вызвать боль во рту и пищеводе и ожоги слизистых оболочек. Он может вызывать желудочно-кишечный дискомфорт при болях в животе, тошноте, рвоте и диарее. НЕ вызывать рвоту. Прополощите рот и дайте пить воду. Никогда не давайте ничего в устной форме человеку без сознания. Позвони доктору. Если рвота возникает спонтанно, положите пострадавшего на бок, чтобы снизить риск аспирации..
Люди с имеющимися кожными заболеваниями, проблемами со зрением или нарушениями дыхательной функции могут быть более подвержены воздействию вещества
Упаковка и хранение соединения AlCl3 должно быть сделано в проветриваемых, чистых и сухих местах.