Хорея у детей что это
Хорея у детей что это
Данная группа включает состояния с анатомическими и/или функциональными признаками поражения базальных структур, отвечающих за контроль движений. Изменения могут ограничиваться экстрапирамидной системой или сочетаться с более диффузным поражением или нарушением функций. Аномалии движений являются основным проявлением. Наиболее частым нарушением движений у детей являются тики, но только в некоторых случаях они представляют тяжелые и стойкие патологические изменения. Дистония является наиболее типичным нарушением движений, требующим обследования и лечения (Fernandez-Alvarez и Aicardi, 2001). Акинетико-ригидный синдром редко встречается у детей.
Состояния, при которых отсутствуют определенные патологические признаки поражения базальных ганглиев, но отмечаются аномалии движений (то есть тики, синдром Туретта, тремор, зеркальные движения) кратко описаны в конце данного раздела.
Хорея представлена тремя основными заболеваниями. Острые хореи, в частности, хорея Сиденгама, рассмотрены в отдельных статьях на сайте. В этой сттатье представлены хорея Гентингтона, хорео-акантоз и доброкачественная наследственная хорея. Хорея также может быть проявлением нескольких заболеваний, некоторые из которых поддаются лечению.
а) Хорея Гентингтона. Хорея Гентингтона является генетическим заболеванием, наследуемым по доминантному типу и характеризующимся экстрапирамидными проявлениями, которые могут быть достаточно вариабельными и включают несколько типов аномальных движений, среди которых хорея является классической формой заболевания у взрослых, а гипокинетическо-ригидный синдром — наиболее типичной формой в детском возрасте; также характерна прогрессирующая деменция.
Заболевание связано с распространением повторов тринуклеотида ЦАГ внутри кодирующего региона гена, картированного на дистальном конце 4р хромосомы. Продукт гена (гантингтин) является новым белком с неизвестной функцией. В контрольной группе выявляется менее 30 повторов; среди пациентов с хореей — 36-121 триплетов (в среднем 44) (Kremer et al., 1994). В соответствии с генетическим механизмом отмечается антиципация (прогрессирующее более раннее проявление симптомов в ряду поколений) и связь наследования с полом. Ювенильные формы, в частности ригидная форма, наследуются от отца в 70-90% случаев (Но et al., 2001). Длина повторов тринуклеотида приблизительно в трети случаев существенно увеличивается при наследовании. Отмечается положительная корреляция раннего начала и большей тяжести заболевания. Распространение происходит внутри полиглутаминового пути и приводит к образованию внутриклеточных включений, и в некоторой степени приводит к усилению токсического действия.
Хорея Гентингтона редко встречается в детском возрасте, несмотря на то, что среди населения в целом составляет 1 на 24000, а распространенность — 7,61 на 100000. Частота встречаемости гетерозигот может составлять 1 на 5000. Тем не менее, случаи начала заболевания до 20-летнего возраста составляют только лишь 5-10% от общего числа пациентов. Вероятно, внешние факторы оказывают некоторое влияние на возраст начала и выраженность заболевания (van Dellen и Hannan, 2004).
С точки зрения патологии отмечается выраженная атрофия стриатума, в особенности хвостатого ядра, приводящая к исчезновению нормального выступа головки хвостатого ядра в передние рога желудочков. Также отмечается атрофия лобной коры. Выявляется истощение нейронов, затрагивающее преимущественно мелкие нейроны, являющиеся ГАМК-эргическими, но могут содержать и субстанцию Р и энкефалины. Крупные нейроны, содержащие преимущественно соматостатин или нейропептид Y, поражаются только в тяжелых случаях. Содержание липофусцина в стриатуме повышено, а само вещество уплотнено, в некоторых случаях отмечается дегенерация митохондрий. Снижение количества клеток связано со снижением содержания ГАМК и синтеза ацетилхолина, обнаруживаемого на основании низкого уровня ацетилхолин-трансферазы. Концентрация соматостатина и пептида Y также снижена. Концентрация дофамина внутри стриатума не отличается от нормы, а введение леводопы приводит к усилению хореиформных движений.
В редких случаях заболевание встречается у детей, когда у родителей еще не развились клинические проявления. Из 46 зарегистрированных случаев начала заболевания в детстве средний возраст появления симптомов составил 3-9 лет (Osborne et al., 1982). Наиболее частым проявлением у детей является ригидность, но несмотря на это расстройство интеллекта может предшествовать появлению экстрапирамидных симптомов. По результатам нейропсихологического исследования у взрослых с доклинической стадией заболевания выявляется раннее поражение функций лобной доли. По данным одного из исследований, ригидный ювенильный вариант болезни Гентингтона отмечался у 26 из 46 пациентов, хореиформные движения — у 9 пациентов, а сочетание хореи и ригидности — у 3 пациентов (в обзоре Osborne). Хореиформные движения сходны с проявлениями хореи Сиденгама, тем не менее, они могут затрагивать в большей степени туловище и проксимальную часть конечностей. Дизартрия может быть ранним и преобладающим симптомом и проявлением поражения мозжечка.
Тем не менее, для детского возраста гораздо более типичен паркинсонизм с ригидностью, чем хореиформные движения. Часто заметна двигательная апраксия. Припадки отмечаются у 50% больных детей (Osborne et al., 1982), также описана миоклоническая форма заболевания (Gambardella et al., 2001). На ЭЭГ могут выявляться ритмичные затылочные медленные волны в сочетании со спайками (Ullrich et al., 2004). Биохимические маркеры заболевания отсутствуют, таким образом, диагностика зависит от клинических проявлений и семейного анамнеза.
При визуализации выявляется расширение желудочков с атрофией головки хвостатого ядра. При ригидных формах может отмечается усиление сигнала от стриатума. Изменения МРТ могут быть поздним проявлением, а локализация снижения метаболизма, выявляемая при позитронно-эмиссионной томографии с помощью деоксиглюкозы, является более чувствительным методом обследования (Berent et al., 1988). Выявление распространенности повторов тринуклеотида ЦАГ подтверждает диагноз. Тем не менее, недавно у взрослых были зарегистрированы редкие случаи болезни, подобной болезни Гентингтона (Stevanin et al., 2003). В некоторых случаях избыток тринуклеотида ЦАГ не отмечается (Vuillaume et al., 2000); в других случаях заболевание связано с распространением мутации ЦТГ/ЦАГ (Margolis et al., 2004).
Дифференциальная диагностика включает редкие случаи младенческого паркинсонизма, лекарственную и спонтанную дистонию и аномальные движения, болезнь Халлерфордена-Шпатца, болезнь Вильсона, дистонический липидоз, синдром Леша-Найхана, хорею Сиденгама, стриато-таламическую дегенерацию (Gieron et al., 1995), доброкачественную наследственную хорею и хореоакантоз в молодом или даже подростковом возрасте. Последнее заболевание проявляется как хореиформными движениями, так и периферической нейропатией с амиотрофией нижних конечностей и когнитивными и поведенческими нарушениями. Акантоциты выявляются в крови. В некоторых случаях наследственная хорея без деменции может отмечаться у пациентов с распространением повторов тринуклеотида ЦАГ, что предполагает широкий диапазон фенотипической вариабельности болезни Гентингтона (Britton et al., 1995). Отмечается прогрессирующая атрофия головки хвостатого ядра и аномальный сигнал от лентикулярного ядра. При патологоанатомическом исследовании выявляется атрофия таламуса и стриатума.
Возможна доклиническая и даже пренатальная ДНК диагностика болезни Гентингтона. Данное обстоятельство может быть источником этических проблем, но позволяет родителям принять осознанное решение.
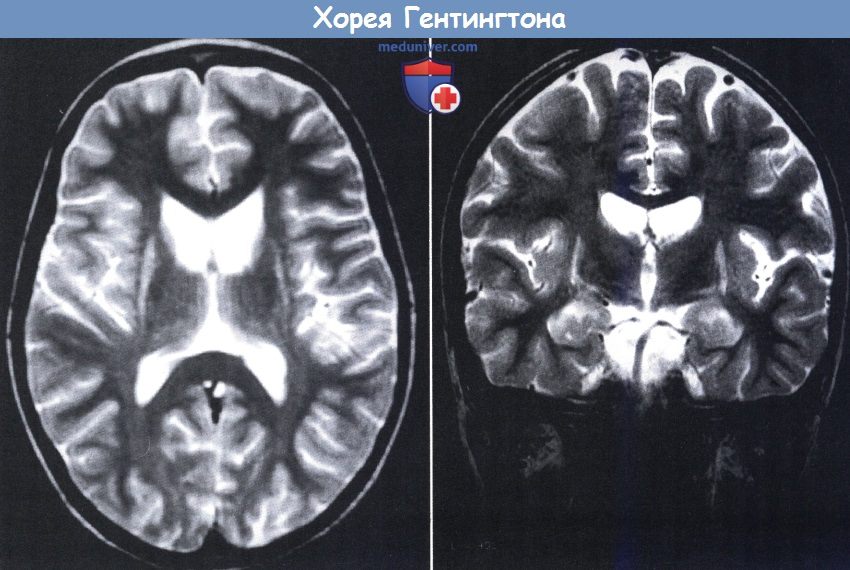
В аксиальной (слева) и фронтальной (справа) проекциях на МРТ видна атрофия хвостатого ядра с результирующим увеличением передних рогов и усилением сигнала от внешней скорлупы.
б) Доброкачественные наследственные хореи. Несколько лет известны очень редкие доброкачественные формы хронической хореи без когнитивной деградации. Заболевания гетерогенны по клиническим и генетическим изменениям (Kleiner- Fisman et al., 2003), таким образом, существование доброкачественной хореи спорно. Отмечаются изолированные хореические движения без когнитивных или неврологических нарушений. Зарегистрировано небольшое число семей с соответствующей клинической картиной изолированной непрогрессирующей хореи, начинающейся в детском возрасте с нормальными когнитивными функциями (Breedveld et al., 2002а); обнаружены мутации гена TITF-1 на 14 хромосоме (Breedveld et al., 2002b). Мутации были выявлены только в 3 из 10 обследованных семей, что свидетельствует о генетической гетерогенности заболевания. Случаи, не связанные с 14 хромосомой, характеризуются более вариабельным фенотипом с дистонией и/или миоклонусом, тремором или нейросенсорной тугоухостью (Wheeler et al., 1993), заболевание может прогрессировать.
Данный вариант течения может представлять собой несколько отдельных заболеваний. В некоторых случаях отмечается тенденция к уменьшению выраженности хореических движений с возрастом, то есть у больных родителей симптомы могут иметь неявный характер. В одной семье зарегистрировано состояние, описанное как «обратная хорея», при котором в первую очередь и в большей степени поражены нижние конечности (Fisher et al., 1979). В некоторых случаях явной доброкачественной хореи отмечается увеличение количества повторов тринуклеотида ЦАГ, сходное с признаками хореи Гентингтона, тем не менее, чаще всего отмечается относительно небольшое число повторов (36-39) (Britton et al., 1995). Такие изменения могут оставаться бессимптомными, но при этом передаваться следующему поколению в более тяжелой форме, поэтому оправдана молекулярная диагностика. Диагноз основан на семейном анамнезе и отсутствии когнитивных нарушений. В целом, лечение не требуется, отмечается тенденция к уменьшению выраженности заболевания с течением времени.
в) Хорея-акантоцитоз (нейроакантоцитоз). Нейроакантоцитоз — генетическое заболевание, относящееся наряду с синдромом МакЛеода, болезнью Гентингтона 2, ассоциированной с пантотенат-киназой нейродегенерацией (PKAN) и абеталипопротеинемией к группе редких заболеваний, характеризующихся наличием в крови шпоровидных эритроцитов (Rampoldi et al., 2002). С неврологической точки зрения часто отмечается поражение базальных ганглиев и периферических нервов в сочетании с дискинезиями, ухудшением когнитивных функций, психиатрическими нарушениями и прогрессирующим течением (Danek et al., 2005). Абеталипопротеинемия относится к группе спиноцеребеллярных атаксий, a PKAN — к дистониям.
Нейроакантоцитоз является редким рецессивным нейродегенеративным заболеванием, поражающим преимущественно взрослых, тем не менее, отмечены случаи болезни у подростков и детей. Заболевание является результатом мутации гена VPS13A, функция которого неизвестна. Основным клиническим проявлением являются нарушения движений, представленные хореей и дистонией; особенно выражено поражение лица и области щек, часто в виде тиков. Часто встречаются дизартрия и дисфагия, когнитивные нарушения и психиатрические проявления, утрата сухожильных рефлексов и другие проявления сенсомоторной нейропатии. Аномалии движений глаз включают частые вертикальные подергивания и медленные гипометрические саккады, в особенности при взоре вверх (Gradstein et al., 2005). Заболевание начинается незаметно, и первые нехарактерные проявления могут предшествовать основным симптомам и развиваться за 2-20 лет до формирования полной клинической картины (Lossos et al., 2005).
Диагноз может быть подтвержден исследованием ДНК и при обнаружении в крови белка хореина (Dobson-Stone et al., 2004). Зарегистрированы также случаи доминантного наследования (Walker et al., 2002).
Неврологический фенотип синдрома МакЛеода сходен с хорея-акантоцитозом, но наследование сцеплено с Х-хромосомой (Danek et al., 2001). Лицевые тики и дизартрия встречаются реже, а кардиомиопатия — чаще, чем при рецессивных формах. Характерным является отсутствие Кх-антигена и низкий уровень антигена Kell в крови. Диагноз подтверждается при выявлении мутации гена YX на Х-хромосоме. В редких случаях возможно появление симптомов у женщин с пораженным геном. Проводится только симптоматическое лечение.
Редактор: Искандер Милевски. Дата публикации: 18.12.2018
Ревматическая хорея (I02)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
В зависимости от степени выраженности основных симптомов хореи выделяют следующие клинические формы заболевания:
К этой же группе относят стертые формы хореи: еле заметные гипeркинезы, иногда тикообразные или дистальные, или клоновидные, неритмичные, нестереотипные.
Продолжительность легких форм заболевания 1,5-2 месяца.
3. Тяжелые формы. Характерные проявления:
— гиперкинeзы распространенные, большие но амплитуде, частые, изнуряющие;
— координация резко нарушена, с трудом выполняются простые волевые движения;
— мышечный тонус значительно снижен;
— большие изменения психики;
— выраженные нарушения вегетативной реактивности.
Продолжительность составляет 4-6-8 месяцев.
Этиология и патогенез
Эпидемиология
Факторы и группы риска
Клиническая картина
Cимптомы, течение
Характерные клинические симптомы малой хореи:
1. Гиперкинезы. Отличаются следующими особенностями: неритмичные, нестереотипные, напоминают произвольные движения, совершаются с легкостью, постоянные. Гиперкинезы усиливаются при выполнении активных движений и во время эмоциональных реакций; становятся слабее в состоянии статического и психического покоя; во время сна прекращаются.
4. Нарушение рефлексов – рефлексы снижены и неравномерны, наблюдается положительный симптом Гордона-2 (при вызывании коленного рефлекса наблюдается более продолжительное, чем у здорового, разгибание голени).
Диагностика
1. Электроэнцефалография – выявляет изменения в биоэлектрической активности мозга.
2. Электромиография для исследования биопотенциалов скелетных мышц. При хорее наблюдается удлинение потенциалов и асинхронность в их возникновении.
3. Компьютерная томография.
4. Магнитно-резонансная томография.
5. Позитронная эмиссионная томография.
Лабораторная диагностика
Дифференциальный диагноз
Наибольшие трудности вызывает дифференциальная диагностика малой хореи в ситуациях, когда она фигурирует в качестве единственного критерия острой ревматической лихорадки. Для исключения иной этиологии гиперкинезов обследование таких больных проводится совместно с невропатологом.
Возможные причины гиперкинезов:
— доброкачественная наследственная хорея;
— хорея Гентингтона;
— гепатоцеребральная дистрофия;
— системная красная волчанка;
— антифосфолипидный синдром;
— тиреотоксикоз;
— гипопаратиреоз;
— гипонатриемия;
— гипокальциемия;
— лекарственные реакции;
— синдром PANDAS.
Ревматическая хорея причины, симптомы, методы лечения и профилактики
Ревматическая хорея или хорея Сиденхема – одно из основных осложнений острой ревматической лихорадки. Оно диагностируется преимущественно у детей в возрасте 6-15 лет. Девочки болеют в 2 раза чаще, чем мальчики. Причиной хореи врачи называют поражение стрептококком группы A базальных ганглиев, располагающихся в глубоких слоях полушарий мозга. Патология сопровождается непроизвольными и хаотичными движениями конечностей и тела.
Причины развития
Хорея Сиденхема может возникать как обострение ревматизма. Иногда она проявляется самостоятельно. В таком случае стрептококковая инфекция сильно сказывается на центральной нервной системе. Позднее у пациента обязательно проявится ревматизм.
На развитие болезни могут влиять такие факторы:
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 13 Декабря 2021 года
Содержание статьи
Симптомы
Клинические признаки нередко нарастают постепенно и незаметно для родителей. Ребенок резко начинает кривляться. Дома и в школе это принимают за шалости. Позже он становится неусидчивым, выкрикивает различные звуки. Со временем у ребенка отмечаются мелкие непроизвольные движения пальцев, а позднее – конечностей. Такие симптомы могут наблюдаться от нескольких дней до недели.
В период манифестации ревматической хореи движения становятся размашистыми и быстрыми, ребенку становится сложно кушать, писать, ходить. Мышечный тонус ослабляется, рот начинает причмокивать, а лицо искажается множеством гримас. Хореические гиперкинезы могут захватывать язык, гортань, лицо, кисти рук, диафрагму.
Иногда ревматическая хорея начинается с судорог, отека диска зрительного нерва, мозжечковой атаксии и пирамидных расстройств.
В тяжелых случаях ребенок не в состоянии стоять на ногах, глотать и говорить, а его тело находится в беспрерывном движении. Не исключены психические расстройства и вегетативная дисфункция.
Разновидности
Согласно МКБ-10 хорея Сиденхема бывает с вовлечением сердца и без такового. По клиническим признаками различают легкие, средней тяжести и тяжелые формы патологии. Они отличаются степенью выраженности гипотонии, непроизвольных двигательных актов и изменений психики.
Диагностика
Для выявления ревматической хореи врач проводит визуальный осмотр. Достаточно стукнуть по колену пациента резиновым молотком. При хорее конечность на некоторое время застывает в выпрямленном положении. Лабораторные методы используют того, чтобы подтвердить активный ревматический процесс в организме. Из дополнительных диагностических методов могут быть назначены электроэнцефалография, компьютерная или магнитно-резонансная томография.
Важно дифференцировать ревматическую хорею от наследственных и приобретенных заболеваний, для которых характерны гиперкинезы. К ним относятся:
Хорея у детей что это
Современные представления о патогенезе, диагностике и лечении малой хореи*
Малая (ревматическая) хорея – одно из основных и, возможно, наиболее загадочных проявлений ревматизма, связанное, как и другие его синдромы, со стрептококковой инфекцией [2]. Малая хорея (МХ) преимущественно возникает в детском возрасте и характеризуется быстрыми неритмичными насильственными движениями с вовлечением мышц лица и конечностей, которые сопровождаются мышечной гипотонией, нарушениями координации, психическими изменениями и вегетативными нарушениями [1, 4].
В последние десятилетия благодаря широкому применению антибиотиков и улучшению социально-экономических условий распространенность МХ, как и других проявлений ревматизма, в развитых странах резко снизилась. Однако высокая заболеваемость ревматизмом сохраняется в развивающихся странах, особенно среди слоев населения с низким социально-экономическим статусом. С конца 1970-х годов в развитых странах вновь стали регистрировать вспышки ревматизма и МХ не только у детей, но и у взрослых [2]. Регулярно встречаются случаи МХ и в нашей стране, но, как показывает опыт работы Центра экстрапирамидных заболеваний Минз драва РФ, их диагностика и лечение нередко встречают существенные трудности.
В настоящее время никто не подвергает сомнению тот факт, что, как и другие проявления ревматизма, МХ возникает вслед за явной или субклинической инфекцией верхних дыхательных путей, вызванной бета-гемолитическим стрептококком группы A. Однако многие вопросы, связанные с происхождением МХ, до сих пор остаются без ответа. Известно, в частности, что стрептококковая инфекция осложняется ревматизмом только в 0,1–2% случаев, а МХ развивается лишь у 6–38% больных, перенесших острую ревматическую лихорадку (ОРЛ). Это может указывать на существование предрасположенности не только к ревматизму, но и к МХ [4, 28]. У значительной части больных с МХ отмечается положительный семейный анамнез как по ревматизму, так и по МХ, что может объясняться как общими средовыми, так и генетическими факторами. В пользу генетической предрасположенности свидетельствует наличие антигена D8/17 на поверхности В-лимфоцитов, выявляемого у большинства больных ревматизмом и значительно реже обнаруживаемого в общей популяции [26].
С другой стороны, гипотеза о существовании предрасположенности к МХ не может объяснить колебаний заболеваемости МХ. Как показывают многолетние наблюдения неврологов в Бразилии, где проблема ревматизма и МХ остается очень острой, в разные годы доля больных с ОРЛ, у которых развивалась МХ, существенно колебалась. В 1920–1950-х годах хорея отмечалась примерно у половины больных, перенесших ОРЛ, в последующие годы этот процент то снижался (до 8,7%), то вновь повышался (до 60%), а затем опять снижался (до 15–26%), вне зависимости от уровня заболеваемости ревматизмом. Эти колебания могут зависеть от того, что разные штаммы стрептококка вызывают МХ с различной вероятностью, хотя нельзя исключить того, что указанные колебания вызваны неинфекционными факторами, участвующими в патогенезе МХ [24].
Долгое время считалось, что в основе МХ лежит церебральный ревмоваскулит. Сторонники этого взгляда существуют и в настоящее время. Так, по мнению Cardoso и соавт. (1997), МХ вызвана васкулитом мелких мозговых сосудов, который может быть связан с продукцией антител к антигенам сосудистой стенки [8]. Тем не менее, по мнению большинства современных исследователей, патогенез МХ связан с продукцией антинейрональных ауто антител к антигенам стриарных нейронов [4, 7, 21, 24].
В 1976 г. Husby и соавт. первыми выявили в сыворотке у 14 из 30 обследованных ими больных с МХ (и лишь у 7 из 50 больных с ревматизмом без хореи) антитела, перекрестно реагирующие с антигенами стрептококковой протоплазменной мембраны и нейроглией хвостатого и субталамического ядер [19]. В последующем аналогичные антитела были обнаружены у больных с МХ и в цереброспинальной жидкости (ЦСЖ).
Почему возникает аутоиммунная реакция против антигенов базальных ганглиев? Наиболее популярна гипотеза так называемой молекулярной мимикрии, предполагающая сходство антигенных детерминант стрептококка и определенных групп нейронов базальных ганглиев, которое ведет к появлению перекрестно реагирующих антител [21, 24]. Иммунологические исследования показывают, что индукция аутоиммунной реакции при ревматизме может быть связана с М-протеином на поверхности стрептококка. Показано, что антитела к определенным эпитопам М-протеина перекрестно реагируют с тканью сердечной мышцы и базальными ганглиями [7, 9]. М-протеин высоковариабелен и служит маркером отдельных серотипов бета-гемолитических стрептококков группы А. Установлено, что лишь некоторые штаммы (серотипы) гемолитического бета-гемолитического стрептококка группы а способны вызывать ОРЛ, кардит или МХ (ревматогенные штаммы), тогда как другие способствуют развитию гломерулонефрита (нефритогенные штаммы). Большинство же серотипов стрептококка, хотя и вызывают фарингеальную инфекцию, неспособны спровоцировать иные осложнения стрептококковой инфекции [25]. Показано, что МХ чаще всего вызывают штаммы М5, М6, М19 и М24 [11].
Согласно другой гипотезе, стрептококковая инфекция приводит к гиперпродукции и нарушению метаболизма некоторых внутриклеточных нейрональных антигенов, утрачивающих недоступность для иммунной системы, что и приводит к срыву толерантности иммунных клеток к нервной системе. Существует также предположение, что стрептококковые антигены действуют как суперантигены, индуцируя воспалительную реакцию и приводя к активизации аутореактивных Т-лимфоцитов и высвобождению избыточного количества провоспалительных цитокинов, что способствует презентации иммунной системе ранее «секвестрированных» антигенов [24].
Хотя наличие антител к антигенам базальных ганглиев практически у 100% пациентов с МХ в остром периоде следует считать доказанным фактом, остается неясным, имеют ли эти аутоантитела патогенный потенциал [4]. Титр антинейрональных антител часто не коррелирует с тяжестью заболевания. Более того, известно, что даже у здоровых лиц сыворотка содержит антитела, способные взаимодействовать с мозговой тканью. Нередко подобные аутоантитела обнаруживаются и у больных с нейродегенеративными заболеваниями, в том числе у 40% больных с болезнью Гентингтона, что, однако, не означает, что иммунологические факторы участвуют в патогенезе этих заболеваний. Более вероятно, что продукция антител провоцируется первичным повреждением мозговой ткани [1, 4]. Это косвенно подтверждается и тем фактом, что антитела к мозговой ткани часто направлены не против поверхностных, а против внутриклеточных антигенов. Тем не менее в последние годы удалось установить, что антитела, перекрестно реагирующие с антигенами стрептококка и мозговой ткани, могут взаимодействовать с лизоганглиозидами на поверхности нейронов [13].
Исключительно важная проблема, связанная с определением роли аутоантител, заключается в том, что циркулирующие в крови антитела неспособны проникать через гематоэнцефалический барьер. Существует предположение, что через барьер могут проникать антигенспецифические В-лимфоциты, которые уже в ЦНС превращаются в плазматические клетки и продуцируют антитела. В пользу этого мнения свидетельствует обнаружение в ЦСЖ олигоклональных антител, что указывает на продукцию антител непосредственно в ЦНС. Однако у части пациентов с МХ олигоклональные антитела в ЦСЖ выявить не удается [21]. Поэтому условием взаимодействия антител с антигенами нервной ткани должно быть повышение проницаемости гематоэнцефалического барьера. Kienzle и соавт. (1991) обнаружили с помощью МРТ с контрастированием признаки нарушения проницаемости гематоэнцефалического барьера именно в области головки хвостатого ядра [20]. Возможно, проникновение антител через гематоэнцефалический барьер облегчается продукцией цитокинов или антителами к клеткам эндотелия и астроцитам.
Если антинейрональные антитела действительно играют решающую роль в патогенезе МХ, остается неясным, вызывают ли они цитотоксический эффект или лишь модулируют активность соответствующих нейронов, а также насколько их действие опосредовано воспалительной реакцией [22]. Ответ на этот вопрос труден в силу того, что морфологический субстрат МХ изучен плохо, поскольку летальные исходы наблюдаются исключительно редко и обычно связаны с сопутствующей сердечной недостаточностью, септицемией, ревмокардитом и другими состояниями, которые способны сами по себе вызвать определенные изменения в ЦНС. Имеющиеся данные указывают на наличие периваскулярной инфильтрации, отека и дистрофических изменений нейронов в базальных ганглиях: хвостатом ядре, скорлупе, субталамическом ядре. Однако неясно, насколько специфичны для МХ эти и другие нередко описываемые изменения (мелкие кровоизлияния, диффузное снижение численности нейронов базальных ганглиев, мозжечка, лобной и височной долей коры больших полушарий, эмболия с милиарными некротическими очагами) [4, 28]. С другой стороны, в некоторых случаях МХ никаких патоморфологических изменений в базальных ганглиях не находят, а описанные выше изменения выявляются и при ОРЛ без МХ [28, 29].
Данные современных методов функциональной нейровизуализации (позитронной эмиссионной томографии, однофотонной эмиссионной томографии), оценивающих метаболизм или перфузию в тех или иных отделах мозга, позволяют по-новому взглянуть на проблему субстрата МХ [23]. В отличие от хореи Гентингтона, нейроакантоцитоза и некоторых других органических заболеваний ЦНС, сопровождающихся развитием хореи, при МХ позитронная эмиссионная томография с [ 18 F]-фтордезоксиглюкозой выявляет не снижение, а повышение метаболизма в области стриатума [19]. Более того, при исследовании в динамике с помощью однофотонной эмиссионной томографии показано, что усиление перфузии в области стриатума регрессирует по мере обратного развития гиперкинеза [23]. Аналогичные изменения выявляются и при других вариантах хореи, связанной с аутоиммунными процессами (в частности, при первичном антифосфолипидном синдроме и системной красной волчанке). Эти данные могут указывать на то, что аутоантитела вызывают не столько гибель определенных популяций нейронов, сколько модуляцию их функциональной активности. Тем не менее нельзя исключить, что выявленные особенности зависят от специфики мишеней патологического процесса. При дегенеративном процессе гибнут основные проекционные нейроны стриатума, при аутоиммунной патологии могут повреждаться другие популяции клеток, в частности вставочные тормозные нейроны или нейроны субталамического ядра, что может приводить к повышенному притоку в полосатое тело афферентных импульсов [19]. При МРТ-морфометрии головного мозга Giedd и соавт. (1995) выявили увеличение объема базальных ганглиев, степень которого уменьшилась (хотя и не до нормального уровня) после проведения плазмафереза [16]. Остается неясным, вызвано ли увеличение объема базальных ганглиев воспалительными изменениями или иным процессом.
Таким образом, завершая обсуждение субстрата МХ, следует заключить, что его можно рассматривать как своеобразный энцефалит или энцефалопатию с иммунопатологическим механизмом развития. Rosenbaum и соавт. (1996) полагают, что МХ являет собой пример очагового неврологического синдрома, возникающего вследствие системного воспалительного заболевания [30]. В любом случае, в результате аутоиммунной реакции нарушается функция подкорково-лобных нейронных кругов, замыкающихся через различные отделы полосатого тела, что приводит не только к развитию гиперкинеза, но и часто сопровождающих его психических нарушений, прежде всего синдрома навязчивых состояний (обсессивно-компульсивного синдрома), синдрома дефицита внимания с гиперактивностью, а также аффективных расстройств (эмоциональной лабильности, тревоги, апатии, депрессии) [25].
Определенную роль в патогенезе МХ играют эндокринные факторы. Об этом свидетельствует тот факт, что среди больных число девочек почти в 2 раза превышает число мальчиков, причем половые различия в заболеваемости проявляются лишь после 10-летнего возраста (другие проявления ревматизма возникают одинаково часто у лиц обоего пола). Возможно, это объясняется способностью эстрогенов и прогестерона повышать чувствительность постсинаптических дофаминовых рецепторов в стриатуме [29].
Насколько стойкими оказываются изменения в базальных ганглиях у пациентов с МХ? Принято считать, что МХ имеет доброкачественный характер: у большинства больных гиперкинез спонтанно регрессирует в течение 1–9 (чаще 3–6) мес. Но в последние годы сообщается об учащении случаев персистирующей МХ, которая сохраняется на протяжении 2 лет и более. Cardoso и соавт. (1999) наблюдали длительное персистирование у половины наблюдавшихся ими за последние 5 лет больных с МХ [9]. Персистирующая МХ чаще отмечалась у больных с кардитом и генерализованной хореей, т.е. при более тяжелом течении заболевания. Но даже в тех случаях, когда хорея в основном регрессировала, у части пациентов стойко сохранялись легкие хореиформные подергивания, тики, тремор, смазанность речи, а также психические изменения в виде астенических, тревожно-депрессивных расстройств, обсессивно-компульсивного синдрома, синдрома дефицита внимания с гиперактивностью и т.д.
Примерно у половины больных, перенесших МХ, в последующие 5 лет развиваются рецидивы. В большинстве таких случаев отмечается только один рецидив, но у небольшой части больных (5–10%) регистрируются два рецидива и более. В среднем рецидивы возникают с интервалами в 1,5–2,5 года. Иногда удается установить связь рецидива с новым эпизодом стрептококковой инфекции, но в большинстве случаев рецидивы возникают спонтанно (как проявление некоего «хореического диатеза»), в том числе на фоне превентивной антибактериальной терапии. Появление или усиление гиперкинеза у больных, перенесших МХ, возможно и при приеме небольших доз лекарственных средств: психостимуляторов, препаратов леводопы, агонистов дофаминовых рецепторов, фенитоина. Как своеобразный рецидив МХ можно рассматривать также хорею беременных и хорею, связанную с применением оральных контрацептивов. В 30–80% случаев такие больные перенесли в детстве МХ. В большинстве подобных случаев возникновение хореи объясняется не активизацией аутоиммунного процесса, а изменением гормонального фона. Появление хореи на 3–5-м месяце беременности совпадает по времени с резким увеличением содержания эстрогенов, способных повышать чувствительность дофаминовых рецепторов [29]. Изредка встречаются случаи, когда у больных, перенесших в детстве МХ, спустя много лет вновь возникает хореический гиперкинез на фоне других заболеваний, таких как полицитемия, тиреотоксикоз, церебральные васкулиты, вирусные инфекции ЦНС, опухоли мозга. При этом течение хореи зависит уже от динамики вновь приобретенного заболевания [4, 8, 28].
Наличие перманентных неврологических и психических нарушений, возникающих в результате МХ, склонность к рецидивированию, возможность возникновения гиперкинеза при приеме лекарственных средств могут свидетельствовать о формировании необратимых изменений в базальных ганглиях. Поскольку методы нейровизуализации чаще всего не выявляют стойких структурных изменений, речь может идти о перманентной дисфункции базальных ганглиев, которую Nausieda и соавт. (1983) определили как «хроническую дофаминергическую гиперчувствительность» [27]. Нельзя исключить и возможности персистирования или рецидивирования аутоиммунного процесса. Но следует отметить, что при персистирующей (хронической) хорее частота выявления антинейрональных антител ниже, чем в остром периоде МХ [11].
Как правило, МХ сопровождается другими клиническими и лабораторными признаками ревматизма (полиартритом, подкожными узелками, лихорадкой, артралгией, повышением СОЭ, положительным C-реактивным белком). Ревматическое поражение сердца обнаруживается у 23–84% больных (применение эхокардиографии в последние годы значительно улучшило выявляемость патологии сердца) [3]. Однако у 5–18% пациентов с МХ даже при тщательном обследовании не удается выявить ни признаков недавней стрептококковой инфекции, ни других проявлений текущего ревматического процесса (так называемая чистая, или простая, хорея). Как по спектру клинических проявлений, так и по их динамике простая хорея аналогична типичной ревматической хорее. Более того, при последующем наблюдении у значительной части пациентов с простой хореей развиваются другие проявления ревматизма, в том числе ревмокардит с исходом в порок сердца. В силу этого простую хорею рассматривают как вариант ревматической хореи, существование которого объясняется трудностями диагностики стертых форм ревматизма, вариабельностью времени манифестации МХ, часто возникающей по прошествии длительного латентного периода (2–6 мес. и более) после стрептококковой инфекции – в «холодном» периоде ревматизма, когда острые воспалительные явления уже «отзвучали», либо после субклинической инфекции [4, 11].
Тем не менее вопрос о том, можно ли все случаи простой хореи относить к ревматизму, следует считать открытым. В последнее десятилетие описан целый спектр неврологических и психиатрических заболеваний, которые возникают в связи со стрептококковой инфекцией и, вероятно, имеют аутоиммунный характер, но не сопровождаются какими-либо иными проявлениями ревматизма и, таким образом, могут рассматриваться как неревматические осложнения стрептококковой инфекции. К ним относятся случаи синдрома навязчивых состояний (обсессивно-компульсивного синдрома), дефицита внимания с гиперактивностью и тиком (так называемое педиатрическое аутоиммунное нейропсихиатрическое расстройство, связанное со стрептококковой инфекцией, сокращенно PANDAS – от англ. Paediatric Autoimmune Neuropsychiatric Disorder Associated with Streptococcal infection), генерализованной или сегментарной миоклонии, пароксизмального некинезиогенного хореоатетоза и даже летаргического энцефалита с развитием паркинсонизма, аффективных нарушений, обсессивно-компульсивного синдрома [6, 12–14, 31]. Общими особенностями этих заболеваний является острое или подострое начало после недавней клинически или лабораторно подтвержденной инфекции бета-гемолитического стрептококка группы A, волнообразное течение с резкими обострениями и последующими полными или частичными ремиссиями. Клиническая специфика постстрептококковых аутоиммунных поражений базальных ганглиев определяется характером и локализацией антигенных детерминант, против которых оказывается направленным аутоиммунный процесс. Таким образом, можно предположить, что в части случаев МХ, входя в спектр постстрептококковых аутоиммунных заболеваний, не сопровождается аутоиммунной атакой против антигенов соединительной ткани и не должна включаться в спектр ревматизма. Однако существует ли подобный вариант МХ и можно ли его отдифференцировать от ревматической хореи, остается неясным.
Согласно модифицированным критериям Джонса (1992), для установления диагноза ревматизма необходимы как минимум 2 больших критерия (кардит, полиартрит, хорея, кольцевая эритема, подкожные узелки) либо 1 большой и 2 малых (лихорадка, артралгия, повышение СОЭ, лейкоцитоз, положительный С-реактивный белок, удлиненный интервал PR), а также наличие анамнестических или лабораторных признаков недавней стрептококковой инфекции (высевание из зева бета-гемолитического стрептококка группы A, указание на недавно перенесенную скарлатину, выявление в крови стрептококковых антигенов, повышенный титр противострептококковых антител – антистрептолизина O, антидезоксирибонуклеазы B, антигиалуронидазы и др.) [3].
Тем не менее, учитывая возможность простой хореи, следует признать, что МХ может быть единственным диагностическим критерием ревматизма [1, 5]. Последний подход оправдан прагматическими соображениями – в связи с опасностью развития у больных с МХ ревматической болезни сердца, требующей превентивной антибактериальной терапии. Следует подчеркнуть, что противострептококковые антитела служат лишь маркерами перенесенной инфекции, но не являются доказательством ревматизма. Величина титра антител не отражает активности ревматического процесса и не имеет прогностического значения. У больных с МХ высокие титры антистрептококковых антител встречаются редко: в большинстве случаев они либо остаются в пределах нормы, либо незначительно повышены, что объясняется длительным латентным периодом [11]. Таким образом, исследование антистрептококковых антител имеет при МХ меньшую диагностическую ценность, чем при других проявлениях ревматизма [25].
При простой хорее диагноз возможен лишь при исключении всех других заболеваний, вызывающих хорею, таких как системная красная волчанка, антифосфолипидный синдром, нейросифилис, тиреотоксикоз, СПИД, наследственная доброкачественная хорея, нейроакантоцитоз, гепатолентикулярная дегенерация, электролитные нарушения и др. В комплекс исследований следует включать КТ и МРТ, методы исследования функционального состояния щитовидной железы, почек, печени, определение уровня в крови глюкозы, натрия, кальция, фосфора, церулоплазмина, экскреции меди, исследование роговицы с помощью щелевой лампы (для исключения кольца Кайзера–Флейшера), тесты на ревматоидный фактор, антинуклеарные и антифосфолипидные антитела, LE-клетки, сифилис, ВИЧ-инфекцию, а иногда и тест на беременность [17]. Необходимо тщательное кардиологическое обследование, включающее не только ЭКГ, но и эхокардиографию. КТ и МРТ чаще всего не выявляют патологии, но у части пациентов в Т2-режиме МРТ может обнаруживаться зона гиперинтенсивности в проекции базальных ганглиев [15].
Лечение МХ складывается из этиотропной, патогенетической и симптоматической терапии. При наличии клинических или лабораторных признаков недавней стрептококковой инфекции (например, если стрептококк обнаруживается в мазках из зева или выявляется повышенный титр антистрептококковых антител) показаны меры, направленные на эрадикацию стрептококка, – 10-дневный курс лечения пенициллином (1,5–4 млн ЕД/ сут.) [3]. Возможно также применение пенициллина V (500 мг 2 раза в день, у детей 250 мг 2–3 раза в день) или амоксициллина, а при аллергии к пенициллинам – эритромицина или цефалоспорина первого поколения. В последующем всем больным, перенесшим МХ (в том числе и ее «чистую» форму), необходима превентивная терапия бензатинбензилпенициллином (взрослым 2,4 млн ЕД внутримышечно 1 раз в 3 недели, детям по 600–1200 тыс. ЕД 1 раз в 3 недели), которая снижает риск не только развития порока сердца, но и рецидива МХ [5]. Превентивную терапию рекомендуют проводить не менее 5 лет либо до тех пор, пока сохраняется высокий риск заражения стрептококковой инфекцией (например, в течение всего времени обучения в школе и вузе).
Нестероидные противовоспалительные средства показаны только при сочетании хореи с ОРЛ. В отсутствие других проявлений ревматизма использование этих средств необоснованно [4]. При выраженном гиперкинезе, особенно при наличии признаков активного воспалительного процесса (увеличения СОЭ, положительного С-реактивного белка, кардита, полиартрита), проводят короткий курс лечения преднизолоном (1–1,5 мг/кг/сут.).
В последние годы применяют также метилпреднизолон в дозе 25 мг/кг у детей, 500–1000 мг у взрослых внутривенно капельно в течение 3–5 дней с последующим назначением преднизолона внутрь в дозе 1 мг/кг/сут. и постепенным снижением дозы в течение нескольких недель или месяцев. Имеется положительный опыт применения кортикостероидов и при «чистой» форме МХ, но в настоящее время их применяют лишь в тяжелых случаях, резистентных к обычным терапевтическим мерам [10]. Тем не менее, учитывая возможность формирования необратимых изменений в базальных ганглиях, следует оценить целесообразность проведения короткого курса кортикостероидов на ранней стадии МХ.
Необходимость в симптоматическом лечении гиперкинеза возникает лишь в ситуации, когда он существенно ограничивает двигательную активность [5]. Оно основано на восстановлении баланса между дофаминергической и ГАМКергической системами. Преобладание дофаминергической системы при МХ может быть связано не только с дисфункцией ГАМКергических нейронов, но и с гиперчувствительностью постсинаптических дофаминовых рецепторов или дисфункцией пресинаптических дофаминовых рецепторов с нарушением внутрисинаптического баланса дофамина. Соответственно, для коррекции гиперкинеза в основном используют препараты, усиливающие ГАМКергическую передачу (вальпроевая кислота, клоназепам) или блокирующие дофаминергическую передачу (метоклопрамид, сульпирид, тиаприд, пимозид, галоперидол) [4].
Учитывая склонность больных с МХ к развитию лекарственного паркинсонизма, следует использовать минимальные эффективные дозы нейролептиков, стремясь не к полному подавлению гиперкинеза, а к созданию приемлемых условий для повседневной активности больного. Спустя 4–8 нед. у большинства больных необходимость в симптоматическом лечении отпадает в связи со спонтанным регрессом хореи, но иногда в течение нескольких месяцев сохраняется потребность в поддерживающей дозе того или другого средства. Приступать к постепенной отмене антиконвульсанта или нейролептика целесообразно не ранее чем через 2–3 нед. после регресса хореи.
В тяжелых, резистентных к обычным методам терапии случаях МХ предлагается проводить лечение плазмаферезом или внутривенным введением иммуноглобулина, однако эффективность этих методов при МХ не установлена [24].
Литература
* Журнал неврологии и психиатрии им. С.С.Корсакова. – 2005. – №5. – C. 67–71.




