Цисплатин или карбоплатин что сильнее
Цисплатин или карбоплатин что сильнее
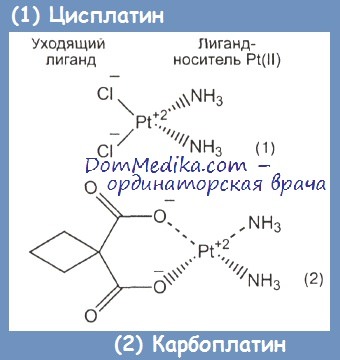
Противоопухолевой активностью обладает только цис-форма циспластина. Он действует как алкилирующий агент. Препарат проникает в клетку, где от молекулы отщепляется хлорид-ион, после чего цисплатин связывается с ДНК, образуя внутри- и межцепочечные сшивки. Препарат связывается главным образом с остатками гуанина. Назначается внутривенно.
Половина от введенного в организм количества препарата выводится через 40 мин; поздняя фаза выведения более продолжительна (период полувыведения составляет 60 ч). Порядка 90% лекарства связывается с белками плазмы, кроме того, оно проникает в почки, кишечник, печень, яичники и яички, но не попадает в ЦНС.
Цисплатин обладает высокой почечной токсичностью, и при назначении его в больших дозах крайне важно обеспечить повышенный отвод мочи. Для этого до введения препарата и в течение 24 ч после инъекции больному внутривенно вводят большое количество жидкости. При назначении дополнительных циклов терапии цисплатином может наблюдаться ухудшение функции почек. Поэтому следует регулярно проверять уровень креатинина в плазме и почечный клиренс.
Для поддержания отвода мочи на должном уровне при назначении больших доз препарата больным вводят маннит. Для предотвращения убыли из мочи ионов К+ и Mg2+/Ca2+ может потребоваться дополнительное одномоментное или длительное введение электролитов. При приеме препарата в больших дозах развивается сильная тошнота и рвота. Также отмечается необратимая ототоксичность, поэтому перед проведением курса лечения больному следует провести аудиометрию.
Миелопоэз подавляется лишь умеренно, однако часто развивается доклиническая форма периферической нейропатии. Нередко отмечается гиперчувствительность.
Цисплатин оказался высокоэффективным средством при лечении опухолей тестикулярного происхождения, и его комбинация с винбластином и блеомицином, на наш взгляд, оказала революционизирующее влияние на лечение больных с обширным опухолевым процессом. Препарат эффективен при лечении рака яичников, мочевого пузыря, а также лимфом и мелкоклеточной карциномы бронха. Противоопухолевый эффект цисплатина отмечен в случаях остеосаркомы и сквамозного рака головы и шеи.
Карбоплатин (Параплатин) для химиотерапии рака
Карбоплатин (Параплатин) аналог цисплатина отличается от него по характеру токсических проявлений, однако эффективен в отношении тех же типов опухолей. Препарат вводится внутривенно, причем площадь под кривой зависимости концентрации препарата от времени (AUC) описывается формулой AUC= [GFR (мл/мин) + 25 х n, где n представляет собой требуемое кратное число.
Препарат также проявляет меньшую токсичность по отношению к почкам и нервной системе. Карбоплатин назначают внутривенно в физрастворе или в смеси физраствора с глюкозой.
При отсутствии у больного рвоты, проведение процедур пре- и постгидратации не является необходимым. По сравнению с цисплатином, препарат менее эффективен при раке яичек. Это связано со снижением назначаемой дозы с целью предупредить опасность последствий подавления миелопоэза. Карбоплатин эффективен в лечении больных с мелкоклеточным раком легкого и пациенток с раком яичников. В последнем случае простота способа введения препарата делает его ценным для паллиативного лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сравнение четырех схем химиотерапии для лечения распространенного немелкоклеточного рака легкого
Опубликовано в журнале: New England Journal of Medicine, 346: 92-98 (2002)
Дж.Г. Шиллер, Д. Харрингтон, Ч.П. Белам, К. Лангер, А. Сандлер, Дж. Крук, Дж. Жу и Д. Г. Джонсон от группы ECOG
Реферат
История вопроса.
Мы провели рандомизированное испытание в целью определить, будет ли какая-либо из трех схем химиотерапии превосходить комбинацию цисплатин/ паклитаксел у больных с распространенным немелкоклеточным раком легкого.
Методы.
1207 больных с распространенным немелкоклеточным раком легкого были рандомизированы на эталонную схему цисплатин/паклитаксел или на одну из трех экспериментальных схем: цисплатин/гемцитабин, цисплатин/доцетаксел или карбоплатин/паклитаксел.
Результаты.
Процент ответа для 11 больных, удовлетворяющих критериям испытания, составлял 19%, медианная выживаемость равнялась 7,9 месяца (95%-ный доверительный интервал [ДИ] от 7,3 до 8,5), годичная выживаемость 33% (95%-ный ДИ от 30 до 36%) и двухгодичная выживаемость 11% (95%-ный ДИ от 8 до 12%).
Процент ответа и выживаемость не отличались достоверно для больных, назначенных на лечение цисплатином/паклитакселом, и больных, назначенных на любую из трех экспериментальных схем. Лечение цисплатином и гемцитабином давало достоверно большее время до прогрессии заболевания по сравнению с лечением цисплатином и паклитакселом, однако давало большую вероятность почечной токсичности степени 3, 4 и 5 (у 9% больных по сравнению с 3% больных, получавших схему цисплатин/паклитаксел). Для больных с функциональным статусом 2 процент выживания был достоверно меньшии по сравнению с больными с функциональным статус 0 или 1.
Выводы.
Ни одна из четырех схем химиотерапии не давала достоверного преимущества по отношению к другим при лечении распространенного немелкоклеточного рака легкого.
Приблизительно треть всей онкологической смертности обусловлена раком легкого, который отвечает за большее количество летальных исходов каждый год, чем рак молочной железы, простаты и толстой кишки совместно. Медианная выживаемость для больных с нелеченым метастатическим немелкоклеточным раком легкого составляет всего лишь 4-5 месяцев, а процент выживания за 1 год всего лишь 10% [1].
Химиотерапия распространенного немелкоклеточного рака легкого часто считается неэффективной или слишком токсичной. Однако мета-анализы показали, что по сравнению с поддерживающим уходом химиотерапия дает небольшое преимущество по выживаемости у больных с немелкоклеточным раком легкого 4, Кроме того, рандомизированные испытания по сравнению химиотерапии с «наилучшим поддерживающим уходом» показали, что химиотерапия снижает симптоматику и улучшает качество жизни [5].
На протяжении последнего десятилетия появился ряд новых препаратов для лечения метастатического немелкоклеточного рака легкого, включая таксаны, гемцитабин и винорелбин. Комбинация одного или нескольких таких препаратов с препаратом платины дает более высокие проценты ответы и увеличивает выживаемость за 1 год, по данным исследований по фазе II [(6-10]. Однако, сравнения между этими более новыми схемами химиотерапии, которые часто используются в настоящее время, немногочисленны.
ECOG провела рандомизированное клиническое испытание по сравнению эффективности трех обычно используемых схем со стандартной схемой цисплатин/паклитаксел [11]. Главная цель испытания заключалась в том, чтобы сравнить общую выживаемость у больных, получающих лечение двойными комбинациями цисплатином/гемцитабином, цисплатином/доцетакселом, карбоплатином/паклитакселом и цисплатином/паклитакселом.
МЕТОДЫ
Больных с немелкоклеточным раком легкого на стадии IIIB (со злокачественным выпотом в плевру или перикард), стадии IV или с рецидивом заболевания рандомизировали в одну из четырех групп лечения (Рис. 1). Первая группа получала стандартное лечение: 135 мг/м 2 паклитаксела вводили на протяжении 24 часов в первый день с последующим введением цисплатина в дозе 75 мг/м 2 в день 2. Курс повторяли один раз в 3 недели. Во второй группе гемцитабин в дозе 1000 мг/м 2 вводили в дни 1, 8 и 15, а цисплатин в дозе 100 мг/м 2 вводили в первый день 4-недельного курса.
Больные в третьей группе получали доцетаксел в дозе 75 мг/м 2 и цисплатин в дозе 75 мг/м 2 в день 1, курс повторяли один раз в 3 недели. Больные в четвертой группе получали паклитаксел в дозе 225 мг/м 2 путем 3-часового вливания в день 1 с последующим вливанием карбоплатина в тот же день в дозе, рассчитанной для создания AUC равной 6. Курс повторяли раз в 3 недели. Больных стратифицировали в соответствии с функциональным статусом по ECOG (0-1 или 2, где больший балл говорит о больших нарушениях), потерей веса за предыдущие 6 месяцев ( 3 и тромбоцитов не менее 100000/мм 3 ); адекватную функцию печени (по критерию уровня билирубина не более 1,5 мг на децилитр, [или 25,6 мкмоля/литр]) и достаточную функцию почек (уровень креатинина не более 1,5 мг/децилитр, [или 132,6 мкмол/л]). Предшествующая лучевая терапия симптоматических очагов допускалась при условии, что индикаторные очаги (очаги, за которыми наблюдали, чтобы определить наличие ответа на лечение) не были облучены и что лучевая терапия была завершена до начала химиотерапии. Больные со стабильными метастазами в мозг могли участвовать в испытании. Все больные после информирования должны были предоставить согласие на участие.
Использовались стандартные критерии определения ответа [по ECOG]. Полный ответ определялся как отсутствие заболевания во всех известных локализациях, по крайней мере, в течение 4 недель. Частичный ответ определялся как 50%-ное снижение суммы произведений взаимно-перпендикулярных диаметров всех измеримых очагов, продолжавшееся, по крайней мере, 4 недель. Прогрессирующее заболевание определялось или как 25%-ное увеличение площади любого очага по сравнению с предыдущим измерением, или появление одного или нескольких новых очагов.
Выживание рассчитывали с даты записи в испытание до даты смерти или даты, когда о больном было последний раз известно, что он жив. Время до прогрессии заболевания рассчитывали, начиная с даты включения в испытание до даты регистрации прогрессии заболевания или смерти; данные о больных, которые были живы и не имели рецидива, снимались с учета (цензурировались) на дату последнего обследования.
Протокол был утвержден соответствующей комиссией по рассмотрению в каждом из участвовавших центров. Все больные после информирования представили письменное согласие на участие.
Статистический анализ
Основным учетным критерием было время выживания с момента включения в испытание. Первичный анализ, определенный протоколом, включал сравнение каждого из распределений по выживаемости для трех экспериментальных групп лечения с распределением для соответствующей контрольной эталонной группы с использованием двустороннего лог-рангового критерия [12]. Для контроля ошибки типа I (то есть для контроля на множественные сравнения) для каждого из сравнений использовалось номинальное двустороннее значение Р=0,016. Исследование было спланировано таким образом, чтобы дать 80%-ную возможность выявления увеличения медианной выживаемости в экспериментальных группах на 33%, то есть медианного выживания, составляющего 12 месяцев, поскольку по данным предыдущего испытания стандартная схема давала медианную выживаемость, равную 9 месяцам [11]. Полное разрешающая сила для выявления 33%-ного улучшения выживаемости потребовала бы всего приблизительно 1070 летальных исходов в четырех группах или 535 на одно попарное сравнение. На основании данных по включению больных и критерию участия для предыдущих испытаний ECOG мысчитали, что нам необходимо включить по 300 больных в каждую группу лечения на протяжении 30-месячного периода.
Промежуточные анализы в ходе испытания мониторировались комитетом по мониторингу данных ECOG. План испытания предполагал два промежуточных анализа и один окончательный анализ данных по выживаемости с использованием границы О’Брайена-Флеминга [13], когда имеется 33%, 67% и 100% ожидаемого количества летальных исходов.
Все приведенные значения Р являются двусторонними и были скорректированы на промежуточные анализы в соответствии с методом О’Брайена-Флеминга. Все распределения времени до события были оценены по методу Каплана-Мейера [14]. Все описанные сравнения в отношении сроков до наступления события проводились с использованием лог-рангового критерия. Категорийные данные, такие как данные о лечении, ответе и токсических эффектах, сравнивались для разных групп лечения с использованием точного критерия Фишера (15).
РЕЗУЛЬТАТЫ
В период с октября 1996 г. по май 1999 г. в испытание было включено всего 1207 больных. Медианный период наблюдения составлял 8,0 месяца. На 1 мая 2000 г.
умерло 1074 больных. Из 1207 больных, включенных в испытание, 52 (4,3%), как было обнаружено в последующем, не удовлетворяли критериям участия (Таблица 1).
Таблица 1. Характеристики больных
Характеристика
Цисплатин/ паклитаксел
(N=303)
Цисплатин/ гемцитабин
(N=301)
Цисплатин/ доцетаксел
(N=304)
Материалы конгрессов и конференций
ECCO 10: Европейская онкологическая конференция
Вена, 12-16 сентября 1999 года
Рак легкого как вторая опухоль у излеченных больных раком молочной железы.
Интересное сообщение представил Dr. Ford из M.D. Anderson Cancer Center [1]. За период с 1960 по 1997 гг. среди излечившихся от рака молочной железы пациенток у 280 в последствие был выявлен рак легкого. Контрольную группу составили 300 больных раком молочной железы за тот же период, но не имевшие рака легкого. Было установлено, что курение увеличивало частоту возникновения рака легкого в 6,0 раз. Лучевая терапия сама по себе не приводила к увеличению риска, однако в случае сочетания курения с облучением риск возникновения рака легкого возрастал в 16,8 раза. Этот «синергизм» был наиболее выраженным для ипсилатерального легкого. Полученные данные показывают на необходимость усиления борьбы с курением среди женщин, радикально пролеченных по поводу рака молочной железы. Также возможно выделить среди этих пациенток группу, имеющих наибольший риск развития рака легкого для включения в скрининговое исследование, например с использованием спиральной КТ низкой энергии, проводимое Dr. Hensсke [2].
Эквивалентны ли цисплатин и карбоплатин при распространенном немелкоклеточном раке легкого?
В этом году на сессии ЕССО 10 в Вене Dr. Uwe Gatzemeier представил первые результаты рандомизированного многоцентрового исследования, сравнившего комбинации паклитаксел-цисплатин и паклитаксел-карбоплатин при распространенном НМРЛ [6]. Программа лечения включала в себя паклитаксел 200 мг/м 2 с цисплатином 80 мг/м 2 или карбоплатином AUC=6. Полученные результаты представлены ниже и свидетельствуют, что использование комбинации цисплатина и паклитаксела увеличивает продолжительность жизни больных на 1,3 месяца по сравнению с комбинацией кабоплатина и раклитаксела.
| Доцетаксел 100 мг/м 2 | Доцетаксел 75 мг/м 2 | ЛСТ | |
|---|---|---|---|
| Число пациентов | 49 | 54 | 100 |
| Частота эффекта | 6,1 % | 5,5 % | 0 % |
| Медиана выживаемости | 5,9 мес. | 9,0 мес.* | 4,7 мес.* |
| 1-годичная выживаемость | 19 % | 40 % | 23 % |
Dr. Shepherd показала, что доцетаксел значительно снижает потребность больных в «поддерживающих» медикаментах, обеспечивает лучший контроль болевого синдрома и астении. Результаты этого исследования согласуются с данными, представленными Dr. Fosella на ASCO 1999г., где в качестве второй линии терапии доцетаксел в дозе 75 мг/м 2 показал достоверное преимущество над ифосфамидом и винорельбином [10]. Результаты использования доцетаксела в дозе 75 мг/м 2 в этих исследований приведены ниже:
| Shepherd | Fosella | |
|---|---|---|
| Число пациентов | 54 | 125 |
| Частота объективного эффекта | 5,5 % | 7,5 % |
| Медиана выживаемости | 9,0 мес. | 5,7 мес. |
| 1-годичная выживаемость | 40 % | 32 % |
III фаза рандомизированных исследований при метастатическом НРЛ: роль новых препаратов.
| паклитаксел 175 мг / карбоплатин | паклитаксел 225 мг / карбоплатин | Р | |
|---|---|---|---|
| Число пациентов | 99 | 99 | |
| Стадия 3В/4 | 29 % / 71 % | 31 % / 69 % | |
| Средний возраст | 62,4 | 59,9 | |
| Объективный ответ | 25,6 % | 31,8 % | 0,73 |
| Время до прогрессирования | 4,3 мес. | 6,4 мес. | 0,04 |
| Медиана выживаемости | 9,5 мес. | 11,4 мес. | 0,16 |
| 1-годичная выживаемость | 37 % | 44 % |
В прошлом году на заседании ASCO Dr. Masuda представил данные по аналогичному рандомизированному исследованию, которое включало в себя и третью группу больных, получавшую гемцитабин в монотерапии [17]. Проведенный совместно анализ этих исследований показал превосходство режима иринотекана и цисплатина над виндезином и цисплатином.
Доцетаксел/ цисплатин в сравнении с доцетаксел/ гемцитабином при НРЛ.
Интересным оказалось, что при аденокарциноме достоверно более эффективной была комбинация доцетаксел/ гемцитабин, тогда как при остальных вариантах эффективней оказался режим доцетаксел/ цисплатин.
Гемцитабин/ винорельбин в сравнении с монотерапией винорельбином у пожилых больных распространенным НРЛ.
В недавнем исследовании, проведенном среди больных НРЛ старше 70 лет, было продемонстрировано преимущество монотерапии винорельбина над лучшей поддерживающей терапией в плане улучшения качества жизни. Объективный ответ зарегистрирован в 19,7% [22]. Гемцитабин также хорошо переносим пожилыми с частотой объективного эффекта около 20 % [19].
Авторы представили предварительные результаты исследования, в которое были включены 234 пациента, оценка эффективности и токсичности проведена у 186. Объктивный противоопухолевый эффект индукционной терапии в двух группах составил 55 %. Торакотомия была выполнена у 102 пациентов с выполнением радикального вмешательства в 79 % случаев (IIIA: 87 %; IIIB: 73 %). В группе А значительно чаще наблюдался эзофагит 3/4 ст. (31,5 % и 9% соответственно). Из 110 полностью закончивших протокол пациентов умерло 9, из них 6 вследствие послеоперационных и 3 химиолучевых осложнений. На настоящий момент число умерших одинаково в обеих группах Продолжается набор в исследование до запланированных 350 включенных пациентов.
Таким образом, данное исследование показало достаточно большой процент выполненных радикальных вмешательств при умеренной токсичности. Окончательные же выводы можно будет сделать только после получения отдаленных результатов.
Паклитаксел, этопозид, цисплатин в сравнении с цисплатином и этопозидом в лечении больных распространенным мелкоклеточным раком легкого : результаты рандомизированного исследования.
| ТЕР | ЕР | Р | |
|---|---|---|---|
| Частота объективного эффекта | 50 % | 46 % | |
| Медиана выживаемости | 10,5 мес. | 10,0 мес. | |
| 1- годичная выживаемость | 41 % | 33 % | |
| Частота токсических смертей | 13 % | 0 % | 2 ), чем в ранее проводимом Glisson исследовании (135 мг/м 2 ) [26]. |
1.Ford M, Sigurdson A, Stewart S, et al. Lung cancer after breast cancer: The role of radiation therapy and smoking. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 981.
2.Henschke C, McCauley D, Yankelevitz D, et al. Early Lung Cancer Action Project: overall design and findings from baseline screening. Lancet 1999;354:99-105
3.Rapp E, Pater J, Wilan A, et al. Chemotherapy can prolong survival in patients with advanced non-small- cell lung cancer—report of a Canadian multicenter randomized trial. J. Clin Oncol 1988;6:633-641.
4.Go R, Adjeri A. Review of the comparative pharmacology and clinical activity of cisplatin and carboplatin. Journal of Clinical Oncology 1999;17:409-415.
5.Klatersky J, Sculier JP, Lacroix H, et al. A randomized study comparing cisplatin or carboplatin with etoposide in patients with advanced non-small cell lung cancer: European Organization for Research and Treatment of Cancer protocol 07861. J Clin Oncol 1990; 8:1556-1562.
6.Gatzemeier U, Rosell R, Belticher D, et al. Randomized Pan-European trial comparing paclitaxel/carboplatin versus paclitaxel/cisplatin in advanced non-small cell lung cancer. Abstracts and Proceedings of ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 973.
7.Kelly K, Crowley J, Bunn P, et al. A Randomized Phase III Trial of Paclitaxel Plus Carboplatin (PC) Versus Vinorelbine Plus Cisplatin (VC) in Untreated Advanced Non-Small Cell Lung Cancer (NSCLC): A Southwest Oncology Group (SWOG) Trial. Proceedings of the 35th Meeting of the American Society of Clinical Oncology. 1999; Atlanta, Ga. Abstract 1777.
8.Belani C, Natale R, Lee J, et al. Randomized phase III trial comparing cisplatin/etoposide versus carboplatin/paclitaxel in advanced and metastatic non-small cell lung cancer (nsclc). Proceedings of the 34th Annual Meeting of the American Society of Clinical Oncology. 1998; Los Angeles, Calif. Abstract 17541.
9.Shepherd F, Gralla R, Ramlau R, et al. Randomized study of taxotere (TAX) versus best supportive care (BSC) in non-small cell lung cancer (NSCLC) patients previously treated with platinum-based chemotherapy. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 979.
10.Fosella F, DeVore R, Kerr, et al. Phase III Trial of Docetaxel 100 Mg/m2 or 75 Mg/m2 Vs Vinorelbine/ Ifosfamide for Non-Small Cell Lung Cancer (NSCLC) Previously Treated with Platinum-Based Chemotherapy (PBC). Abstracts and Proceedings of the 35th Annual Meeting of the American Society of Clinical Oncology. 1999; Atlanta, Ga. Abstract 1776.
11.Postmus P, Mattson K, von Pawel J, et al. Phase II trial of mta (LY231514) in patients (PTS) with non-small cell lung cancer (NSCLC) who relapsed after previous platinum or non-platinum chemotherapy. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 985.
12.Rusthoven J, Eisenhauer E, Butts C, et al. Multitargeted Antifolate LY231514 as First-Line Chemotherapy for Patients With Advanced Non-Small-Cell Lung Cancer: A Phase II Study. J Clin Oncol 1999;17:1194.
13.Comella P, Panza N, Nicolella G, et al. Cisplatin-gemcitabine-vinorelbine (PGV) vs cisplatin-vinorelbine (PV) vs cisplatin-gemcitabine (PG) in advanced non-small cell lung cancer (NSCLC). Interim analysis of a SICOG phase III trial. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 977.
14.Kosmidis P, Mylonakis N, Skarlos D, et al. A multicenter randomized trial of paclitaxel (175 mg/m2) plus carboplatin (6AUC) versus paclitaxel (225 mg/m2) plus carboplatin (6AUC) in advanced non-small cell lung cancer (NSCLC). Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 978.
15.Roszkowski K. Taxotere® (TXT) versus best supportive care (BSC) in chemonaive patients with unresectable non-small cell lung cancer (NSCLC): Final results of the phase III study. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 976.
16.Kunitoh H, Sailo N, Nagao K, et al. Cisplatin (CDDP) and irinotecan (irinotecan) versus CDDP and vindesine (VDS) in advanced (stage IIIB and stage IV) non-small cell lung cancer (NSCLC). A multicenter phase II study. Abstracts and Proceedings from ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 989.
17.Masuda N, Fukouka M, Negoro S, et al. Randomized trial comparing cisplatin (CDDP) and irinotecan (irinotecan versus CDDP and vindesin (VDS) versus irinotecan alone in advanced non-small cell lung cancer (NSCLC): a multicenter phase III study. [Abstract 1774]. Proc Am Soc Clin Oncol 1999.
18.Kris MG, Miller VA, Ng KK, Grant SC. The development of docetaxel (Taxotere) in non-small cell lung cancer. Semin Oncol 1997;24(Suppl 14):1-4.
19.Sandler A, Ettinger DS. Gemcitabine: single-agent and combination therapy in non-small cell lung cancer. The Oncologist 1999;4:241-251.
20.Mattson K, Saarinen A, Jekunen A. Combination treatment with docetaxel (Taxotere) and platinum compounds for non-small cell lung cancer. Semin Oncol 1997;24 (Suppl 14):5-9.
21.Georgoulias V, Papadakis E, Alexopoulos A, et al. Docetaxel plus cisplatin versus docetaxel plus gemcitabine chemotherapy in advanced non-small cell lung cancer: A preliminary analysis of a multi-centre randomized phase II trial. Abstracts and Proceedings from ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 986.
22.The Elderly Lung Cancer Vinorelbine Italian Study Group. Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small cell lung cancer. J Natl Cancer Inst 1999;91:66-72.
23.Frasci G, Lorusso V, Panza N, et al. Gemcitabine + vinorelbine (GV) vs vinorelbine (V) alone in elderly or frail non-small cell lung cancer (NSCLC) patients. Interim analysis of a SICOG phase III trial. Abstracts and Proceedings from ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 987.
24.Rube Ch, Thomas M, Semik M, Riesenbeck D. Chemotherapy (CT) and twice daily radio-chemotherapy (HART/CT) versus chemotherapy (CT) alone before surgery in stage III non small cell lung cancer (NSCLC): Abstracts and Proceedings from ECCO 10. Sept 12-16, 1999; Vienna, Austria. Abstract 988.
25.Mavroudis D, Papdakis E, Veslemes M, et al. Paclitaxel-cisplatin-etoposide (TEP) versus cisplatin-etoposide (EP) as first line treatment in small cell lung cancer (SCLC): A preliminary analysis of a multicenter randomized phase III trial. Abstracts and Proceedings of ECCO 10. Sept 12-16; Vienna, Austria. Abstract 980.
26.Glisson B, Kurie J, Perex-Soler R, et al. Cisplatin, Etoposide, and Paclitaxel in the Treatment of Patients With Extensive Small-Cell Lung Carcinoma. J Clin Oncol 1999;17:2309.
27.Miller A, Lilenbaum R, Lynch T, et al. Treatment-related fatal sepsis from topotecan/cisplatin and topotecan/paclitaxel J Clin Oncol 1996;14:1964-1965.