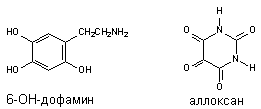Цитотоксическое действие что это
Цитотоксическое действие что это
Цитотоксические вещества блокируют клеточный цикл. Все цитотоксические противоопухолевые лекарства препятствуют прохождению клетками клеточного цикла, приводя к синхронизации и замедлению пролиферации быстро размножающихся клеток. Результатом является снижение чувствительности к лекарствам в S-фазе.
Цитотоксичность пропорциональна общей лекарственной экспозиции. Фармакокинетика противоопухолевых лекарств — это сложный процесс, т.к. цитотоксичность для злокачественных клеток пропорциональна общей лекарственной экспозиции (площадь под кривой; ППК), а не концентрации препарата в плазме на пике. Сначала вещество должно проникнуть в отдельные злокачественные клетки, а затем взаимодействовать со своими молекулярными мишенями. Поскольку это взаимодействие часто обратимо, по крайней мере сначала, цитотоксическая концентрация должна сохраняться все это время.
Кроме того, число индивидуальных взаимодействий между лекарством и молекулами-мишенями, необходимое для киллинга одиночной клетки, может быть очень велико. Подсчитано, что для киллинга одной клетки с ее ДНК должен связаться как минимум 1 млн молекул цисплатина.
Комбинации противоопухолевых препаратов стали применять после того, как было обнаружено, что использование одного препарата не дает значительной ремиссии или не излечивает пациента (за исключением метотрексата при лечении хориокарциномы). Это явление объясняет гипотеза log-киллинга.
Лекарства, используемые для комбинированной терапии, должны обладать определенными свойствами:
• оказывать некоторый эффект при использовании в отдельности;
• вызывать преимущественно полный ответ (гибель всех клеток опухоли), а не частичный (гибель менее 50% клеток);
• биохимические механизмы действия препаратов должны быть разными для воздействия на опухоль, содержащую гетерогенную клеточную популяцию;
• препараты не должны обладать сходным побочным действием, т.к. в этом случае необходимо снижать их дозы, что приводит к утрате аддитивного эффекта комбинации.
По многим показателям различные опухоли являются гетерогенными, включая чувствительность к лекарственным веществам, в результате нестабильности их генетической конституции. Злокачественные клетки способны мутировать, что крайне важно для терапии, поскольку такие мутации могут привести к возникновению резистентности к лекарствам. В большинстве случаев такая резистентность определяется свойствами конкретного типа опухолей.
Клинически резистентность может стать очевидной, когда чувствительные клоны опухоли погибают, а резистентные выживают и становятся доминирующими. Излечимость пропорциональна числу злокачественных клеток, и, в соответствии с гипотезой Голди-Колдмана, существует более высокая вероятность мутации, приводящих к лекарственной резистентности, в более многочисленной клеточной популяции.
Цитотоксическое действие что это
13.1. Механизмы энергообеспечения клеток различной морфофункциональной организации в условиях нормы и гипоксических состояний
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС – синдроме, шоковых и коллаптоидных состояний, является неизменным спутником заболеваний инфекционной и неинфекционной природы, а также стрессовых ситуаций.
Тяжесть течения многих заболеваний и их исход в конечном итоге определяется особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
Как указывалось выше, в соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксии экзогенного и эндогенного происхождния. Последняя включает дыхательную, циркуляторную, гемическую и тканевую гипоксии системного или локального характера.
Общепринятым является представление о том, что в основе развития гипоксий различного генеза лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда.
Как известно, динамика формирования структурных и функциональных сдвигов в различных органах и тканях при гипоксии определяются в значительной мере темпами ее развития, локализацией патологии, характером этиологических факторов, инициирующих гипоксию, и особенностями компенсаторно-приспособительных реакций в том или ином органе.
В соответствии с данными литературы устойчивость тканей различных органов и систем к гипоксии широко варьируют. Наиболее чувствительной к гипоксии является нервная система: при полном прекращении кровотока признаки повреждения коры головного мозга обнаруживается через несколько секунд. Снижение потребления кислорода на 20% структурами головного мозга вызывает потерю сознания. Через 5-6 мин аноксии головного мозга возникают глубокие структурные изменения нейронов, а в продолговатом мозге – через 10-15 мин.
В сердечной мышце мелкие очаги некроза появляются через 3-5 мин с момента, развития ишемии, а крупноочаговый инфаркт миокарда формируется уже спустя 20-30 мин.
Недостаток кислорода в тканях приводит, прежде всего, к дефициту макроэргических соединений, образуемых в сопряженных с окислительно-восстановительными процессами реакциях фосфорилирования на внутренней мембране митохондрий.
Основным энергетическим субстратом для нервной системы, а также для клеток других органов и тканей, является глюкоза. Между тем, при нормальной оксигенации миокарда основным источником его энергетического обеспечения являются высшие жирные кислоты. Так, при окислении 1 молекулы пальмитиновой кислоты образуется 130 М АТФ. В условиях ишемии миокарда усиливается конкурентное ингибирование использования жирных кислот лактатом, что приводит к значительному снижению энергообеспечения миокарда. Так, в процессе анаэробных гликолитических реакций энергетический выход на 1 молекулу глюкозы составляет 2 М АТФ.
Вышеизложенное свидетельствует о том, что независимо от характера этиологических факторов и механизмов развития гипоксии, наиболее ранними проявлениями нарушения оксигенации тканей являются сдвиги их энергетического обеспечения и связанные с ними нарушения углеводного, жирового и белкового метаболизма.
Как известно, процессы ресинтеза АТФ а митохондриях тесно связаны не только с окислительно-восстановительными реакциями, но и с реакциями гликолиза, липолиза, протеолиза, являющимися поставщиками Ац-СоА для цикла Кребса. Установлено, что регулирующими ферментами гликолиза являются фосфорилаза, гексокиназа, фосфофруктокиназа, пируваткиназа, поэтому их подавление в условиях гипоксии приводит к уменьшению образования свободной энергии и в ряде случаев носит необратимый характер. В то же время роль главного регуляторного фермента в последовательных реакциях гликолиза играет фосфофруктокиназа, которую ингибируют АТФ и цитрат, а стимулируют АМФ и АДФ.
Таким образом, в условиях гипоксии, в случаях увеличения потенциала фосфорилирования, возникает активация ключевого фермента гликолиза – фосфофруктокиназы (ФФК) и соответственно возрастание пропускной способности реакции анаэробного гликолиза. При этом резко снижается запас гликогена в сердце, мозге, печени, почках, мышцах и других тканях и соответственно накапливаются продукты гликолитических реакций – молочная и пировиноградная кислоты.
Так активация ФФК на начальных этапах ишемического или гипоксического повреждения клеток приводит к усилению мобилизации гликогена, несколько улучшает энергообеспечение тканей. При этом истощаются запасы гликогена, усиливается ацидоз, приводящий на пике своего развития к подавлению ФФК, и соответственно полной блокаде энергообеспечения клетки.
Развитие метаболического ацидоза при гипоксических состояниях усугубляется также недостаточностью реакций окисления жирных кислот, аминокислот, чрезмерным накоплением кислых продуктов метаболизма указанных соединений.
На обеих стадиях окисления жирных кислот атомы водорода или соответствующие им электроны передаются по митохондриальной цепи переноса электронов на кислород. С этим потоком электронов сопряжен процесс окислительного фосфорилирования АДФ до АТФ. Следовательно, в условиях гипоксии различного генеза блокируются процессы окисления жирных кислот в тканях, в избытке накапливаются кислые продукты, формируется метаболический ацидоз, и соответственно развиваются дефицит АТФ, подавление всех энергозависимых реакции.
Касаясь функциональной значимости метаболического ацидоза, закономерно развивающегося при гипоксии различного генеза, следует отметить ряд последующих неспецифических метаболических и функциональных расстройств, представляющих собой динамическую трансформацию реакций адаптации в реакции дезадаптации.
Как известно, типовой реакцией тучных клеток и тромбоцитов на развитие гипоксии и ацидоза является их дегрануляция с избыточным освобождением в окружающую среду высокоактивных соединений – гистамина, серотонина, ФАТ, ФХЭ, ФХН, лейкотриенов, интерлейкинов. В свою очередь, избыточное накопление ионов водорода, биологически активных соединений приводит к резкому увеличению проницаемости биологических мембран за счет структурных переходов в белках и липидах, и активации процессов свободно-радикального окисления.
Таким образом, среди механизмов, приводящих к повреждению биологических мембран при гипоксии различного генеза, необходимо выделить следующие:
1) развитие метаболического ацидоза,
2) выброс вазоактивных соединений тучными клетками,
3) активацию процессов липопероксидации,
4) высвобождение лизосомальных гидролаз при дезорганизации лизосомальных мембран с последующим усугублением метаболических сдвигов.
13.2. Механизмы развития гипоксического некробиоза.
В настоящее время очевидно, что развитие гипоксического некробиоза связано в значительной мере с дезорганизацией цитоплазматических, лизосомальных, митохондриальных, и других биологических внутриклеточных мембран, формирующих отдельные функциональные и структурные компартменты.
Причем наиболее ранние расстройства возникают у градиентсоздающих и сократительных систем клеток.
Важнейшим фактором повреждения клеток при гипоксии являются ионы кальция.
Как известно, внутриклеточная концентрация кальция в состоянии покоя поддерживается в среднем на уровне 10-7М, что в 100.000 раз меньше, чем в межклеточной жидкости. В период возбуждения кальций проникает из внеклеточной среды в клетку через потенциалзависимые кальциевые каналы. При этом возникают активация фосфолипазы С и образование липидных внутриклеточных посредников – диацилглицерина и инозинфосфамина. Цитоплазматический кальций взаимодействует с кальмодулином – внутриклеточным рецептором с последующей активацией кальмодулинзависимых протеинкиназ и включением тех или иных внутриклеточных реакций.
В условиях гипоксии, дефицита энергетического обеспечения клеток возникают недостаточность механизмов инактивации цитоплазматического кальция и удаления его из клеток в связи с подавлением активности АТФ-зависимого Са-насоса, натрий- кальциевого обменного механизма, дестабилизацией митохондриальных мембран и мембран эндоплазматического ретикулума, играющих в условиях нормы важную роль в поддержании баланса внутриклеточного кальция. При избытке внутриклеточного кальция усугубляются процессы набухания митохондрий, усиливаются дефицит АТФ и подавление всех энергозависимых реакций в клетке. Избыток кальция активизирует ядерные эндонуклеазы, фрагментирующие ДНК, индуцирует апоптоз. При высоком уровне внутриклеточного кальция активизируются нейтральные протеазы – кальципаины, разрушающие цитоскелет клетки, в частности, белки фоурин и В-актин, лизирующие рецепторы и протеинкиназу С.
При гипоксическом некробиозе вокруг гибнущих клеток формируется кальцийзависимая активация системы комплемента, активация коагуляционного и тромбоцитарного звеньев гемостаза, а также фибринолиза и калликреин-кининовой системы.
Активация под влиянием кальция мембранных фосфолипаз приводит к дальнейшей дезинтеграции мембран клеток, активации циклооксигеназы и липооксигеназы с последующим образованием простагландинов, лейкотриенов, свободных радикалов с выраженным цитотоксическим действием.
Чрезвычайно важна роль дезинтеграции митохондриальных мембран в механизмах гипоксического некробиоза клеток.
Как известно, в клетках эукариот все специфические дегидрогеназы принимают участие в окислении пирувата и других субстратов, локализованных в митохондриальном матриксе. Во внутренней мембране митохондрий локализуются переносчики электронов, составляющие дыхательную цепь и ферменты, катализирующие синтез АТФ из АДФ и фосфата.
В связи с этим очевидно, что продукты гликолиза, липолиза, протеолиза, вовлекаемые через ацетил-СоА в цикл Кребса, а также АДФ должны пройти через обе мнтохондриальные мембраны, в то время как новообразованные АТФ проникают из внутренней мембраны митохондрий в цитоплазму клетки и далее к местам энергетических трат. Установлено, что наружная мембрана легко проницаема для всех молекул и ионов небольшого размера, в то время как во внутренней мембране имеются специальные ферментативные транспортные системы, обеспечивающие трансмембранный перенос ионов и различных соединений.
Таким образом, при избыточном накоплении ионов кальция в клетке, активации процессов липопероксидации при гипоксии различного генеза резко повышается проницаемость митохондриальных мембран, возникает набухание митохондрий, пространственная дезориентация ферментативных систем транспорта электронов, синтеза АТФ. В результате происходят разобщение окислительного фосфорилирования и дыхания и соответственно подавление всех энергозависимых систем клетки: синтеза белка, трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения в мышечных структурах и т.д.
В процессе набухания митохондрии энергия потока электронов трансформируется в тепловую энергию.
Наряду с локальными и системными метаболическими сдвигами в тканях, обусловленными гипоксией, ацидозом, активизацией процессов липопероксидации, возникает комплекс метаболических и функциональных сдвигов, обусловленных выбросом гормонов адаптации – катехоламинов, глюкокортикоидов.
Как известно, при чрезмерной активации симпатоадреналовой системы (САС) реакции адаптации довольно быстро трансформируется в дезадаптационные процессы. Во-первых, при активации освобождения норадреналина происходит спазм сосудов переферических органов и тканей и соответственно усугубление циркуляторной гипоксии. На фоне активации САС при участии постсинаптических β-адренорецпторов возможна активация процессов гликолиза, гликогенолиза, липолиза, что, безусловно, усугубляет развитие ацидотических сдвигов, свойственных гипоксии.
Усиление адренергетических влияний закономерно сопровождается активацией процессов липопероксидации, что вносит весомый вклад в механизмы развития гипоксического некробиоза клеток органов и тканей, чувствительных к ишемии.
Синхронно с освобождением катехоламинов в условиях гипоксического стресса выбрасываются глюкокортикоиды, индуцирующие процессы лизиса и апоптоза в лимфоидной ткани, блокирующие процессы пролиферации и репаративной регенерации в ряде внутренних органов.
Цитотоксическое действие что это
Материалы и методики исследования
В работе использовали химически синтезированные пептиды. Исследовали их цитотоксическое действие в отношении клеток эритромиелоидной лейкемии человека К-562 и клеток гистиоцитарной лимфомы человека U-937. Клетки культивировали в среде RPMI-1640, дополненной глутамином, гентамицином и 10% эмбриональной телячьей сывороткой. Для оценки жизнеспособности клеток после их обработки пептидами в качестве маркера клеточной гибели использовали краситель трипановый синий. К суспензии клеток добавляли 0,4%-й раствор трипанового синего и подсчитывали в камере Горяева под микроскопом количество клеток, включивших краситель (количество погибших клеток) и не включивших краситель (количество живых клеток).
Активность каспазы 3 определяли колориметрическим методом по скорости расщепления синтетического субстрата Ac-DEVD-pNAс помощью набора «Caspase 3 AssayKit, Colorimetric» («Sigma», США). Клетки (1 млн/мл) инкубировали с разными концентрациями пептидов в течение 3 часов при 37°С; объем проб составлял 150 мкл, использовали по три параллели. Контролями служили пробы, в которых клетки инкубировали в тех же условиях, но без добавления пептидов. По окончании инкубации клетки центрифугировали 10 мин при 300 g, к полученным осадкам добавляли лизирующий раствор и оставляли их на ледяной бане на 30 мин. Далее пробы центрифугировали 20 мин при 10000 g при 4°С. Супернатанты отбирали и использовали для приготовления проб в соответствии с рекомендациями изготовителей набора «Caspase 3 AssayKit, Colorimetric». Полученные пробы в 96-луночных планшетах инкубировали при 37°С в течение 3 часов, затем оптическую плотность измеряли на спектрофотометре Sectra Max 250 при 405 нм. Активность каспазы представляли в процентах от контроля (клетки без пептида).
Статистическую обработку данных проводили в программе Statistica 6. Графики строили в программе SigmaPlot 11.
Результаты исследования и их обсуждение
Ранее было показано, что антимикробные пептиды бактенецин ChBac3.4 и протегрин 1 (PG1) оказывают токсическое действие на опухолевые клетки [13]. Целью данной работы явилось изучение механизмов этого действия. Чтобы оценить, насколько быстро реализуются токсические эффекты PG1 и ChBac3.4 на клетки-мишени, изучали динамику их цитотоксического действия в отношении клеток U-937 (клетки гистиоцитарной лимфомы человека) и К-562 (клетки эритромиелоидной лейкемии человека), инкубируя клетки с пептидом в течение 15, 30, 60, 120 и 180 мин и оценивая количество живых и мертвых клеток с использованием витального красителя трипанового синего.
На рис. 1 (а, б) представлены данные, полученные после инкубации клеток с PG1.
Механизмы цитотоксичности
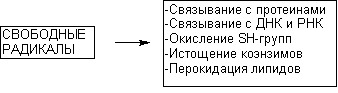
В основе токсического действия веществ лежит повреждение клеток, сопровождающееся их функциональными, либо структурно-функциональными изменения. Разнообразие формирующихся при этом эффектов со стороны целостного организма обусловлено сложностью организации клеток, многообразием клеточных форм, составляющих организм. Сформировавшиеся в процессе эволюции особенности структуры и функции отдельных клеточных типов, формирующих различные органы и ткани, настолько существенны, что чувствительность различных клеток к токсикантам может отличаться в тысячи раз. Тем не менее, живое объединено общностью фундаментальных свойств (см. выше), а это позволяет выделить и некоторые общие механизмы, лежащие в основе цитотоксического действия ксенобиотиков. К числу важнейших можно отнести следующие:
— нарушение энергетического обмена;
— нарушение гомеостаза внутриклеточного кальция;
— активация свободно-радикальных процессов в клетке;
— нарушение процессов синтеза белка и клеточного деления;
— повреждение клеточных мембран;
Необходимо отметить, что все эти механизмы тесно связаны друг с другом. Порой один из них является пусковым, но в дальнейшем особую значимость для судьбы поврежденной клетки приобретают другие. Очень часто два или несколько из упомянутых механизмов связаны между собой по типу «порочного круга». В этой связи их выделение носит искусственный характер и оправдывается только целями данного издания.
1. Нарушение процессов биоэнергетики
1.1. Системы энергообеспечения клетки
Если между двумя веществами осуществляется взаимодействие, например:
А + В 
то существует и некая константа равновесия, характеризующая силу этого взаимодействия:
Х + АТФ 

Х-АДФ + У 

В этом случае эндэргический процесс:
Х + У 

становится возможным за счет сопряженного экзэргического процесса:
АТФ 

в ходе которого образуется промежуточный активный продукт Х-АДФ.
Жизнь клеток и макроорганизмов есть постоянный процесс синтеза сложных молекул (нуклеиновых кислот, белков, полисахаридов, липидов и т.д.), то есть структур с достаточно высокой энтальпией и низкой энтропией. Образование таких молекул означает увеличения свободной энергии системы. Следовательно синтетические процессы невозможны без одновременного протекания экзэргических реакций, обеспечивающих высвобождение энергии, поступающей из окружающей среды и запасенной в форме химических соединений. Основным видом таких реакций в организме является гидролитическое расщепление богатых энергией веществ, содержащих пирофосфатные связи (макроэрги). К их числу относятся: аденозинтрифосфорная кислота (АТФ), аденозиндифосфорная кислота (АДФ), гуанозинтрифосфорная кислота (ГТФ_, цитозинтрифосфорная кислота (ЦТФ), уридинтрифосфорная кислота (УТФ), ацилфосфаты и др. В конечном итоге энергетические возможности клетки определяются запасами макроэргов и, в первую очередь, АТФ.
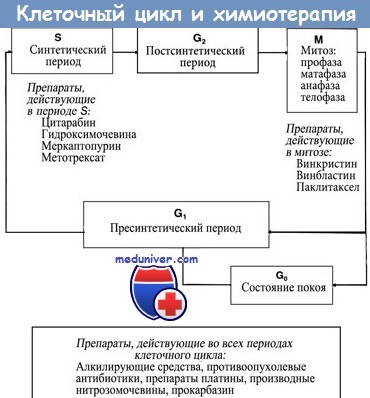
Наиболее уязвимыми для действия токсикантов элементами биологической системы, обеспечивающей образование макроэргов в организме, являются: механизмы биологического окисления (ферменты цикла трикарбоновых кислот, ферменты дыхательной цепи), механизмы сопряжение биологического окисления и фосфорилирования (образования АТФ из АДФ и фосфата), механизмы доставки кислорода к клеткам кровью (рисунок 1).
Рисунок 1. Модель процесса клеточного дыхания. Энергия движения электронов и протонов по цепи дыхательных ферментов обеспечивает работу механизма сопряжения процесса фосфорилирования (кумуляция энергии)
Угнетение активности энзимов гликолиза редко приводит к существенному нарушению энергетического обмена, так как метаболизм других веществ (жиров, белков) может компенсировать этот вид нарушений.
1.2. Механизмы токсического повреждения систем энергообеспечения клетки
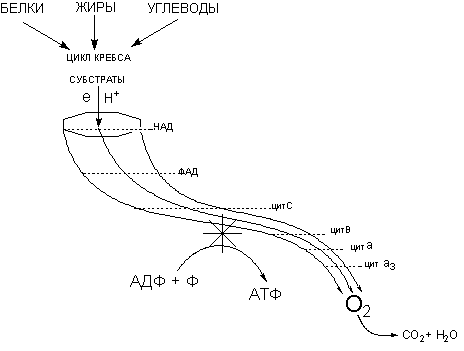
Нарушение процессов биоэнергетики приводит к повреждению биологических систем, вплоть до их гибели. Токсиканты могут влиять на энергетические процессы различными способами. Некоторые примеры представлены на рисунке 2.
Рисунок 2. Механизмы действия токсикантов на биоэнергетические процессы
Мышьяк, ртуть, их органические и неорганические соединения, другие тяжелые металлы, иодацетат и проч., могут взаимодействовать с сульфгидрильными группами целого ряда энзимов гликолиза и цикла трикарбоновых кислот и подавлять их активность (сульфгидрильные яды). Достаточно избирательно действуют вещества-аналоги природных субстратов (фторацетат, оксид углерода и т.д.). Они взаимодействуют с активными центрами соответствующих энзимов, угнетая отдельные этапы процесса энергообеспечения клеток.
Ингибирование энзимов цикла трикарбоновых кислот (ТК) является пагубным для клетки. Так, некоторые фторированные спирты и фторкарбоновые кислоты (ингибиторы ферментов цикла ТК), являются чрезвычайно токсичными соединениями, вызывающими смертельное отравление в дозах нескольких миллиграмм на килограмм массы.
Большое токсикологическое значение имеют вещества, действующие на цепь дыхательных ферментов. Токсиканты, блокирующие элементы цепи дыхательных ферментов (цианиды, сульфиды), могут в течение нескольких минут привести организм к гибели. Первая ступень цепи дыхательных ферментов чувствительна к седативным средствам (барбитураты).
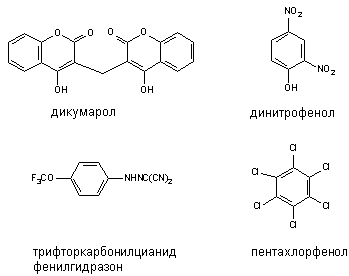
Некоторые вещества способны разобщать процессы биологического окисления и фосфорилирования. Такими свойствами обладают, как правило, липофильные соединения, содержащие фенольную группировку в молекуле и являющиеся слабыми органическими кислотами: 2,4-динитрофенол (ДНФ), динитро-о-крезол, хлорфенолы, дикумарол, а также салицилаты, арсенаты, тироксин и др. (рисунок 3). Самым активным разобщителем является 3,5-дитретбутил-4-гидроксибензилиден-малононитрил (SКF6847). Это вещество примерно в 1800 раз активнее 2,4-ДНФ и уже в концентрации 0,2 моль на 1 моль цитохрома вызывает максимальное разобщение.
in vitro «разобщители» стимулируют скорость потребления кислорода митохондриями и индуцируют активность АТФазы. in vivo в результате их действия значительно активируются процесс клеточного дыхания, однако содержание АТФ в клетках при этом снижается. Образующаяся в ходе окисления субстратов энергия рассеивается в форме тепла, температура тела отравленного резко повышается, учащается дыхание, появляются тошнота, обильное выделение пота, развивается острая сердечная недостаточность, кома. Интоксикация развивается бурно и заканчивается быстрой гибелью пострадавшего.
Рисунок 3. Структура некоторых разобщителей процесса окислительного фосфорилирования
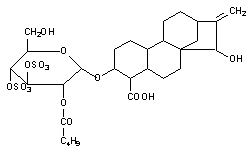
Наконец еще одним механизмом нарушения энергообеспечения клетки является угнетение митохондриальной транслоказы, обеспечивающей транспорт ситезированной АТФ из митохондрий в цитоплазму. Таким образом, действует, в частности атрактилозид, вещество выделяемое из растения Distel Atractylis gummifera, произрастающего в Среднеземноморье (рисунок 4).
Рисунок 4. Структура атрактилозида
Непрямым механизмом цитотоксического действия является понижение токсикантами парциального давления кислорода в тканях.
Нехватку кислорода человек и другие млекопитающие могут переносить только несколько минут. Особенно чувствительными к аноксии являются клетки органов с интенсивным энергообменом (таблица 1).
Таблица 1. Потребление кислорода различными органами крысы
>Скорость потребления О 2 (мл/г ткани мин)
Скелетная мускулатура
2. Нарушение гомеостаза внутриклеточного кальция
Роль кальция, как регулятора физиологических процессов, протекающих в клетке, хорошо известна. Нарушение внутриклеточного гомеостаза этого иона, сопровождающееся существенным повышением его концентрации в цитоплазме клетки, лежит, как полагают, в основе механизма клеточной гибели при целом ряде патологических состояний таких как ишемия, аутоиммунные процессы и т.д. Цитотоксическое действие самых разных токсикантов (цианидов, четыреххлористого углерода, свинца, метилртути, хлордекона, оловоорганических соединений, алкилирующих агентов, диоксина и т.д.) также полагают, хотя бы отчасти, связано с повышением уровня кальция внутри клеток.
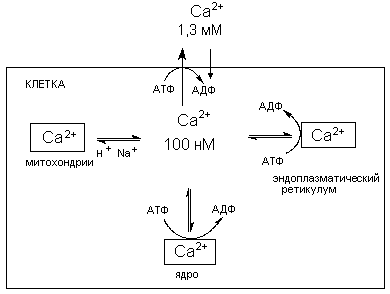
В норме низкая концентрация кальция в цитоплазме поддерживается механизмами его активного транспорта через биомембраны и системой его компартментализации (накопление в клеточных органеллах) (рисунок 5).
Рисунок 5. Схема регуляции содержания ионов кальция в цитоплазме.
Нарушение механизмов поддержания гомеостаза внутриклеточного кальция, как это видно из представленной схемы обмена иона, может стать следствием:
— повреждения биологических мембран и усиления их проницаемости для ионов;
— нарушения биоэнергетики клетки, приводящие к истощению запасов макроэрогов;
Все эти механизмы могут приводить к усилению инфлюкса кальция из внеклеточной жидкости и его высвобождению из депо в цитоплазму клетки. Примеры веществ, повреждающих механизмы поддержания гомеостаза кальция внутри клеток, представлены в таблице 2.
Таблица 2. Некоторые вещества, нарушающие распределение кальция внутри клетки
| 1. Высвобождение кальция из митохондрий:— динитрофенол — кадмий | 3. Усиление поступление кальция через плазматическую мембрану:— четыреххлористый углерод | ||||||||
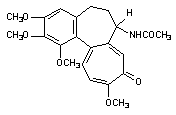
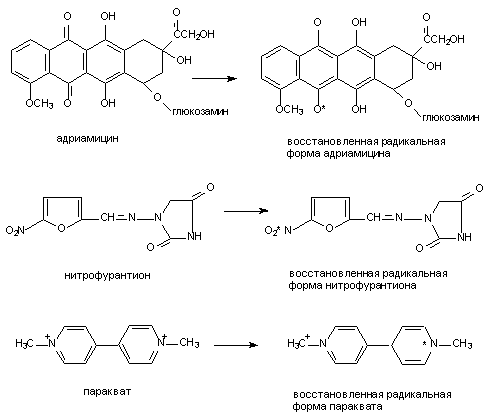
| 2. Высвобождение кальция из эндоплазматического ретикулума: — альдегиды | 4. Угнетение эффлюкса кальция из клетки:— цистамин Цитотоксический эффект в результате стойкого повышения содержания кальция в цитоплазме в настоящее время связывают с развивающимся при этом повреждением целостности цитоскелета и неконтролируемой активацией катаболических энзимов (фосфолипаз, протеаз, эндонуклеаз). Велика роль структур, формирующих цитоскелет в нервных клетках. Здесь микрофиламенты и микротрубочки принимают участие в монтаже системы антероградного и ретроградного аксонального транспорта биологически активных веществ. Как известно белки синтезируются в перикарионе нейрона, а затем транспортируются с помощью этой системы на периферию клетки (в область синаптических контактов). Транспорт по аксону необходим и для обеспечения функций аксональных мембран: оборот глобулярных протеинов в мембране аксонов, выполняющих функции ионных каналов (см. выше). Состояние Швановских клеток также контролируется трофическими веществами, переносимыми с аксональным током. С аксональным током перемещается весь набор энзимов, нейромедиаторов и их предшественников, необходимых для обеспечения синаптической передачи нервных импульсов. Белки цитоскелета повреждаются не только в результате повышения содержания Са 2+ в цитоплазме, но и в результате воздействия токсикантов с иными механизмами токсического действия. Так, непосредственно взаимодействуют с белками цитохалазины, фаллоидин (один из токсинов бледной поганки), а также колхицин (рисунок 7), алкалоиды барвинка (винбластин, винкристин). Рисунок 7. Структура колхицина Действие веществ на тубулин митотического веретена делящихся клеток приводит к нарушению пролиферации последних (особенно клеток системы крови). Колхицин и алкалоиды барвинка в эксперименте, разрушая цитоскелет аксонов нервных клеток, существенно нарушают аксональный ток. Вероятно, аналогичные эффекты могут развиваться и при повреждении цитоскелета веществами, нарушающими внутриклеточный гомеостаз кальция. Установлено, что кальций участвует в активации эндонуклеаз. Вызванная глюкокортикоидами фрагментация ДНК тимоцитов и гибель этих клеток связаны со стойким повышением содержания Са 2+ в цитоплазме. Одним из постоянных проявлений отравления экспериментальных животных диоксином является атрофия тимуса. Установлено, что при этом в тимоцитах значительно активируется процесс фрагментации ДНК, причем периоду разрушения хроматина предшествует период повышения концентрации кальция в цитоплазме. Возможно, что механизм цитотоксичности ТХДД хотя бы отчасти связан с кальциевой активацией эндонуклеаз. Активация эндонуклеаз может быть причиной гибели клеток печени, миокарда, почек при отравлениях многими химическими веществами. 3. Активация свободно-радикальных процессов в клетке Многие ксенобиотики, попав во внутренние среды организма, подвергаются метаболическим превращениям (см. раздел «Биотрансформация ксенобиотиков в организме»). Одним из возможных результатов метаболизма является образование реактивных промежуточных продуктов. Взаимодействие этих реактивных метаболитов, либо вторичных продуктов их превращения, с молекулами-мишенями приводит к нарушению клеточных функций. Изменения в клетках могут быть следствием как избирательного повреждения какой либо одной биохимической структуры, так и сочетанного повреждения нескольких структурно-функциональных элементов. Достаточно часто в ходе исследований удается идентифицировать реактивный метаболит, изучить особенности его взаимодействия с молекулами-мишенями, оценить факторы облегчающие и модулирующие эти взаимодействия. Становиться все более очевидным, что многие реактивные промежуточные продукты метаболизма ксенобиотиков появляются в форме свободных радикалов, т.е. на внешней орбитали молекулы метаболита находится неспаренный электрон. Центром образования такого радикала в молекуле могут быть атомы углерода, азота, кислорода, серы (рисунок 8): Рисунок 8. Примеры простых свободных радикалов Хорошо доказана возможность образования радикалов при метаболизме ацетаминофена, адриамицина (и других цитостатиков антрациклиновой группы), нитрофурантиона, параквата, фенилгидразина, четыреххлористого углерода, бенз(а)пирена и т.д. (рис. 9). Рисунок 9. Структура веществ, подвергающихся биотрансформации с образованием активных радикалов Появление неспаренного электрона на внешней орбитали делает метаболит чрезвычайно реакционноспособным. Активные радикалы вступают внутри клетки в многочисленные реакции, в том числе, связываются с ненасыщенными жирными кислотами, отщепляют водород от других молекул, взаимодействуют друг с другом с образованием димеров и т.д. Рисунок 10. Активация свободно-радикальных процессов в клетках и их последствия 3.2. Механизмы клеточной антирадикальной защиты Механизмы антирадикальной защиты включают как ферментативные, так и неферментативные процессы. Самым простым примером некаталитического разрушения радикалов является их гидролиз, лежащий в основе нейтрализации многих водорастворимых продуктов, например, ацилгалидов, эпоксидов, карбокатионов, изоцианатов, эписульфониум-иона и т.д. Наиболее важной неферментативной реакцией «обезвреживания» радикалов является их взаимодействие с биологическими антиоксидантами, такими как витамин Е, глутатион, витамин С. В результате такого взаимодействия образуются нереакционноспособные вещества, прерывание каскад «наработки» свободных радикалов. Гомеостаз в клетке поддерживается за счет равенства скоростей образования и связывания радикалов. В случае повреждения механизмов защиты клеток, либо активации процессов образования радикалов, превосходящих по интенсивности возможности защиты, или даже разрушающих эти механизмы, развивается поражение клетки. Так, интоксикация преимущественным пульмонотоксикантом паракватом приводит к некоторому снижению содержания глутатиона в печени. Предварительное связывание глутатиона диэтилмалеатом приводит к тому, что паракват приобретает свойства преимущественного гепатотоксиканта. Таким образом, резерв глутатиона в клетке имеет особое значение для обеспечения её антиоксидантной защиты. Хотя глутатион может взаимодействовать с многочисленными субстратами и неферментативно, наличие в тканях энзима глутатион-S-трансферазы (GST) значительно ускоряет течение процесса, повышает его эффективность. Множественность форм GST, их широкая субстратная специфичность, высокий уровень активности в различных тканях делают систему глутатионтрансфераз наиболее универсальной и значимой для связывания активных метаболитов. Глутатион и селен-зависимые глутатионпероксидазы восстанавливают перекись водорода и другие гидроперекиси до менее токсичных алкоголей и воды. Глутатион-дисульфид, образующийся в ходе этой реакции, подвергается обратному восстановлению до глутатиона с помощью НАДФН-зависимой глутатионредуктазы. Активность глутатионредуктазы ингибируют изоцианат-содержащие продукты метаболизма нитрозомочевины. Два других энзима, имеющих большое значение для детоксикации свободных радикалов, это супероксиддисмутаза (СОД) и каталаза. Первый из энзимов катализирует преобразование двух супероксидных радикалов в молекулу кислорода и перекись водорода. Обнаруживаемая во всех тканях СОД содержит в структуре активного центра ионы Cu, Zn, Mn. Образующаяся перекись водорода разрушается с помощью каталазы или глутатионпероксидазного цикла. 3.3. Механизмы активации ксенобиотиков и образования свободных радикалов Ксенобиотики могут трансформироваться в радикалы как энзиматическим, так и неэнзиматическим путем. Например известны токсиканты, специфично повреждающие тела дофаминэргических и серотонинэргических нейронов ЦНС (6-гидроксидофамин и 5,7-дигидрокситриптпмин), Рисунок 11. Вещества, инициирующие свободно-радикальные процессы путем спонтанного окислительно-восстановительного превращения молекулы в клетках Ионы металлов с переменной валентностью (медь, железо) облегчают процесс аутоокисления, а восстановители, например аскорбиновая кислота, обеспечивают регенерацию исходной формы ксенобиотика. Таким образом, формируется неэнзиматический окислительно-восстановительный цикл токсиканта. SH-соединения, никотиновая кислота в опытах in vitro останавливают процесс. Ультрафиолетовые лучи активируют превращение (фотоактивация) накапливающихся в коже сульфаниламидных препаратов, 4-аминобензойной кислоты (рисунок 12) и др. в свободно-радикальную форму, которая, как полагают, ответственна за развитие фототоксических и фотоаллергических процессов у лиц, принимающих эти лекарства. Рисунок 12. Структура о-аминобензойной (антраниловой) кислоты В процессе метаболизма адриамицина, митомицина С, нитрофурантиона, параквата и некоторых других ксенобиотиков образование промежуточных свободных радикалов идет при участии одной лишь НАДФН-зависимой цитохром Р-450-редуктазы. При этом образовавшиеся радикалы удается выявить только в жестких анаэробных условиях. В присутствии кислорода восстановленные радикалы быстро окисляются до исходной формы, при этом электроны переходят с радикала на молекулу кислорода, что приводит к образованию супероксидного аниона и других его реактивных форм и также активации свободно-радикальных процессов. Помимо упомянутых выше, в образовании активных радикалов могут принимать участие и другие энзимы. Так, ксантиноксидаза участвует в метаболизме адриамицина, нитрофурантиола, параквата до продуктов их одноэлектронного восстановления. Тирозиназа, в большом количестве содержащаяся в клетках меланом участвует в образовании многих реактивных метаболитов. Цитоплазматическая диафораза и простогландинсинтетаза облегчают формирование окислительно-восстановительного цикла трансформации параквата, ацетаминофена, бенз(а)пирена и т.д. Таким образом, можно выделить несколько ключевых моментов, имеющих особое значение для реализации повреждающего действия ксенобиотиков на клетку, путем активации свободно-радикальных процессов: 2. Усиленное образование свободных радикалов может начаться в нескольких независимых локусах клетки (эндоплазматическом ретикулуме, митохондриях, ядре, цитоплазме); 3. Активация ксенобиотиков до активных радикалов может стать следствием последовательного действия на токсикант нескольких ферментов; 4. Возможно неэнзиматическое образование свободных радикалов. Превращение одного из ксенобиотиков может активировать превращение другого. Так, блеомицин повреждает ДНК в присутствии митомицина С и т.д. 3.4. Биологические последствия активации свободно-радикального процесса в клетке В результате образования свободных агрессивных радикалов повреждаются самые разные структуры-мишени: липидные мембраны, свободные аминокислоты, полисахариды, нуклеиновые кислоты, рецепторные молекулярные комплексы, транспортные протеины. Итогом такого действия является изменение функционального состояния и гибель клетки, мутация её генетического кода, что, как уже указывалось, на уровне макроорганизма приводит к явлению массивной клеточной гибели (некроз), разрастанию соединительной ткани в органе (фиброз), мутагенезу, развитию новообразований в отдаленные периоды после действия токсиканта. Характер повреждающего действия активных радикалов во многом определяется их стабильностью и расстоянием, на которое они могут мигрировать от места своего образования. В соответствии с этими признаками реактивные метаболиты могут быть разделены на несколько групп. Наивысшей реакционной способностью обладают промежуточные продукты, образующиеся в ходе так называемого «суицидного метаболизма». Эти продукты разрушают образующие их энзимы. К числу «суицидных» ингибиторов Р-450 относятся, в частности, винилгалогены, некоторые олифены, дигидропиридины, циклопропильные соединения. Следующими по реакционной способности являются вещества, покидающие область локализации фермент-субстратного комплекса, но активно взаимодействующие с другими протеинами. Примерами веществ, действующих подобным образом, являются: ацилгалидный метаболит хлорамфеникола, электрофильный радикал серы, отщепляющийся в ходе метаболизма паратиона и т.д. Менее реакционноспособными являются продукты, мигрирующие в другие локусы клеток и даже за их пределы. Эта группа метаболитов включает большинство промежуточных продуктов. Подобные радикалы способны проникать через биологические мембраны. Это свойство присуще метаболитам бенз(а)пирена, бромбензола, диметилнитрозамина, винилхлорида, трихлорэтилена и т.д. Механизмы токсического действия свободных радикалов представлены на рисунке 14. Рисунок 14. Некоторые токсические эффекты свободных радикалов 4. Повреждение мембранных структур 4.1. Основные свойства и функции биологических мембран В мембрану встроены белковые молекулы, которые часто пронизывают всю ее толщу, либо погружаются на различную глубину, локализуясь на внешней или внутренней стороне. Углеводный компонент клеточной мембраны представлен главным образом гликопротеинами. Они располагаются на внешней поверхности мембраны. Мембраны различных клеток существенно различаются по своему строению и функциям. В клеточной мембране печени обнаруживается около 20 энзимов. Активность энзимов во многом зависит от липидного состава мембран. Особыми свойствами обладают возбудимые мембраны нервной, мышечной и железистой тканей. Изменение их свойств в ответ на стимул являются важнейшим звеном цепи биологических процессов, лежащих в основе формирования реакции организма на внешние и внутренние раздражители. Клеточные мембраны чрезвычайно динамичный элемент. Их строение изменяется в соответствии с условиями окружающей среды и потребностями клетки. Увеличение площади поверхности растущей клетки осуществляется за счет слияния клеточной мембраны с синтезируемыми в цитоплазме (аппарат Гольджи) микровезикулами. Этот же процесс обнаруживается и у не растущих секреторных и нервных клеток, которые путем отшнуровывания микровезикул выделяют в окружающую среду биологически активные вещества (гормоны, нейромедиаторы). Важными свойствами клеточной мембраны является её электрический заряд и электрическая проводимость. Наружная сторона мембраны клеток в состоянии покоя заряжена положительно. Полярность мембраны определяется отчасти асимметричностью липидных слоев, отчасти наличием в её составе белковых молекул и гликопротеинов. Особое значение имеет градиент концентрации ионов по обе стороны мембраны, поддерживаемый благодаря энергозатратным процессам. Таким образом свойства мембраны и обмен веществ в клетке тесно связаны. Вещества, вмешивающиеся в обмен липидов, существенно влияют на свойства биологических мембран. Токсическое действие многих веществ сопряжено с их влиянием на состояние мембранных структур. Оно может быть прямым и опосредованным. Наиболее вероятными механизмами опосредованного повреждения биологических мембран при интоксикациях являются: — активация перекисного окисления липидов; — активация фосфолипазной активности. 4.2. Действие токсикантов на мембраны 4.2.1. Прямое действие на мембраны Возможно действие ксенобиотиков непосредственно на липидный бислой или белковые компоненты биомембран. Развивающиеся вследствие этого эффекты могут быть как неспецифичными (отсутствие строгой зависимости между структурой токсиканта и развивающимся эффектом), так и строго специфичными. Специфичность является следствием действия токсикантов на энзимы и рецепторные белковые комплексы (см. выше). Часто действие носит смешанный «полуспецифический» характер. В результате неспецифического действия многочисленных токсикантов (бензола, толуола, динитробензола, хлороформа, мылов, сапонинов, смачивающих веществ, тяжелых металлов и других денатурирующих агентов) может нарушаться структурная целостность мембран, что приводит к деформации, лизису клетки и её гибели. При действии таких веществ на мембраны эритроцитов развивается гемолиз.
Многие токсиканты избирательно действуют на мембраносвязанные энзимы, транспортные системы, рецепторные комплексы к биологически активным веществам. К числу таких в частности относятся гликозиды, агонисты и антагонисты нейромедиаторов и гормонов, блокаторы ионных каналов и многие другие. 4.2.2. Активация перекисного окисления липидов Не смотря на многочисленные исследования до настоящего времени нет четких представлений о значении активации перекисного окисления липидов для развития токсического процесса, инициируемого даже такими мощными прооксидантами, как паракват, адриамицин, нитрофурантион и т.д. Для развития процесса важна степень насыщенности тканей кислородом. В полностью аэробной среде образующийся из ксенобиотика восстановленный метаболит подвергается быстрому обратному окислению. При этом значительно возрастает количество радикалов в виде вторичных активных форм кислорода. Поэтому хорошо снабжаемые кровью и насыщенные кислородом ткани (легкие, сердце, головной мозг) являются более чувствительными к повреждающему действию прооксидантов. Важным механизмом повреждения биологических мембран является гидролиз фосфолипидов, наступающий вследствие активации фосфолипаз (особенно фосфолипазы A 2 ). Активация энзима происходит в результате прямого или опосредованного (гипоксия, нарушение гомеостаза внутриклеточного кальция и т.д.) действия многих токсикантов на клетки организма (рисунок 16).
4.3. Биологические последствия действия токсикантов на мембраны Вещества, действующие на клеточные мембраны, как правило, изменяют следующие их параметры: 1. Проницаемость. Изменяется поступление субстратов в клетки и отток продуктов метаболизма. Действие проявляется изменением интенсивности обмена веществ в клетке, нарушением электрических свойств мембран. 2. Электрический заряд. Нарушается раздражимость возбудимых клеток. 3. Структурная организация. Нарушается структура клетки, возможна клеточная гибель. Кроме того, патохимические процессы, проходящие в мембране, приводят к образованию целого ряда биологически активных веществ (см. выше), участвующих в патогенезе токсического процесса. Поскольку система внутриклеточных мембран также является мишенью для действия многочисленных токсикантов, среди них можно выделить группу митохондриальных ядов, повреждающих различные звенья процессов биоэнергетики, веществ действующих на шероховатый (нарушение процессов синтеза белка) и гладкий эндоплазматический ретикулум (индукция или угнетение метаболизма ксенобиотиков), лизосомальные мембраны (аутолиз клеток) и др. 5. Повреждение процессов синтеза белка и клеточного деления Таблица 3. Возможные точки приложения повреждающего действия токсикантов на процессы синтеза белка и нуклеиновых кислот. 1. Синтез ДНК. Репликация — изменение структуры (конформации) ДНК — нарушение процесса полимеризации ДНК — нарушение синтеза нуклеотидов — нарушение процесса репарации ДНК — нарушение механизмов регуляции синтеза ДНК 2. Синтез РНК. Транскрипция — нарушение полимеризации РНК — нарушение процессии РНК — нарушение синтеза нуклеотидов — нарушение механизмов регуляции синтеза РНК 3. Синтез белка. Трансляция — нарушение организации и процессии рибосом и полисом — нарушение полимеризации аминокислот — нарушение образования аминоацетил-tРНК — нарушение формирования конформации белка и его третичной и четвертичной структур — нарушение механизмов регуляции трансляции |
5.1. Синтез ДНК. Репликация
Как указывалось ранее, нарушение репликации может явиться следствием химического взаимодействия ДНК с токсикантами. Однако возможны и иные механизмы повреждения (таблица 4).
Таблица 4. Механизмы действия ингибиторов синтеза нуклеиновых кислот и белков
>Примеры
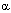
1. Угнетение активности ДНК-полимераз и других ферментов синтеза.
Эдеин и налидиксовая кислота угнетают активность ДНК-полимераз, а N-диметилрифампицин подавляет РНК-зависимый синтез ДНК (ингибитор ревертазы). Соединения, нарушающие конформацию ДНК, могут подавлять реакцию её полимеризации, не изменяя активность соответствующих энзимов.
2. Влияние на синтез дезоксирибонуклеотидов.
3. Влияние на регуляцию синтеза ДНК.
4. Действие на разрушение ДНК и её репарацию.
Ингибиторы лигаз угнетают процессы репарации ДНК и повышают частоту мутаций (например, бензамид и его производные).
5. Другие механизмы действия.
5.2. Синтез РНК. Транскрипция
1. Нарушение конформации и свойств ДНК (см. выше).
На поврежденной ДНК синтезируется измененные молекулы РНК, не свойственные организму.
2. Угнетение активности РНК-полимераз.
3. Влияние на РНК-процессинг.
Это явление изучено недостаточно. Полагают, что кордицепин (см. выше) ингибирует начало процесса синтеза РНК.
4. Угнетение синтеза нуклеотидов.
5. Нарушение регуляции синтеза РНК.
Синтез РНК контролируется целым рядом факторов. Большая часть генома находится в репримированном состоянии, т.е. блокирована специальными белками (гистонами) и не участвует в процессе транскрипции. Активация этих отрезков молекулы ДНК осуществляется низкомолекулярными хромосомными РНК, цитоплазматическими протеинами и другими факторами (например гормонами). Так, стероиды (эстрогены, андрогены, кортикостероиды) стимулируют синтез РНК и, следовательно, белка. Аналогичные эффекты описаны для инсулина и глюкагона. Многочисленные синтетические соединения (барбитураты, толбутамид, бензпирен, метилхолентрен, диоксин и т.д.) вызывают индукцию синтеза микросомальных энзимов, ответственных за метаболизм ксенобиотиков. По всей видимости, они взаимодействуют с репрессорными протеинами, вызывают депримирование ДНК и активируют тем самым синтез РНК и соответствующих белков.
5.3. Синтез белков. Трансляция
Объединение аминокислот в полипептидную цепь осуществляется на рибосомах или полисомах. Токсиканты могут вмешиваться в процессы синтеза белка и на этом этапе. Возможны следующие механизмы токсического действия:
1. Нарушение конформации рибосом и организации полисом.
Этот механизм экспериментально показан для целого ряда антибиотиков, действующих на рибосомы и полисомы бактериальных клеток.
2. Угнетение процесса образования полипептидной цепи.
Многие антибиотики вмешиваются в процесс синтеза белка на рибосомах бактерий. При этом выявляются нарушения:
— процессов считывания информации с кода мРНК;
— образования формилметионил-tРНК и повреждение тем самым инициации синтеза полипептидной цепи;
— образования пептидных связей (таков, в частности, один из механизмов токсического действия дифтирийного токсина);
— затруднение транслокации пептидил-tРНК и мРНК.
3. Угнетение синтеза и формирования аминоацил-tРНК.
Необходимым этапом полимеризации аминокислот и образования полипептидной цепи является их активация, путем образования комплекса с tРНК (образование аминоацил-tРНК). На первом этапе происходит взаимодействие аминокислот с АМФ (активация), и лишь затем образуется связь с РНК. Введение в среду, где инкубируется экспериментальный материал (делящиеся клетки, бактерии), ненормальных аминокислот, например D-форм или таких как этионин, тиенилаланин, алкилвалин и др., приводит к угнетению активности синтезирующих энзимов, а следовательно и процесса синтеза белка в целом.
4. Нарушение конформации синтезируемой белковой молекулы.
Синтезированная полипептидная цепь спонтанно формирует свою третичную структуру. Отчасти процесс проходит при участии различных кофакторов. Угнетение синтеза таких кофакторов или поступление в организм их неактивных аналогов (антивитаминов) нарушает процесс.
5. Влияние на регуляцию процесса трансляции.
Имеются данные о том, что процесс трансляции, особенно его инициация и терминация, подлежат контролю. Отвечают за это особые виды регуляторных РНК и протеинов, а также механизмы контролирующие уровень цАМФ в клетках. Образованию полисом способствует повышение содержания эстрадиола; инсулин активирует процесс инициации синтеза белка на малых субъединицах рибосом. Витамин К блокирует на уровне трансляции образование протромбина и других факторов свертывания крови и т.д. Усиление или угнетение рассмотренных процессов может лежать в основе токсического действия некоторых веществ.
5.4. Биологические последствия действия токсикантов на нуклеиновый обмен и синтез белка
Токсикологическое значение веществ, вмешивающихся в процесс синтеза белка и клеточное деление, обусловлено их цитостатическим, иммуносупрессорным, мутагенным, тератогенным и канцерогенным действием (см. соответствующие разделы).
Таблица 5. Условия воздействия генотоксиканта, определяющие форму развития токсического процесса: канцерогенеза, мутагенеза, тератогенеза
Токсический процесс
Чувствительная ткань
Оптимальное время воздействия
Продолжи тельность действия и доза
Канцерогенез
Мутагенез
Существует представление, согласно которому проникновение в организм даже единственной молекулы генотоксиканта (в отличие от токсикантов с иным механизмом токсического действия) может привести к пагубным последствиям. Дело в том, что химическое повреждение единичной молекулы ДНК в единичной клетке макроорганизма, при стечении обстоятельств, может стать причиной мутогенеза, тератогенеза, канцерогенеза. Вероятность такого события бесконечно мала, но теоретически возможна. Такой характер действия веществ на биосистемы называется беспороговым.


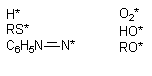
 -клетки поджелудочной железы (аллоксан) и др., легко подвергающиеся аутоокислению с образованием активных радикалов (рисунок 11). Параллельно с самоокислением молекулы подобных ксенобиотиков осуществляется продукция реактивных форм кислорода.
-клетки поджелудочной железы (аллоксан) и др., легко подвергающиеся аутоокислению с образованием активных радикалов (рисунок 11). Параллельно с самоокислением молекулы подобных ксенобиотиков осуществляется продукция реактивных форм кислорода.