Цервикогенная вестибулопатия что это
Цервикогенная вестибулопатия что это
Кафедра нервных болезней лечебного факультета Московского государственного медико-стоматологического университета
ГБУЗ «Московский научно-практический центр оториноларингологии им. Л.И. Свержевского» Департамента здравоохранения Москвы
ФГБУ «Российский научный центр медицинской реабилитации и курортологии» Минздрава России, Москва, Россия
ФГБУ «Российский научный центр медицинской реабилитации и курортологии» Минздрава России, Москва, Россия
Цервикогенное головокружение: взгляд невролога
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(3): 97-102
Стулин И. Д., Тардов М. В., Кунельская Н. Л., Агасаров Л. Г., Болдин А. В. Цервикогенное головокружение: взгляд невролога. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(3):97-102.
Stulin I D, Tardov M V, Agasarov L G, Boldin A V, Cervical vertigo: a neurologist’s point of view. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2018;118(3):97-102.
https://doi.org/10.17116/jnevro20181183197-102
Кафедра нервных болезней лечебного факультета Московского государственного медико-стоматологического университета
Цервикогенное головокружение до сих пор не признается многими неврологами, так как не имеет специфических клинических симптомов и надежных диагностических критериев. Накоплены многочисленные экспериментальные и клинические факты, подтверждающие правомочность выделения цервикогенного головокружения как отдельной нозологической формы. В обзоре представлены доказательства существования цервикогенного головокружения, а также описания его типов. Рассмотрены принципы диагностики и лечения, предпринята попытка создания единой концепции цервикогенного головокружения.
Кафедра нервных болезней лечебного факультета Московского государственного медико-стоматологического университета
ГБУЗ «Московский научно-практический центр оториноларингологии им. Л.И. Свержевского» Департамента здравоохранения Москвы
ФГБУ «Российский научный центр медицинской реабилитации и курортологии» Минздрава России, Москва, Россия
ФГБУ «Российский научный центр медицинской реабилитации и курортологии» Минздрава России, Москва, Россия
Головокружение входит в группу наиболее частых жалоб на амбулаторном врачебном приеме: до 30% населения знакомы с этим явлением [1]. Нередко головокружение развивается у больных с шейными проблемами: из более чем 18 000 пациентов, проходивших курс мануальной терапии в Нидерландах в 1972—1992 гг., 18% больных жаловались на головокружение [2].
Термин «цервикогенное головокружение» (ЦГ) начали использовать M. Ryan и S. Cope в 1955 г. [3]. Исследователи считали основой проблемы нарушение импульсации от рецепторного аппарата верхнешейных межпозвонковых суставов к вестибулярным ядрам. Спустя 40 лет J. Furman и S. Cass определили ЦГ как «неспецифическое ощущение нарушения ориентации в пространстве и равновесия, обусловленное патологической афферентной импульсацией из области шеи» [4].
До сих пор в мировом медицинском сообществе единого мнения в отношении ЦГ не существует, однако данные многочисленных научных работ позволяют оценить возможность рассмотрения его в качестве отдельной формы и выработать общую концепцию.
Экспериментальные основы. Экспериментальное изучение ЦГ продолжается более 100 лет [5]. Неоднократно продемонстрирована возможность провокации нистагма и нарушения координации у животных при помощи анестезии трех верхних шейных корешков или шейных мышц [6—8]. Экспериментальные работы с участием людей также зарегистрировали постуральный дисбаланс, нистагм и головокружение при воздействии болевого стимула [9] или анестетика [10] в области шеи. Те же эффекты зафиксировали при локальном физическом воздействии [11] или гальванизации области шеи [12], так же как и раздражении миофасциальных триггерных точек [13, 14]. Основываясь на работах ведущих специалистов данной области [15—17], можно выделить несколько патогенетических типов ЦГ.
Проприоцептивное ЦГ. Поддержание равновесия обеспечивается функционированием вестибулярного, зрительного и соматосенсорного анализаторов. Информация от этих систем обрабатывается в мозжечке, формируется общая картина, на основе которой осуществляются моторные акты, направленные на обеспечение устойчивости или совершение движения. Сохранение равновесия или развитие головокружения хорошо объясняется принципом эфферентного копирования E. Holst и H. Mittelstaedt [18], подразумевающим возможность несоответствия ожидаемой реафферентации и реальной сенсорной информации (рис. 1). 
С позиций постурологии, полный поток проприоцептивной информации рассматривается как совокупность потоков, исходящих из частей тела с максимальной концентрацией проприорецепторов: плантарный и окуломоторный входы, височно-нижнечелюстной сустав, пояснично-крестцовый и верхнешейный отделы позвоночника [19, 20]. Дисфункция любого из представленных входов вызывает дезорганизацию всей постурологической системы с перераспределением тонуса поперечнополосатых мышц, что приводит к нарушению устойчивости. Миофасциальный синдром шейных мышц, частое следствие хлыстовой травмы шеи, сходным образом нарушает баланс афферентной импульсации, обеспечивающей контроль равновесия [21]. Дискоординация в свою очередь приводит к нарушению контроля шейного мышечного тонуса [22] и замыкает патологический круг.
Синдром Барре—Льеу. J. Barre и Y. Lieou в 1926—1928 гг. описали синдром симпатической дисфункции [23, 24], включающий головокружение, шум в ушах, затуманенность зрения, тошноту, рвоту и головную боль. Авторы связывали развитие клинической картины со спазмом артерий вертебрально-базилярной системы, обусловленным усилением активности симпатических сплетений позвоночных артерий (ПА), вызываемым вертебральным дистрофическим процессом. Гипотеза Барре—Льеу была отвергнута после завершения работ, которые не смогли подтвердить эффект симпатической денервации ПА на церебральный кровоток [25, 26]. Однако дальнейшие исследования на животных [27] и людях [28] доказали присутствие большого количества симпатических постганглионарных волокон в задней продольной связке, фиброзном кольце межпозвонкового диска, капсуле унковертебрального сустава и стенках дурального мешка.
Ротационный синдром ПА. Одним из характерных симптомов нарушения кровотока в ПА служит головокружение: синдром представляет собой вертебрально-базилярную недостаточность. В рамках МКБ-10 диагноз сформулирован как «синдром вертебрально-базилярной артериальной системы» (G45.0). Патофизиологический базис может определяться ишемией в стволе головного мозга или непосредственно в бассейне лабиринтной артерии, снабжающей кровью внутреннее ухо [15]. В клинической практике встречаются малые инсульты, имитирующие периферический вестибулярный синдром [29, 30] и связанные с очагами в стволе головного мозга, мозжечке и коре больших полушарий.
Варианты компрессии ПА, проявляющиеся постуральным дисбалансом и головокружением, могут быть отнесены к ЦГ. В отечественной медицинской литературе рассматриваемый вариант именуется «синдром позвоночной артерии», ему посвящено множество работ российских неврологов [31—34]. Симптоматика в каждом конкретном случае определяется анатомией задней системы циркуляции и патологией шейных структур. Так, сочетание гипоплазии ПА, несостоятельности гомолатеральной задней соединительной артерии и компрессии гетеролатеральной гемодинамически доминирующей ПА повышает вероятность развития стволового инсульта [35].
К компрессионным синдромам ПА относятся ротационный синдром ПА, описанный в 1978 г. B. Sorensen [36] как «синдром лучника»; синдром нижней косой мышцы головы, описанный Я.Ю. Попелянским [37], и синдром Унтерхарнштейдта, описанный в 1956 г. [38].
Клиническая картина компрессионного синдрома ПА близка к синдрому позвоночно-подключичного обкрадывания, связанному со значимым стенозированием подключичной артерии в области устья. Синдром приводит к обкрадыванию ствола головного мозга в пользу ишемизированной верхней конечности и подробно рассматривается в ангионеврологии [39].
Ассоциированное с мигренью ЦГ. В 2013 г. D. Yacovino и Т. Hain [15] высказали предположение о связи головокружений с патологией шейной области у пациентов с мигренью, основываясь на том, что: 1) головокружение встречается у 30% больных с мигренью [40]; 2) болями в шее страдают 35% больных с мигренью [41]; 3) доказана связь комплекса вестибулярных ядер и спинального ядра тройничного нерва [42], нижняя граница которого доходит до уровня сегментов С1—С3.
Боль в верхнешейной области способна активировать тригеминоваскулярную систему, которая может запустить как приступ мигрени, в том числе с типичной аурой, так и эпизод вертиго. В связи с этим уместно вспомнить о «шейной мигрени», описанной W. Bartschi-Rochaix в 1949 г. [43]. Позже термин был вытеснен понятием «цервикогенная головная боль» [44], что привело к концентрации внимания специалистов преимущественно на болевом компоненте страдания, а элементы ауры, включая головокружение, были преданы забвению [45].
Клиническая картина. Головокружение как основной элемент рассматриваемого синдрома развивается одновременно с цервикалгией и может представлять собой приступ истинного вертиго либо несистемного головокружения [17] продолжительностью от минут до часов. Понятие Ц.Г. неразрывно связано с шейным болевым синдромом. При этом характер боли определяется вовлеченными в патологический процесс структурами: монотонные «ломящие» суставные боли, усиливающиеся при движениях головы; тянуще-ноющие миофасциальные боли, длительно существующие или возникающие при нагрузке с усилением во время движения. «Прострелы» при движениях могут быть вызваны суставно-связочной патологией или компрессией нервных стволов. Корешковые боли или миофасциальный синдром могут возникать в лопатке, надплечье или плече, иррадиировать в затылочную или заушную область, темя, висок, глазное яблоко. В некоторых случаях дебют болевого синдрома связан с дисфункцией височно-нижнечелюстного сустава или миофасциальным синдромом жевательной мускулатуры на фоне зубных окклюзионных нарушений.
Для ЦГ характерна нередко весьма выраженная вегетативная симптоматика: тошнота, рвота, побледнение, гипергидроз, тахикардия, позывы на мочеиспускание и дефекацию. Шум в ухе и снижение слуха могут быть связаны с ишемической деполяризацией волосковых клеток или непосредственно миофасциальным синдромом мышц среднего уха. Слуховые расстройства, сохраняющиеся более 15 с, могут стать необратимыми, что проявляется нейросенсорной тугоухостью и указывает на нарушение кровообращения в системе лабиринтной артерии [15].
Диагностика. В дифференциальный ряд ЦГ входят: 1) заболевания внутреннего уха и VIII черепного нерва (доброкачественное пароксизмальное позиционное головокружение, вестибулярный нейронит, болезнь Меньера, двусторонняя вестибулопатия, фистула лабиринта, опухоль мостомозжечкового угла); 2) транзиторные атаки и инсульт в вертебрально-базилярной системе; 3) центральное вертиго; 4) мигреньассоциированное головокружение; 5) аномалии краниовертебрального перехода (Арнольда—Киари 1-го типа, базилярная импрессия, платибазия, Киммерле и др.).
ЦГ диагностируется по принципу исключения — задача непростая, поскольку среди критериев диагностики вестибулярной мигрени и болезни Меньера присутствует «исключение иных причин заболевания». Важную роль играет информация о способах купирования приступа, используемых пациентом: местные тепловые процедуры, анальгетики или триптаны, мочегонные средства, холинолитики.
Достоверного критерия диагностики ЦГ не существует, но наличие ряда составляющих считается обязательным [16, 46]: 1) исключение таких нозологических форм, как головокружение мигреньассоциированное, центральное, доброкачественное пароксизмальное позиционное, лекарственное, психогенное, ортостатическое, болезнь Меньера, вестибулярный нейронит; 2) боль в шее, связанная с головокружением; 3) травма, в том числе связанная с пульсационными техниками мануальной терапии, или заболевание шейного отдела позвоночника в анамнезе; 4) хронологическая связь дебюта боли в шее и головокружения.
Диагноз считают обоснованным при наличии критериев 1—3, последний пункт принимается во внимание при травматической этиологии процесса.
Тестов, достоверно подтверждающих связь головокружения с патологией шеи, на сегодняшний день не существует. Применяются следующие группы проб: глазодвигательные, сосудистые, постурометрические и позиционно-суставные [47—49].
Глазодвигательные функции меняются при шейной патологии неспецифическим образом; большое значение имеют некоторые виды нистагма. «Шейный нистагм» был описан A. Philipszoon и J. Bos в 1963 г [50], способ его вызывания заключался в поворотах туловища пациента вокруг вертикальной оси при фиксированном положении головы. Результат считают патологическим, если скорость нистагма превышает 2° [48]. В группу вестибулометрических тестов также входят тест плавного слежения, признаваемый положительным при скорости возникающих саккад более 2°/с [51, 52], и релокационный тест, результаты которого считают патологическими при ошибке более 4,5° [48].
Существенную помощь в диагностике проприоцептивного ЦГ оказывает мануальное исследование шейных и жевательных мышц: выявление асимметричных гипертонусов в парных мышцах, а также мышечных триггеров головокружения [53]. В то же время результаты применения постуро- и стабилометрических тестов противоречивы.
В случае подозрения на компрессионный механизм страдания ПА выполняется тест Де Кляйна: после аускультации шейных сосудов и измерения артериального давления пациент поворачивает и запрокидывает на максимальный угол голову, тест осуществляется в положении стоя или лежа и немедленно прерывается при появлении любых неприятных ощущений у пациента. Через 20—30 с от начала пробы оценивают субъективные ощущения больного (возникновение головокружения или неустойчивости), регистрируют нистагм. При диагностике ротационного синдрома ПА объективную информацию получают благодаря ультразвуковому и ангиографическому исследованию (магнитно-резонансная или компьютерная ангиография) [54, 55]. Чувствительным инструментом служит ультразвуковая допплерография ПА с повторными поворотами головы [56]: регистрация изменения линейной скорости кровотока в ПА более 15% свидетельствует об экстравазальных влияниях. Выполнение измерений при поворотах и наклонах головы позволяет судить об уровне, на котором происходит воздействие.
При помощи нейровизуализационных методов можно исключить такие причины головокружения, как патология мостомозжечкового угла, нейроваскулярный конфликт, ишемические церебральные очаги. Рентгенологически подтверждаются травматические и дегенеративные процессы в телах и суставах позвонков, межпозвонковых дисках, аномалии краниовертебральной области. Однако обнаружение патологии позвоночника или основания черепа само по себе не позволяет подтвердить диагноз ЦГ.
Лечение. Возможности лечения при ЦГ зависят от его варианта. Наиболее эффективна при синдроме Барре—Льеу транскутанная лазерная декомпрессия диска [57]: положительный эффект достигается в 70—80% случаев при иссечении поврежденных участков диска и задней продольной связки с последующей фиксацией поврежденных позвонков [58].
Спектр лечебных возможностей при ротационном синдроме ПА простирается от простых поведенческих рекомендаций (избегание поворотов головы) до применения антикоагулянтов, эндоваскулярной хирургии и декомпрессионных операций [59, 60]. Множество работ [61, 62] демонстрирует положительный эффект консервативных подходов, делая обоснованным именно такое начало лечения с дальнейшей коррекцией тактики в зависимости от полученного эффекта.
В терапии проприоцептивного ЦГ более актуальны методы физио- и мануальной терапии [63—65]. В рамках мануальной терапии целесообразно применение мягкотканных техник с осторожным использованием манипуляционных приемов [66]. Одно из редких контролируемых рандомизированных исследований, посвященных применению мануальной терапии при ЦГ, было завершено S. Reid и соавт. в 2014 г. [67]. Авторы зарегистрировали достоверный эффект апофизиального скольжения по Mulligan и пассивных мобилизаций по Maitland с сопоставимой эффективностью двух методик в ближайшем после применения периоде и в течение 12 нед.
Таким образом, противники выделения ЦГ в самостоятельную нозологическую единицу обосновывают свое мнение отсутствием специфического диагностического теста, а также возможностью объяснения большинства симптомов иными причинами. Однако все возрастающее число исследований в данной области и накопление данных приводят к постепенному изменению взглядов ведущих отоневрологов мира на ЦГ [19, 62, 68].
Еще один аргумент основан на отсутствии четкой связи между степенью выраженности локальных изменений позвонков и дисков и интенсивностью болей. Объяснить данный феномен можно сохранной подвижностью шейных позвоночных двигательных сегментов при начальных изменениях костно-суставного аппарата. Высокая подвижность приводит к существенному воздействию на рецепторные элементы. При прогрессировании патологии амплитуда движения позвонков убывает, что влечет за собой снижение ирритации воспринимающих структур.
Описанные варианты ЦГ целесообразно рассматривать как элементы единого патогенетического процесса в рамках одной нозологической формы. Прежде всего дистрофические явления при остеохондрозе и спондилезе вовлекают межпозвонковые диски, тела позвонков и межпозвонковые суставы. Как следствие, развиваются блоки и нестабильность позвоночных двигательных сегментов, подвывихи и спондилолистезы, что вызывает нарушение тонуса шейных мышц и связок, приводящее к ирритации симпатических нервных окончаний в этих структурах, т. е. одновременно формируется основа синдрома Барре—Льеу, проприоцептивного головокружения и шейной мигрени. Костно-связочные изменения и миофасциальный синдром могут создать условия для компрессии ПА, ротационного синдрома. Нам удалось продемонстрировать, что собственно нестабильность шейных позвоночных двигательных сегментов ведет к изменению скорости кровотока и достоверному нарушению реактивности ПА при пробах с поворотами головы [69], а стимуляция триггерных точек в кивательной мышце может провоцировать приступы меньеровского типа [70]. Аналогичным образом могут развиваться изменения после хлыстовой травмы (рис. 2). 
Таким образом, описанные разновидности ЦГ могут сосуществовать у одного больного в составе единого многокомпонентного патофизиологического процесса. Доминирующий процесс определяет клиническую картину в каждый конкретный момент времени, а изменение превалирующего механизма приводит к появлению нового симптомокомплекса. Большое влияние на результирующий синдром оказывают не только локальные шейные особенности, но и взаимодействие всех компонентов постуральной системы. Помимо описанных явлений, мышечный тонус находится под прямым воздействием стрессорных факторов, а психоэмоциональный фон оказывает существенное влияние на порог болевой чувствительности и клиническую картину ЦГ в целом.
Для уточнения предлагаемых положений требуются контролируемые рандомизированные исследования.
Авторы заявляют об отсутствии конфликта интересов.
Головокружение, обусловленное патологией шейного отдела позвоночника
Головокружение и отоневрологические симптомы описаны при различных видах патологии в области шеи: травматических повреждениях шеи и спинного мозга [4, 5, 10], шейном остеохондрозе [2], окклюзии позвоночной артерии (ПА) [
Головокружение и отоневрологические симптомы описаны при различных видах патологии в области шеи: травматических повреждениях шеи и спинного мозга [4, 5, 10], шейном остеохондрозе [2], окклюзии позвоночной артерии (ПА) [1, 3, 12] и инсультах, обусловленных повреждениями ПА [1, 11, 13, 15], диссекции ПА, в связи с движением шеи или манипуляцией на шейном отделе позвоночника [6, 7, 8, 9, 11, 14].
Выделение вертеброгенного головокружения обусловлено распространенностью патологии среди лиц молодого возраста, тяжестью течения заболевания, разнообразием симптоматики, возникновением инсультов при манипуляциях на шее.
Отличительной особенностью вертеброгенного головокружения является острое начало, связанное с определенной позицией головы (наклон вперед, запрокидывание назад, резкий поворот в сторону и др.), часто утром, после сна. Головокружение, которое возникает в результате изменения позиции головы, может быть обусловлено как раздражением внутреннего уха, так и центральных вестибулярных структур головного мозга (ствола, мозжечка). Компрессия артерий развивается при остеофитах и боковых грыжах дисков в унковертебральных областях, передних экзостозах суставных отростков, а также при подвывихе.
Отоневрологическое обследование пациента позволяет провести точную топическую диагностику, а также дифференциальную диагностику от периферического головокружения, обусловленного другими заболеваниями: болезнью Меньера, доброкачественным пароксизмальным позиционным головокружением, вестибулярным нейронитом.
Барре (1926), впервые обративший внимание на связь отоневрологических симптомов с патологией в области шеи, описал их под названием «задний шейный симпатический синдром», указывая при этом на значение связи головы и шеи при помощи симпатической нервной системы.
Показано, что углубленное исследование ПА с учетом не только диаметра и особенностей кровотока, но и с применением функциональных проб позволяет выявить моменты, важные для дифференциальной диагностики между гемодинамически значимой и незначимой экстравазальной компрессией ПА.
Повреждающее действие экстравазальных факторов компрессии направлено, прежде всего, на ее нервное сплетение. Раздражение позвоночного нерва, повышая тонус ПА, может уменьшить скорость объемного кровотока в ней на 30% от исходной величины, на 40% в ветвях основной артерии, в частности внутреннего уха [1].
Таким образом, функциональное состояние позвоночного нерва и структурные изменения ПА являются основой для развития недостаточности кровотока в вертебрально-базилярной системе (ВБС) на экстра- и интракраниальном уровне. Как подчеркивают различные авторы, кохлеовестибулярный синдром может развиваться при недостаточности кровообращения в ВБС как в области внутреннего уха, так и в области вестибулярных ядер и проводящих путей ствола головного мозга, мозжечка.
Кроме нарушений кровоснабжения ВБС, в патогенезе вертеброгенного головокружения также играет роль нарушенная проприоцептивная нервная импульсация со стороны структур шеи. Движения в измененных остеохондрозом и спондилоартрозом суставах шейных позвонков, дисках, а также возникающее тоническое напряжение мышц способствуют развитию неадекватной афферентной импульсации и неправильной оценке вестибулярной системой информации о позиции головы, что вызывает ощущение головокружения и нарушения равновесия.
Целью проведенной на базе НЦ неврологии РАМН работы было выявление клинических особенностей и отоневрологической симптоматики у больных с вертеброгенным головокружением на фоне патологических изменений в шейном отделе позвоночника, а также сопоставление вестибулярных нарушений со структурными изменениями ПА, уровнем артериального давления, состоянием внутренних яремных вен.
Нами проведено обследование 115 больных с острой и хронической недостаточностью кровообращения в ВБС, в том числе 47 пациентов с наличием дегенеративно-дистрофических изменений в шейном отделе позвоночника, из них у 33 — дегенеративные изменения (остеохондроз), у 9 — краниовертебральная патология, аномалия Киммерли, у 4 больных аномалия вхождения ПА в канал на уровне С4, стеноз позвоночного канала — у одной больной. Возраст больных колебался от 28 до 74 лет.
Основными заболеваниями, на фоне которых развивались вестибулярные нарушения, были артериальная гипертония (АГ) в сочетании с атеросклерозом, вегетативно-сосудистая дистония, остеохондроз.
Всем больным проведено полное классическое отоневрологическое обследование, включающее исследование спонтанных и экспериментальных вестибулярных реакций (вращательная и калорическая пробы) и слуха. Исследование слухового анализатора проводилось с использованием аудиометрии и слуховых вызванных потенциалов.
Структурные изменения магистральных артерий головы (МАГ) и гемодинамические показатели кровотока по ПА и внутренней сонной артерии (ВСА) изучали с помощью ультразвукового дуплексного сканирования МАГ (ДС МАГ) с функциональными пробами, в ряде случаев при проведении спиральной компьютерной томографии (СКТ), магнитно-резонансой ангиографии.
Результаты
Отоневрологическое обследование позволило разделить больных на две группы: 45 больных с периферическим вестибулярным синдромом (ПВС) и 70 больных с центральным вестибулярным синдромом (ЦВС).
С целью выявления гемодинамических особенностей, на фоне которых развиваются ПВС и ЦВС, нами проводилось сопоставление наличия ПВС и ЦВС с состоянием кровотока по ПА по данным ДС МАГ (см. табл. на стр. 55 «Структурные изменения сосудов вертебрально-базилярной системы у больных с вертеброгенным головокружением»). Как видно из таблицы, ПВС сопровождался определенными структурными изменениями ПА — гипоплазия и асимметрия диаметров встречались наиболее часто.
ЦВС гетерогенны и развиваются у больных с вертебрально-базилярной недостаточностью на основе гипертонии, атеросклероза, диссекции ПА (спонтанной или травматической), приводящих к формированию мелких ишемических очагов в стволе головного мозга и мозжечке. Вестибулярные нарушения при центральном синдроме отличаются более тяжелым клиническим проявлением по сравнению с периферическим синдромом. При этом возможности компенсации нарушенных функций существенно снижены, вследствие непосредственного поражения вестибулярных ядер ствола. Установлено, что в патогенезе ЦВС важное значение имеет наличие у больных односторонних гемодинамически значимых стенозов и окклюзий ПА, двусторонних ее деформаций и извитостей (см. табл. на стр. 55 «Структурные изменения сосудов вертебрально-базилярной системы у больных с вертеброгенным головокружением»).
Механизм развития головокружения у пациентов с остеохондрозом шейного отдела позвоночника в 21 (45%) наблюдении обусловлен экстравазальной компрессией, которая была зарегистрирована на различных уровнях, чаще С3–С4, С5–С6 позвонков с обеих сторон. В 25 случаях (55%) была выявлена экстравазальная компрессия доминирующей ПА, причем у этой группы больных выявлялась симптоматика периферического кохлеовестибулярного синдрома на стороне компрессии. У этих же больных была выявлена гипоплазия одной ПА с другой стороны или асимметрия диаметров ПА с гемодинамическим преобладанием по одной из них.
Клинический пример
У больного 25 лет утром после сна появилось системное вращательное головокружение, тошнота, рвота, шум в левом ухе. Постепенно головокружение уменьшалось, но не исчезало несколько дней; любое изменение положения приводило к усилению головокружения, сохранялся шум в ухе.
При отоневрологическом осмотре в научно-консультативном отделении НЦ неврологии РАМН у больного выявлялась симптоматика со стороны левого мостомозжечкового угла: снижен роговичный рефлекс справа и чувствительность слизистой полости носа и полости рта (V пара черепно-мозговых нервов (ЧМН)), снижены вкусовые ощущения на передних 2/3 языка справа (VII пара ЧМН), односторонний спонтанный нистагм вправо. При проведении вращательной пробы отмечается асимметрия по лабиринту с раздражением справа и нейросенсорная тугоухость I степени.
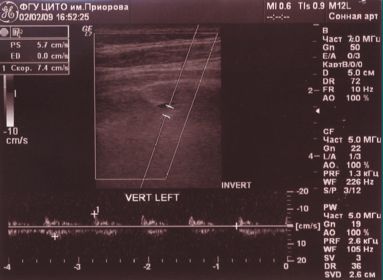
Обоняние — не нарушено, в позе Ромберга — неустойчив, отклоняется влево, пальценосовую пробу выполняет с обеих сторон. При проведении ДС МАГ — диаметр левой ПА — 1,6 мм (гипоплазия), артерии проходимы, входят в канал на уровне С6 позвонка, имеют прямолинейный ход и стабильные показатели линейной скорости кровотока (ЛСК): справа 34 см/с, слева регистрируется низкоамплитудный кровоток в сегменте V3 — 7,4 см/с периферического типа (рис. 2).
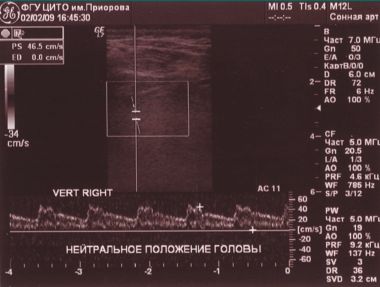
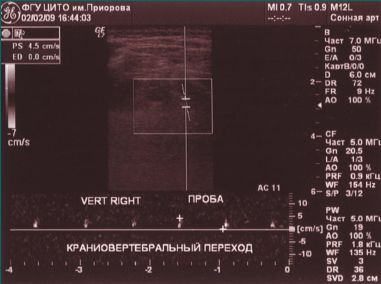
При проведении функциональных проб на уровне краниовертебрального перехода кровоток по правой ПА не регистрируется (рис. 3, 4).
На рентгенограмме шейного отдела позвоночника выявлены изменения в виде смещения вперед позвонков С2–С4 по типу лестничных, определяется вариант Киммерли. Таким образом, головокружение и шум в ухе возникли у больного в результате недостаточности кровоснабжения в конечных артериях ВБС, обусловленной наличием структурных и гемодинамических изменений в ПА. Важным в этом клиническом случае является подтверждение снижения кровотока по ПА при дуплексном ультразвуковом исследовании, позволяющем выявить снижение кровотока при выполнении функциональных проб.
Периферическое головокружение (ПГ) может быть обусловлено болезнью Меньера, вирусным поражением вестибулярного ганглия и доброкачественным позиционным головокружением. В основе диагностики ПГ ишемической природы основное значение принадлежит результатам отоневрологического обследования, при котором выявляется не только симптоматика поражения внутреннего уха, но и других ЧМН, кровоснабжение которых осуществляется артериями ВБС.
Важное значение имеет сопоставление результатов отоневрологического обследования с результатами ДС ПА, которое проводится с применением функциональных проб, а также оценка состояния внутренних яремных вен на шее.
Дифференциальная диагностика
Своеобразие кохлеовестибулярных синдромов составляет основу дифференциальной диагностики заболеваний внутреннего уха и ретролабиринтной патологии (см. табл. на стр. 55 «Дифференциальная диагностика вестибулярных синдромов при болезни Меньера, центральном вестибулярном синдроме, периферическом вестибулярном синдроме и доброкачественном пароксизмальном позиционном головокружении»).
Лечение вертеброгенного вестибулярного головокружения
Терапия цервикального синдрома включает снятие болевого синдрома и мышечного напряжения. С этой целью рекомендованы нестероидные противовоспалительные препараты (НПВП), которые оказывают выраженное противовоспалительное и противоотечное действие. Массаж шейно-воротниковой зоны возможен только после уточнения структурных и гемодинамических изменений в магистральных сосудах головы.
Терапия вестибулярных нарушений включает вестибулолитические средства, которые назначаются до получения стойкого положительного эффекта, в среднем 2–3 месяца и более. Предпочтение отдается бетагистину гидрохлориду (Бетасерк), который обладает двойным механизмом действия: улучшает кровообращение внутреннего уха в ВБС, а также компенсаторные возможности вестибулярных ядер ствола головного мозга. Бетасерк обладает прямым стимулирующим действием на гистаминовые Н1-рецепторы внутреннего уха и опосредованное — на Н3-рецепторы вестибулярных ядер, нормализуя трансмиттерную передачу в нейронах медиальных ядер ствола головного мозга. Бетасерк нормализует нарушения вестибулярного аппарата, уменьшая выраженность головокружения, уменьшает шум в ушах, улучшает слух. Бетасерк назначают по 24 мг 2 раза в день после еды в течение нескольких месяцев. Препарат в дозе 48 мг в сутки эффективно уменьшает головокружение, практически не имеет противопоказаний, хорошо переносится пожилыми пациентами. Из побочных действий возможны легкие желудочно-кишечные расстройства, обычно быстро проходящие. Важное преимущество препарата — отсутствие седативного эффекта.